预乳化对大豆蛋白-猪肌原纤维蛋白混合凝胶性质的影响
安丰富,何志勇,秦 昉,曾茂茂,黄小林,陈 洁
(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
大豆分离蛋白(SPI)是优质的植物蛋白,商业大豆分离蛋白被广泛应用于乳化香肠等低温肉制品中[1-2]。但是,由于 SPI在 80℃ 条件下形成的凝胶,其性能弱于同等条件下肌原纤维蛋白(MPI)所形成的凝胶,当SPI应用于肉制品中往往会导致肉制品凝胶强度和持水力的凝胶性质的显著下降。针对此,国内外有大量研究通过改造SPI、在肉制品中同步添加多糖和磷酸盐等添加剂等手段提升SPI在肉制品中的应用效果[3-4]。预乳化是近年来提出的一种在蛋白食品加工中提升凝胶性质的新的加工方法。研究显示,MPI,乳清蛋白等蛋白经过添加油脂预先乳化,可以有效提高产物的凝胶性质[5-6]。大豆蛋白具有良好的乳化性,如果利用SPI的乳化性,预乳化油脂,能够显著改善大豆蛋白的凝胶性质。本论文以SPI-MPI混合凝胶性质体系为模型体系,以自制未变性SPI和商业化SPI为原料,研究SPI预乳化对SPI-MPI混合凝胶性质的影响,以期为大豆蛋白的利用提供新的思路和方法。
1 材料与方法
1.1 材料与设备
低温脱脂豆粕 秦皇岛益海一嘉里集团;商业SPI 山东万得福实业集团;新鲜猪里脊肉购自当地的市场(屠宰 24~48h后,pH5.6~5.9),低温保存;大豆油 中粮集团;氢氧化钠、浓盐酸、浓硫酸、氯化钠、氯化镁、乙二醇二乙醚二胺四乙酸(EGTA)、十二烷基磺酸钠(SDS)、磷酸氢二钠、磷酸二氢钠 中国医药集团上海化学试剂公司。
QZ-5高速离心喷雾干燥机 锡山市林洲干燥机厂;Avanti J-26 XP高速离心机 美国Beckman公司;JB5374-91电子天平 瑞士 Mettler-Toledo有限公司;磁力搅拌器 广州仪科实验仪器有限公司;恒温水浴锅 江苏金坛市荣华仪器制造有限公司;高速组织捣碎机 上海精科实业有限公司;UV-3802紫外可见分光光度计 上海尤尼柯公司;Ultraturrax乳化均质机 德国IKA公司;TA-XT2i质构仪 英国Stable Micro Systems公司;AR-G2流变仪 英国TA Instrument公司。
1.2 实验方法
1.2.1 大豆分离蛋白的提取 SPI的提取方法主要参考Feng和Xiong[7]的方法,有所改变。室温下豆粕按1∶8加水,利用2mol/L NaOH 调节 pH8.0,搅拌1h,10000×g离心10min,取上清液。利用2mol/L HCl调节pH 到4.5,静置30min,3300×g离心10min,沉淀复溶,利用2mol/L NaOH调节pH到7.0,喷雾干燥得到大豆分离蛋白产品,喷雾干燥时进口温度为180℃,出口温度为80℃。产品作为对照SPI。
1.2.2 SPI乳化性的测定 参考Molina[8]的实验方法,配成蛋白浓度1%(w/v)的溶液,取15mL蛋白溶液与5mL大豆油混合,放入100mL玻璃大试管中。在高速乳化均质机下13500r/min乳化2min,将乳化液迅速倒入25mL小烧杯中,立即开始取样。取样点固定在离烧杯底部0.5cm处,取20μL的乳状液与0.1%的SDS溶液5mL均匀混合,在500nm处测定其吸光值,记为A0,乳状液静置30min后采用相同的方法测定乳状液吸光值,记为A30,用0.1%的SDS做空白对照。
乳化性:

乳化稳定性:

式中,EAI:乳化性,ESI:乳化稳定性,T=2.303,N:稀释倍数250,C:乳化液形成前蛋白质水溶液中蛋白质浓度(g/mL),φ:乳化液中油的体积分数(0.25)。
1.2.3 肌原纤维蛋白的提取 根据Xiong和Brekke的方法[9],猪瘦肉切碎称重,加入4倍体积的分离缓冲液(0.1mol/L NaCl,10mmol/L磷酸盐缓冲液,2mmol/L MgCl2,1mmol/L EGTA,pH7.0),在组织捣碎机中充分斩拌混匀;500mL离心管在2000×g,4℃条件下离心12min,得到肌原纤维沉淀,用相同的缓冲液重复两遍,然后用0.1mol/L NaCl的溶液再重复两遍,得到的肌原纤维蛋白分离物用碎冰保存,利用0.6mol/L NaCl配制4%的MPI溶液。
1.2.4 蛋白溶液预处理及凝胶的制备 用含0.6mol/L NaCl的缓冲溶液(pH7.0)配制12%(w/w)的SPI溶液,取出30mL利用50mL离心管在800r/min 4℃条件下离心1min脱气,作为SPI空白对照;将SPI溶液与4%(w/w)的MPI溶液按照1∶1(w/w)混合,取出30mL,再次同上离心脱气,作为SPI-MPI混合蛋白溶液,其中SPI的浓度为6%,MPI的浓度为2%。
将SPI,含0.6 mol/L NaCl的缓冲溶液(pH7.0),大豆油按12∶44∶44 的比例混合,采用 Ultra-turrax乳化均质机以13500r/min进行乳化均质,时间分别为0、30、60、90、120s,取 30mL,在 800r/min 4℃ 条件下离心1min脱气,作为乳化SPI溶液。将此溶液与4%(w/w)的 MPI溶液按照1∶1(w/w)混合后,取30mL,再次同上离心脱气,产物作为乳化SPI-MPI混合蛋白溶液,其中SPI的浓度为6%,MPI的浓度为2%。
上述四种蛋白溶液分别移取25mL转移至50mL小烧杯中,保鲜膜封口。置于80℃的超级恒温水浴锅中,保温30min,取出转移至碎冰中迅速冷却,形成蛋白凝胶,在4℃冷室中过夜备用。
1.2.5 凝胶强度的测定 凝胶强度的测定参考王婵秋[10]的方法,略有改动。将制备好的凝胶,取出室温下平衡30min,用质构仪测定凝胶强度。主要参数为:探头类型为 P/0.5,测前速度1mm/s,测试速度1mm/s,测后速度10mm/s,穿刺距离4mm,触发类型为自动,触发力为5g。凝胶强度用硬度(Hardness)即探头下压过程中的最大感应力(单位g)表示。
1.2.6 弹性模量G'的测定 参考Renkema[11]等人的实验方法,略有改动。利用流变仪,对上述四种蛋白样品进行温度扫描。主要参数为:平板夹具直径40mm,最大应变力为0.01,单频频率为0.1Hz,狭缝为1mm,以5℃/min的速率从20℃升至80℃,每个温度点的平衡时间为20s。滴加几滴硅油并盖好保护盖,防止水分蒸发。测量过程中G'随温度的变化。
1.2.7 凝胶持水性的测定 制备的混合蛋白凝胶在4℃冰箱中过夜后,将凝胶块转移至50mL的离心管中,在10000r/min 4℃条件下离心15min。倒掉离出的水,将离心管倒置于铺有吸水毛巾的桌面上,15min后称重。
持水性(%)=离心后凝胶净重/离心前凝胶净重×100
1.3 数据统计分析
本实验数据均为2次重复3次平行,使用Statistix软件,采用LSD方法对数据进行显著性统计分析(p<0.05),数值采用均值±标准偏差表示,使用origin 8.0作图。
2 结果与分析
2.1 预乳化时间对SPI凝胶强度的影响
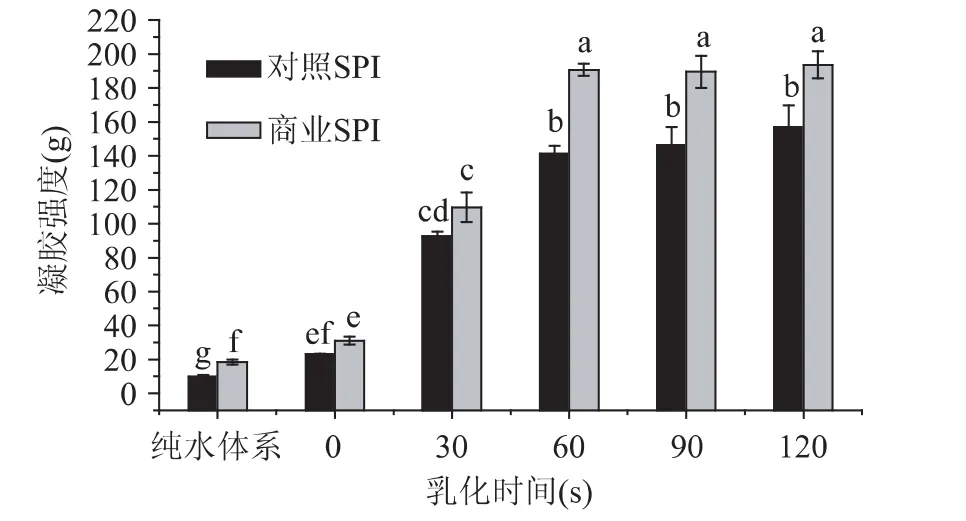
图1 预乳化时间对大豆分离蛋白凝胶强度的影响Fig.1 The effect of the pre-emulsification time on the gels strength of SPI
预乳化时间对SPI混合凝胶强度的影响如图1所示,从图中可以看出,随着均质乳化时间的增加,乳化后的SPI的凝胶强度明显增加,乳化60s后凝胶强度趋于稳定。这个结果暗示,预乳化形成良好乳化稳定性以及大小分布均匀的油滴对于形成良好的SPI凝胶是必要的。另外,从图中还可以看出,整体而言,商业SPI凝胶强度均优于未变性的自制SPI。分析其原因可能是商业SPI具有较好的乳化性(如表1所示)。商业SPI一般采用碱溶酸沉工艺,但是其往往在喷雾干燥前会采用高温瞬时水热处理,这种处理可能导致 SPI的部分变性[12]。韩丽华[13]的研究也发现,适度加热预处理,可以使SPI的乳化性和乳化稳定性提高。

表1 对照SPI与商业SPI的乳化性和乳化稳定性Table 1 The EAI and ESI of the native SPI and commercial SPI
2.2 预乳化对混合凝胶强度的影响
预乳化对大豆蛋白-肌纤维蛋白混合蛋白弹性模量的影响如图2所示。从图中可以看出,上述混合蛋白的G'值都大约在42℃时开始增大,这是基于肌球蛋白不同部分有不同的变性温度,此时重酶解肌球蛋白开始变性,导致肌球蛋白长丝的交联。46℃时G'达到最大值后又下降,是因为酶解肌球蛋白轻链开始变性,增加了蛋白的流动性。55℃时G'回落到最小值后又上升,其原因很可能是形成了永久性、不可逆的肌动球蛋白交联体。两种12%SPI以及SPI-MPI混合物,在20~80℃范围内加热,样品弹性模量几乎都没有显著变化,这个结果暗示,对于SPI而言,80℃温度加热不足以形成强凝胶;而对于SPI-MPI体系,由于体系中MPI浓度低,形成凝胶骨架弱,而6%的SPI本身不足以形成凝胶,由于其变性温度较高,也不足以在80℃以下温度促进混合蛋白凝胶的形成。

图2 预乳化对混合蛋白弹性模量的影响Fig.2 The effect of the pre-emulsification on the storage modulus of SPI and MPI
无论是对照SPI还是商业SPI,预乳化的12%SPI的弹性模量显著上升;乳化SPI-MPI的产物性能与4%MPI非常接近,其中乳化对照SPI-MPI混合体系其加热曲线与4%MPI非常相似,尽管最终G'略低;而乳化商业SPI-MPI混合体系尽管弹性模量曲线和4%MPI不尽相似,但是最终G'极为接近。上述结果说明,乳化后的油脂能够增强蛋白凝胶性质,预乳化可以极大提升大豆蛋白的G',从而促使预乳化的12%SPI与4%MPI 1∶1的混合凝胶在80℃的G'接近于 4%MPI的 G'。Xiong 和 Kinsella[6]等人的研究也得到类似结果,在以牛奶为基础的凝胶中,利用乳清蛋白乳化猪油,提高了牛奶体系的弹性模量。
预乳化对大豆蛋白-肌纤维蛋白混合蛋白凝胶强度的影响如图3所示,预乳化能够显著提高SPIMPI混合凝胶的凝胶强度,商业SPI对混合凝胶的凝胶强度的增强效应显著高于未变性的对照SPI,与MPI的凝胶强度接近。这个结果进一步说明,乳化后的油脂能够增强蛋白凝胶的强度,利用SPI预乳化油脂,可以大幅度提升 SPI-MPI混合凝胶的强度。Xiong[14]等人证实了利用肌原纤维蛋白乳化猪油等四种油脂,能显著提高鸡肉肌原纤维蛋白的凝胶强度。同时该结果也暗示,经过热处理有部分变性的商业SPI可能由于其具有更强的乳化效应而使混合凝胶的产物凝胶强度优于未变性的SPI的效应。
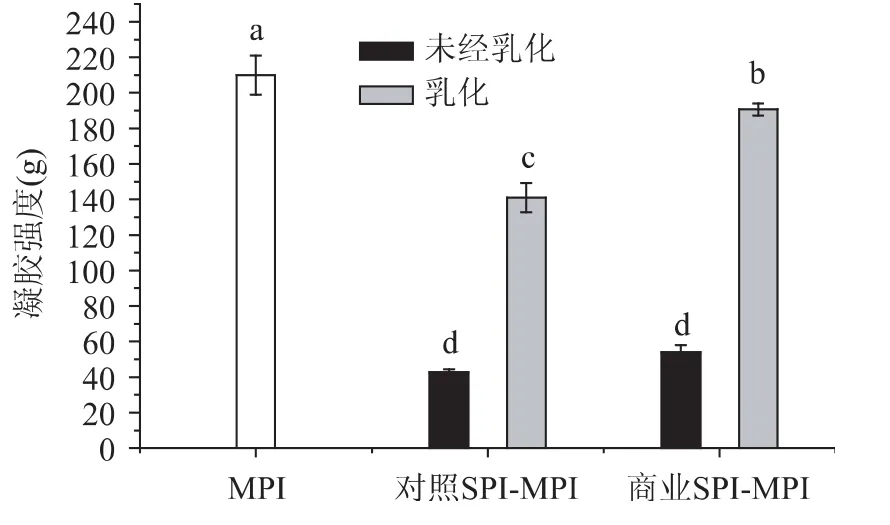
图3 预乳化对混合蛋白凝胶强度的影响Fig.3 The effect of pre-emulsification on the gels strength of the mixed gels of SPI and MPI
2.3 预乳化对混合蛋白凝胶持水性的影响
预乳化对大豆蛋白-肌纤维蛋白混合蛋白持水性的影响如图4所示,预乳化显著提高SPI-MPI混合凝胶的持水性,从未经过预乳化的蛋白的53%提高到了70%左右,接近4%MPI凝胶的持水性。这个结果说明预乳化对混合蛋白凝胶持水性具有提升作用,一方面,由于大豆油的添加,降低了整体的水分含量,减少水分的蒸发量;另一方面,乳化体系的存在,可以使凝胶网络更为紧凑,增强凝胶网络的毛细管作用,固定更多的水分[5]。商业SPI与未经过热变性的SPI的效应从统计角度无显著差异,说明原料SPI的变性与否或者热处理与否与产物凝胶的持水性关联度不大。

图4 预乳化对混合蛋白凝胶持水性的影响Fig.4 The effect of pre-emulsification on the the WHC of the mixed gels of SPI and MPI
3 结论
预乳化处理能够显著提高SPI-MPI混合凝胶的性质,商业SPI经过预乳化后形成的商业SPI-MPI混合凝胶的凝胶强度和持水力更接近MPI单独形成的凝胶强度和持水力,改善了SPI-MPI混合凝胶强度弱,持水力差的问题。研究结果表明具有较好乳化性能的SPI能够更好的发挥预乳化在SPI-MPI混合凝胶中的作用,这也为SPI的利用提供了一种先提高SPI的乳化性,再经过预乳化添加到肉制品中的思路和方法。
[1]李应彪,李开雄,童军茂,等.大豆蛋白在火腿肠生产中的应用[J].肉类研究,1999(4):44-45.
[2]张福,杨艳敏.大豆蛋白在肉制品中的重要作用[J].肉类工业,2005(1):34-36.
[3]马霞,关凤霞,魏述众,等.提高国产大豆分离蛋白应用性能的研究[J].江苏食品与发酵,2001(3):34-36.
[4]马宇翔,周瑞宝,黄贤校,等.脂肪、盐和大豆分离蛋白对肉糜的影响[J].肉类工业,2004(8):12-15.
[5]Wu M G,Xiong Y L,Chen J.Rheological and microstructural propertiesofporcine myofibrillar protein-lipid emulsion composite gels[J].Journal of Food Science,2009,72(4):207-217.
[6]Xiong Y L,Kinsella J E.Influence of fat globule membrane composition and fat type on the theological Properties of milkbased composite gels[J].Milchwissenschaft- milk science international,1991,46:207-212.
[7]Feng J,Xiong Y L.Interaction and functionality of mixed myofibrillar and enzyme- hydrolyzed soy proteins[J].Journal of Food Science,2003,68(3):803-809.
[8]Molina E,Ledward D A.Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J].Food Hydrocolloid,2001,15(3):263—269.
[9]Xiong Y L,Brekke C J.Gelation properties of chicken myofibrils treated with calcium and magnesium chlorides[J].Journal of Muscle Foods,1991,2(1):21-36.
[10]王婵秋,迟玉杰.乙醇、氯化钙和抗坏血酸对大豆分离蛋白凝胶性质的影响[J].中国粮油学报,2010(7):39-42.
[11]Renkema J M S,Gruppen H,Vliet T V.Influence of pH and ionic strength on heat-induced formation and rheological properties of soy protein gels in relation to denaturation and their protein compositions[J].Journal of Agricultural and Food Chemistry,2002,50(21):6064-6071.
[12]张海瑞,何志勇,秦昉,等.热处理制备高凝胶性大豆分离蛋白的工艺[J].食品与发酵工业,2012(3):81-84.
[13]韩丽华.高乳化性大豆蛋白的研制[D].无锡;江南大学,2011.
[14]Xiong Y L,Blanehard S P,Means W J.Properties of broiler myofibril gels containing emulsified lipids[J].Poultry Science,1992,71(9):1548-1555.

