益生菌对治疗口腔疾病的研究
肖 蒙,孟昭旭,彭 悦,杜 鹏,霍贵成
(东北农业大学,乳品科学教育部重点实验室,黑龙江哈尔滨150000)
益生菌(probiotics)是达到一定的数量并对人体有益的微生物的总称。乳酸菌是益生菌中的重要组成部分,其中主要包括乳杆菌、双歧杆菌、嗜热链球菌、不具有致病性的大肠杆菌、肠球菌、芽孢杆菌、酵母等。关于乳酸菌的发现最早可以追溯到20世纪初,俄国生物学家,诺贝尔奖的获得者Mechnikoff在他的“长寿学说”中指出保加利亚地区的人之所以长寿,原因是他们食用的酸奶中富含一种对人体肠道有益的乳酸菌[1]。随着科学研究的深入,人们对乳酸菌的研究已经不仅局限在食品领域,而是逐渐把研究热点转向利用乳酸菌治疗一些人体常见疾病,如胃肠道疾病、阴道炎、胰腺炎、乳房炎、腹泻、口腔疾病、湿疹、便秘、皮肤炎等。通过文献报道,乳酸菌治疗疾病的机理主要如图1[2]所示。由于考虑到不同疾病的发病机理、乳酸菌对不同疾病治疗机理、治愈状况等存在差异性,所以本文主要针对口腔疾病进行探讨。口腔中大约含有700种微生物,由30~100个种组成,它们寄生在口腔黏膜、牙齿、舌头上以及唾液中,这些微生物共同保卫人体的口腔健康。当内在或外在因素变化造成口腔中的微生态系统失去平衡时,就易引起常见的口腔疾病,如龋齿、牙周炎、牙龈炎和口臭等。Kragen H[3]是最早对乳酸菌治疗口腔疾病进行研究的学者,他开启了此领域的先河。
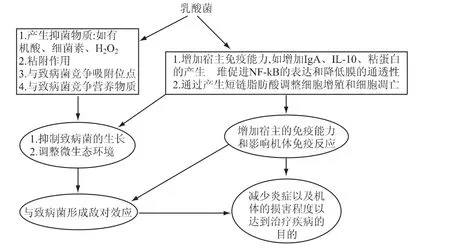
图1 乳酸菌治疗疾病的机理Fig.1 The mechanism of lactic acid bacteria cure diseases
1 龋齿
1.1 造成龋齿的微生物种类
龋齿是一种发病率极高的口腔疾病,主要由产酸,以及耐酸能力强的变形链球菌(Streptococcus mutans)和乳杆菌引起[4]。大量研究表明,变形链球菌是造成龋齿的主要原因[5]。同时,也有学者指出少部分唾液链球菌(Streptococcus salivarius)同样能增加患龋齿的风险[6-7]。Becker[8]通过分子生物学方法对龋齿患者口腔菌群进行检测,结果发现患者口腔中戈氏放线菌(Actinomyces gerencseriae),双歧杆菌(Bifidobacterium),韦永氏球菌(Veilonclla),唾液链球菌(Streptococcus salivarius),变形链球菌(Streptococcus mutans),星座链球菌(Streptococcus constellatus),血链球菌 (Streptococcussanguis),发酵乳杆菌(Lactobacillus fermentum)含量明显比健康人高。由于大多数益生菌能通过发酵乳糖产生乳酸,而乳酸又能促进龋齿的发生,所以也有少量文献提出,用益生菌来治疗龋齿有一定的弊端,如 Fitzgerald RJ[9]明确指出,在初期致龋过程中乳酸杆菌并不致龋,龋坏进入深层时,乳酸杆菌由于其较强的耐酸性而大量繁殖并产酸,协同变形链球菌致龋。可见,造成人龋齿的口腔微生态系统和机理较复杂,菌种多样性及各菌之间的相互联系仍需要进一步研究。
1.2 治疗龋齿益生菌的筛选与改良
虽然益生菌的来源非常广泛,但学者们还是经常从人体自身筛选出益生菌,用于治疗相应的疾病,因为,从其应用的器官中筛选的益生菌才能长期定植在所需部位而达到良好的治疗效果[10]。如Simark-Mattsson C从健康人的口腔中筛选出23株能抑制变形链球菌生长的乳杆菌,并指出其中干酪乳杆菌(Lactobacilluscasei)、植物乳杆菌(Lactobacillus plantarum)、鼠李糖乳杆菌(Lactobacillus rhamnosus)的抑菌效果最好[11]。这表明了从人的口腔中筛选出的益生菌的确具有治疗龋齿的潜在价值。
同时,经过基因工程改良的菌株在工程上应用成功的案例很多,但将工程菌用于人体疾病治疗领域的成功案例很少。经过基因手段改良的变形链球菌A2JM虽然在营养成分要素需求上要求较高,但它不仅不具备了致龋性,而且还能显著降低龋齿发病率[12]。这为之后通过基因工程改良益生菌的生物性状,为其将来应用于各种疾病治疗上指明了方向。
1.3 不同的食用方式和益生菌对治疗龋齿的影响
众所周知,酸奶、干酪是人体摄入乳酸菌的重要途径,所以很多研究者让实验对象食用含有特定乳酸菌的酸奶、干酪,从而研究不同的乳酸菌对治疗龋齿的影响。Nase L等[13]对594个1~6岁的孩子进行人体实验,让实验对象食用了含有鼠李糖乳杆菌(LGG)发酵的酸奶,7个月后龋齿发病率明显比不食用的孩子低,而且变形链球菌的数量也更少。Ahola AJ[14]也对LGG进行了相关人体实验研究,与前者的不同之处是把酸奶换成了干酪,结果发现食用了含LGG的干酪后不仅能降低口腔中的变形链球菌数目,还能降低口腔中的酵母数目。这两个实验不足之处在于没有对小孩做喂养普通酸奶(或普通干酪)的对照实验,所以不能完全确定是酸奶(或干酪)还是LGG造成的治疗效果。但其它很多研究也已经表明,LGG的确具有明显的抗龋齿和其它保健功能,而且它已经成功应用于国际市场,表现出了益生菌行业广阔的市场前景。
另外,Caglar E[15]让 24 个人食用含乳双歧杆菌(Bifidobacterium lactis)Bb-12的冰淇淋40天之后,检测其口腔菌群的变化。虽然唾液中的乳杆菌数量变化很小,但变形链球菌数目明显减少。Nikawa H,Petti S和Comelli EM通过各自的抑菌实验也都表明罗伊氏乳杆菌(Lactobacillus reuteri),普通酸奶等都能抑制诸多致龋病菌的生长[16-18]。由此可见,乳双歧杆菌Bb-12和罗伊氏乳杆菌等乳酸菌都具有应用于市场抗龋产品的潜在价值,但它们在人体实验以及定植能力上还要进行深入研究。
1.4 益生菌治疗龋齿机理
1.4.1 益生菌的粘附作用 粘附能力的大小是益生菌益生功能强弱的重要指标之一,因为只有较强粘附能力的乳酸菌才能长时间定植在口腔中发挥益生功能,才能降低龋齿复发率。计算乳酸菌对细胞的粘附数量是测定乳酸菌的粘附能力的常用手段,但由于考虑到口腔环境的特殊性,所以研究者发明了一种专门筛选治疗龋齿的益生菌的实验方法,即向液体培养基中插入一条玻璃管,用此玻璃棒模拟牙齿,将乳酸菌培养一段时间后测定玻璃管上粘附的细菌数,从而检测各乳酸菌的粘附能力[19]。这为之后测定治疗龋齿的益生菌的粘附能力奠定了基础。
更深层次对粘附机制的研究也是目前学者们研究的热点问题。关于乳酸菌粘附机制的争论主要集中在菌体产生的胞外多糖和菌体的疏水性质这两个方面。Kralj S[20]指出细菌胞外多糖是细菌对口腔进行粘附的关键因素,其中的葡聚糖就是胞外多糖中增加菌体粘附能力的典型代表。但也有研究者对此持反对意见,并指出乳杆菌胞外多糖在口腔粘附作用中的作用很小[21-23],如 Rosenberg M 等[24]研究者则通过对牙菌斑筛选的微生物进行有机溶剂浊度分析之后,指出细菌表面的疏水性才是口腔粘附的重要机制,牙菌斑是牙齿表面逐渐沉积的生物薄膜,由食物残渣、脱落的口腔上皮组织细胞、唾液和细菌组成,它是造成口腔疾病的重要原因之一。其实对乳酸菌粘附机制的研究不仅仅局限在以上两个方面,更加复杂的机制也逐渐被人们所揭示,如研究者发现有一株乳酸菌能改变唾膜蛋白的组成,它能通过除去重要的吸附蛋白和唾液中的细胞凝集素gp340(它与变形链球菌的吸附作用有重要关系),从而影响了变形链球菌在口腔的定植能力[25],而达到治疗口腔疾病的目的。可见,关于乳酸菌粘附机制以及乳酸菌间接影响相关致病菌的定植能力的研究还需要进一步深入。
1.4.2 益生菌产生的H2O2和细菌素 众所周知,乳酸菌通过产生H2O2和细菌素抑制致病菌的生长,是乳酸菌发挥益生功能的重要基础,所以H2O2和细菌素对致龋病菌的抑制作用是学者们必须研究的内容。血链球菌(Streptococcus sanguinis)是口腔中的正常菌群,它能通过产生H2O2和血链素抑制口腔有害菌的生长,如能与变形链球菌发生竞争现象[8]。Kreth J[26]在2005年指出血链球菌对变形链球菌产生的乳酸和细菌素很敏感,但同时血红链球菌能够通过产生H2O2抑制变形链球菌的生长,他之后又在2008年通过进一步实验发现,在氧气的存在下,血链球菌的量增多,这同时又刺激了变形链球菌对抑制链球菌的变链素IV的产量增多[27]。不仅口腔中的血链球菌能进行龋齿预防,取自于健康人体牙菌斑的寡发酵链球菌(Streptococcus oligofermentans)同样也能抑制口腔有害微生物生长,其中一个重要机理就是它能利用变形链球菌产生的乳酸而增加H2O2的产量[28]。
KrügerC[29]将 一 株 重 组 的 玉 米 乳 杆 菌(Lactobacillus zeae)接种在患有龋齿的小鼠口腔中之后,发现它能刺激机体对变形链球菌分泌scFv抗体,从而降低变形链球菌数目。scFv抗体是医学工作者研究的比较热门的一种免疫物质,它对靶细胞具有较强的杀灭作用,但同时对机体的免疫系统影响很小,可见,乳酸菌能间接刺激机体产生的一些免疫物质,从而阻止致龋菌的生长[30]。
2 牙龈炎和牙周炎
2.1 造成牙龈炎和牙周炎的微生物
牙龈炎主要是由细菌的入侵造成的,其中变形链球菌是主要因素[48],造成牙周炎的微生物则主要为牙龈卟啉单胞菌(Porphyromonas gingivalis),放线杆菌(Actinobacillus actinomycetemcomitans),福赛斯坦纳菌(Tannerellaforsythensis)和齿垢密螺旋体(Treponema denticola)[31-32]。同时由于牙龈与牙齿的结构存在差异性,所以二者在症状上有较大区别,牙龈炎主要表现为牙龈出血,红肿,胀痛,继续发展侵犯硬组织,产生牙周炎症。可见牙龈炎是牙周炎的初级阶段,所以可以把牙龈炎和牙周炎结合在一起阐述。
2.2 不同的食用方式对治疗牙龈炎和牙周炎的影响
关于乳酸菌对牙龈炎和牙周炎疾病的研究较少,2006 年,Krasse P[33]让牙龈炎患者食用含罗伊氏乳杆菌的口香糖14d后,口腔中的罗伊氏乳杆菌的数量显著增高,牙菌斑中有害微生物明显减少,牙龈炎病症明显降低,而且指出不同的罗伊氏乳杆菌对唾液的粘附能力有一定的差异性。Twetman S[34]在2009年进行了和Krasse P同样的实验,得到了同样的结论,但他则更加深入的从细胞因子水平进行了分析,结果发现:实验对象口腔上皮细胞的肿瘤坏死因子(TNF-α)和白细胞介素-8(IL-8)也明显减少,但是当康复的患者不食用此口香糖2周后,牙龈炎便复发了。这与Horz HP[35]对患者喂养唾液链球菌药片的实验结果类似,都是取消治疗一段时间后,患者不同程度地出现了复发现象。在益生菌对很多疾病的治疗中,复发现象的确是一个比较常见的问题,这可能主要是因为益生菌定植能力上不强,以及杀菌能力与抗生素相比还有一定的差距性有关。在治疗牙周炎方面,研究发现,患者食用含唾液乳杆菌WB21的片剂能显著降低牙周袋深度,特别是对吸烟者效果更显著,同时也能降低牙周炎菌斑的数目[36-37]。
在治疗口腔疾病中,不仅乳酸菌菌种的选择很重要,不同类型的治疗方法也同样重要,因为只有使用简单而实用的治疗方法才能更好地预防和治疗口腔疾病。如漱口水就是一种较好的选择,让患者食用含有三种不同口腔链球菌的漱口水和含Nisin的漱口水后,结果发现,两种漱口水分别能显著降低引起牙周炎、牙龋齿的细菌数量和牙菌斑数[38-39],从而达到治疗或缓解牙周炎的目的。
2.3 益生菌治疗牙龈炎和牙周炎机理
关于乳酸菌在调节人体免疫方面,有学者进行过相关研究发现,口腔中细胞炎症因子(如金属蛋白酶、一氧化氮合成酶、前列腺素E2、干扰素-γ)与牙龈炎症状(如龈沟液增多)呈正相关关系,但当患者食用含乳酸菌的食物后,体内细胞炎症因子水平显著降低[40],因此我们可以利用乳酸菌能降低促炎症因子的产生的原理[41],利用乳酸菌治疗牙龈炎和牙周炎。
在益生菌的代谢产物抑制牙龈炎方面,Pangsomboon K[42]发现一株干酪乳杆菌产生的一种细菌素能够显著抑制牙龈卟啉单胞菌引起的牙龈炎。也有学者同样发现两株不同的缓症链球菌(Streptococcus mitis)都能通过分泌一种表面活性剂,从而减少造成牙周炎的变形链球菌等致病菌粘附能力[43],达到最终治疗目的。
3 益生菌对其他口腔疾病的治疗
有学者指出某些类型的口臭可能是由一些唾液链球菌通过刺激牙龈卟啉单胞菌(Porphyromonas gingivalis)产生粘蛋白类物质而引起的[44]。但是并不是所有唾液链球菌都是导致口臭的罪魁祸首,某些唾液链球菌同样能抑制造成口臭的微生物的生长[45]。如 Tagg JR[30]和 Kroes I[46]就发现一株唾液链球菌K12能有效地防止喉咙感染和口臭。Cosseau C[47]则将唾液链球菌K12对人体免疫系统的影响进行了更加深入的研究,结果表明:唾液链球菌K12能降低IL-8的分泌水平,调控抗菌肽LL-37的表达和细胞内的代谢平衡,从而达到抑制口臭的功效。也有学者发现食窦魏斯氏菌(Weissella cibaria)能减少由具核梭杆菌(Fusobacterium nucleatum)产生的硫化氢气体造成的口臭症状,且效果显著,原因可能是由于食窦魏斯氏菌产生了H2O2以及与具核梭杆菌竞争吸附位点[48],可见不同的益生菌对不同类型的口臭治疗机制可能不同,不同的学者从不同的角度研究,得到不同的实验结果。
4 结论
目前,关于乳酸菌对口腔疾病的研究尚处于初级阶段,筛选或改良出对口腔疾病治疗效果较好的菌株是所面临的重大问题,因为这样的菌株必须满足以下条件才能达到更好的治疗效果:能长时间定植在比较难吸附的口腔上皮细胞、唾液和牙齿上,有利于防止口腔疾病复发;菌株产酸能力较差,产细菌素、H2O2能力较强,因为产酸能力强的菌易造成龋齿,所以要求益生菌菌株主要通过产细菌素和H2O2达到最终的抑菌目的;最好从口腔直接筛选出所需的乳酸菌,因为这样的乳酸菌更能适应口腔环境,能减缓或防止疾病复发;能相当于疫苗一样,引起口腔组织产生免疫物质,从而杀灭致病菌的益生菌菌株以及调节炎症反应的益生菌都是研究的新兴热点领域,这些机理必将为科研工作者筛选出性状较好的益生菌,预防或治疗口腔疾病提供了一个新的方向。
[1]Metchnikoff E,Schlesinger EB.The prolongation of life:optimistic studies[M].New York:Putnam,1908.
[2]Haukioja A.Probiotics and Oral Health[J].Eur J Dent,2010,4:348-355.
[3]Kragen H.The treatment of inflammatory affections of the oral mucosa with a lactic acid bacterial culture preparation[J].Zahnarztl Welt,1954,9:306-308.
[4]Aas JA,Paster BJ,Stokes LN,et al.Defining the normal bacterial flora of the oral cavity[J].J Clin Microbiol,2005,43:5721-5732.
[5]Loesche WJ.Role of Streptococcus mutans in human dental decay[J].Microbiol Rev,1986,50:353-380.
[6]Matsumoto M,Tsuji M,Sasaki H,et al.Cariogenicity of the probiotic bacterium Latobacillus salivarius in rats[J].Caries Res,2005,39:479-483.
[7]Lien CP,Rob JM,Wilfred FM,et al.Effects of probiotic Lactobacillus salivarius W24 on the compositional stability of oral microbial communities[J].Archives of Oral Biology,2009,54:132-137.
[8]Becker MR,Paster BJ,Leys EJ,et al.Molecular analysis of bacterial species associated with childhood caries[J].J Clin Microbiol,2002,40:1001-1009.
[9]Fitzgerald RJ,Adams BO,Davis ME.A microbiologicdy of recurrent dentinal caries[J].Caries Res,1994,28:409-415.
[10]David C,Johan R,Freek B,et al.Proteomic analysis of log to stationary growth phase Lactobacillus plantarum cells and a 2-DE database[J].Proteomics,2006,6:6485-6493.
[11]Simark-Mattsson C,Emilson CG,Hakansson EG,et al.Lactobacillus mediated interference of mutans streptococci in caries-free vs.caries- active subjects[J].Eur J Oral Sci,2007,115:308-314.
[12]Hillman JD,Mo J,McDonell E,et al.Modification of an effect strain for replacement therapy of dental caries to enable clinical safety trials[J].J Appl Microbiol,2007,102:1209-1219.
[13]Nase L,Hatakka K,Savilahti E,et al.Effect of long-term consumption of a probiotic bacterium,Lactobacillus rhamnosus GG,in milk on dental caries and caries risk in children[J].Caries Res,2001,35:412-420.
[14]Ahola AJ,Yli-Knuuttila H,Suomalainen T,et al.Short-term consumption of probiotic-containing cheese and its effect on dental caries risk factors[J].Arch Oral Biol,2002,47:799-804.
[15]Caglar E,Kuscu OO,Selvi Kuvvetli S,et al.Short- term effect of ice-cream containing Bifidobacterium lactis Bb-12 on the number of salivary mutans streptococci and lactobacilli[J].Acta Odontol Scand,2008,66:154-158.
[16]Nikawa H,Makihira S,Fukushima H,et al.Lactobacillus reuteri in bovine milk fermented decreases the oral carriage of mutans streptococci[J].Int J Food Microbiol,2004,95:219-223.
[17]Petti S,Tarsitani G,Simmonetti DA.Antibacterial activity of yoghurt against viridans streptococci in vitro[J].Arch Oral Biol,2008,53:985-990.
[18]Comelli EM,Guggenheim B,Stingele F,et al.Selection of dairy bacterial strains as probiotics for oral health[J].Eur J Oral Sci,2002,110:218-224.
[19]Samot J,Lebreton J,Badet C.Adherence capacities of oral lactobacilli for potential probiotic purposes[J].Anaerobe,2011,17:69-72.
[20]Kralj S,Geel- Schutten GH,Rahaoui H,et al.Molecular characterization of a novel glucosyltransferase from Lactobacillus reuteri strain 121 synthesizing a unique,highly branched glucan with α-(1→4)and α-(1→6)glucosidic bonds[J].Appl Environ Microbiol,2002,68:4283-4291.
[21]Vuyst DL,Degeest B.Heteropolysaccharides from lactic acid bacteria[J].FEMS Microbiol Rev,1999,23:153-177.
[22]Harding LP,Marshall VM,Hernandez Y,et al.Structural characterisation of a highly branched exopolysaccharide produced by Lactobacillus delbrueckii subsp.bulgaricus NCFB2074[J].Carbohydr Res 2005,340:1107-1111.
[23]Lipinski T,Jones C,Lemercinier X,et al.Structural analysis of the Lactobacillus rhamnosus strain KL37C exopolysaccharide[J].Carbohydr Res,2003,338:605-609.
[24]Rosenberg M,Judes H,Weiss E.Cell surface hydrophobicity of dental plaque microorganisms in situ[J].Infect Immun,1983,42:831-834.
[25]Haukioja A,Loimaranta V,Tenovuo J.Probiotic bacteria affect the composition of salivary pellicle and Streptococcal adhesion in vitro[J].Oral Microbiology and Immunology,2008,23:336-343.
[26]Kreth J,Merritt J,Shi W,et al.Competition and coexistence between Streptococcus mutans and Streptococcus sanguinis in the dental biofilm[J].J Bacteriol,2005,187:7193-7203.
[27]Kreth J,Zhang Y,Herzberg MC.Streptococcal antagonism in oral biofilms:Streptococcus sanguinis and Streptococcus gordonii interference with Streptococcus mutans[J].J Bacteriol,2008,190:4632-4640.
[28]Tong H,Chen W,MerrittJ,etal.Streptococcus oligofermentans inhibits Streptococcus mutans through conversion of lactic acid into inhibitory H2O2:a possible counteroffensive strategy for interspecies competition[J].Mol.Microbiol,2007,63:872-880.
[29]Krüger C,Hu YZ,Pan Q,et al.in situ delivery of passive immunity by lactobacilli producing single- chain antibodies[J].Nature Biotech,2002,20:702-706.
[30]Tagg JR,Dierksen KP.Bacterial replacement therapy:adapting‘germ warfare’to infection prevention[J].Trends Biotechnol,2003,21:217-223.
[31]Pihlstrom BL,Michalowicz BS,Johnson NW.Periodontal diseases[J].Lancet,2005,66:1809-1820.
[32]Oringer RJ.Modulation of the host response in periodontal therapy[J].J Periodontol,2002,73:460-470.
[33]Krasse P,Carlsson B,Dahl C,et al.Decreased gum bleeding and reduced gingivitis by the probiotic Lactobacillus reuteri[J].Swedish Dental journal,2006,30:55-60.
[34]Twetman S,Derawi B,Keller M,et al.Short-term effect of chewing gums containing probiotic Lactobacillus reuteri on the levels of inflammatory mediators in gingival crevicular fluid[J].Acta Odontologica Scandinavica,2009,67:19-24.
[35]Horz HP,Meinelt A,Houben B,et al.Distribution and persistence of probiotic Streptococcus salivarius K12 in the human oral cavity as determined by real-time quantitative polymerase chain reaction[J].Oral Microbiol Immunol,2007,22:126-130.
[36]Shimauchi H,Mayanagi G,Nakaya S,et al.Improvement of periodontal condition by probiotics with Lactobacillus salivarius WB21:a randomized,double- blind,placebo- controlled study[J].J Clin Periodontol,2008,35:897-905.
[37]Mayanagi G,Kimura M,Nakaya S,et al.Probiotic effects of orally administered Lactobacillus salivarius WB21-containing tablets on periodontopathic bacteria:a double-blinded,placebocontrolled,randomized clinical trial[J].J Clin Periodontol,2009,36:506-513.
[38]Zahradnik RT,Magnusson I,Walker C,et al.Preliminary assessment of safety and effectiveness in humans of ProBiora3,a probiotic mouth-wash[J].J Appl Microbiol,2009,107:682-690.
[39]Noordin K,Kamin S.The effect of probiotic mouthrinse on plaque and gingival inflammation[J].Annal Dent Univ Malaya,2007,14:19-25.
[40]Staab B,Eick S,Knöfler G,et al.The influence of a probiotic milk drink on the development of gingivitis:a pilot study[J].J Clin Periodontol,2009,36:850-856.
[41]Lammers KM,Vergopoulos A,Babel N,et al.Probiotic therapy in the prevention of pouchitis onset:decreased interleukin-1β,interleukin-8,and interferon- γ gene expression[J].Inflamm Bowel Dis,2005,11:447-454.
[42]Pangsomboon K,Kaewnopparat S,Pitakpornpreecha T,et al.Antibacterial activity of a bacteriocin from Lactobacillus paracasei HL32 against Porphyromonas gingivalis[J].Arch Oral Biol,2006,51:784-793.
[43]Hoogmoed CG,Der KM,Der Mei HC,et al.Inhibition of Streptococcus mutans NS adhesion to glass with and without a salivary conditioning film by biosurfactant-releasing Streptococcus mitis strains[J].Appl Environ Microbiol,2000,66:659-663.
[44]Sterer N,Rosenberg M.Streptococcus salivarius promotes mucin putrefaction and malodor production by Porphyromonas gingivalis[J].J Dent Res,2006,85:910-914.
[45]Burton JP,Chilcott CN,Tagg JR.The rationale and potential for the reduction of oral malodour using Streptococcus salivarius probiotics[J].Oral Dis,2005,11:29-31.
[46]Kroes I,Lepp PW,Relman DA.Bacterial diversity within the human subgingival crevice[J].Proc Natl Acad Sci USA,1999,96:14547-14552.
[47]Cosseau C,Devine DA,Dullaghan E,et al.The commensal Streptococcus salivarius down-regulates immune responses of human epithelial cells and promotes host-microbe homeostasis[J].Infect Immun,2008,76:4163-4175.
[48]Kang MS,Kim BG,Chung J,et al.Inhibitory effect of Weissella cibaria isolates on the production of volatile sulphur compounds[J].J Clin Periodontol,2006,33:226-232.

