乌贼墨多糖的制备及对睾丸化疗性损伤的保护作用
乐小炎,原 林,林少杰,陶叶杏,谷毅鹏,刘华忠
(1.广东海洋大学食品科技学院,广东湛江524088;2.广东海洋大学生物化学中心,广东湛江524088)
乌贼墨已被证明是一种多功能生物活性物质,其主要成分有黑色素、蛋白质、多糖等。近年来,少量报道对SIP的构效关系进行了较为深入的研究,发现其生物学功能具有广谱性,如抗菌及保鲜作用[1]、抗氧化[2]、增强免疫力[3]等。在近年来我们报道 SIP的化疗保护功能之后,最近发现SIP能有效缓解CP导致的小鼠睾丸损伤,提高精子的数量和质量。上述生物学功能的发现是基于粗多糖的研究。有研究表明,硫酸葡聚糖在分子量为1ku时具有体外抗HIV活性,且活性随着分子量的增加而增强,在10ku时达到最大[4]。因此,目前所报道的SIP功能的实现是某均一性多糖抑或协同作用的结果,仍不得而知,尚需进一步研究。本实验通过分离纯化某一分子量片段的SIP,探讨其对睾丸化疗性损伤的缓解作用,为进一步探讨不同分子量多糖对其生物活性功能的影响提供理论基础,也为我国乌贼墨的开发利用提供实际指导意义。
1 材料与方法
1.1 材料与仪器
曼氏乌贼墨囊 湛江东丰批发市场,保藏在-20℃冰柜中冷冻备用;昆明小白鼠 广东省医学实验动物中心;木瓜蛋白酶 北京鼎国生物技术有限公司;Dextran 系列标准品(T-10,10ku;T-20,20ku;T-40,40ku;T-70,70ku;T-110,110ku)Pharmacia Fine Chemicals公司;注射用环磷酰胺(CP)江苏恒瑞医药股份有限公司;Sephdex G-100 GE Healthcare;乳酸脱氢酶(LDH)、γ-谷氨酰转肽酶(γ-GT)试剂盒 南京建成生物工程研究所;其他试剂均为分析纯。KDC-160HR高速冷冻离心机 科大创新股份有限公司中佳分公司;FDU-1100真空冷冻干燥机 托普仪器有限公司;UV-2550紫外可见分光光度计 日本岛津仪器有限公司;DHL-A电脑恒流泵 上海青浦沪西仪器厂;N-1000旋转蒸发仪 托普仪器有限公司;JY92-Ⅱ超声波细胞粉碎机 宁波新芝生物科技股份有限公司;TENSOR27红外光谱仪 德国布鲁克光谱仪器公司。
1.2 实验方法
1.2.1 SIP的分离 取乌贼墨囊4℃解冻,剪取墨汁,加入等体积的 PBS(0.01mol·L-1,pH7.2),超声处理,浸泡 8h,8000r·min-1离心 50min 去除沉淀,重复 2次,再加入木瓜蛋白酶,50℃下水解90min,100℃灭酶失活10min,离心去除沉淀,然后加入四分之一体积的氯仿/正丁醇(体积比4∶1),去除蛋白,重复3次,取上清液旋转蒸发浓缩,加入4倍体积的乙醇沉淀,冷冻干燥,得白色粉末样品。采用Sephdex G-100作为填料,柱规格(1.0cm×100cm)分离纯化,0.2%的NaCl溶液作为流动相,流速为 0.5mL·min-1,每管收集2mL,蒽酮法检测每管的含糖量,并合并同一峰下的样品,冷冻干燥得到样品。
1.2.2 纯度鉴定和相对分子质量的测定 采用排阻高效液相色谱(SE-HPLC)分析,分别将不同分子量的葡聚糖标品 T10、T20、T40、T70、T110 配制成 3mg·L-1,分别进样,记录保留时间T。以T为横坐标,lgM为纵坐标绘制标准曲线,求得回归方程。取纯化样品溶解,配成3mg·L-1,记录 T,推算其相对分子质量。HPLC系统由岛津 LC-20AT,RID-10A HPLC系统由岛津LC-20AT,RID-10A示差检测器组成(岛津公司,日本)。色谱柱:Shodex Sugar KS-804(8 ×300mm);流动相:0.1mol/L NaNO3溶液;流速 1mL/min;柱温:常温。
1.2.3 紫外光谱分析 将样品用超纯水配成1mg·L-1的水溶液,在 190~400nm 进行光谱扫描。
1.2.4 红外光谱分析 取样品1mg,采用KBr压片,在4000~400cm-1红外波数范围内进行扫描。
1.2.5 硫酸根含量的测定 采用氯化钡-明胶法[4]。
1.2.6 睾丸损伤的测定 选60只性成熟的雄性昆明小白鼠(28~30g),随机分成六组,空白组A,模型组B(腹腔注射 CP,15mg/kg,1 次/周,持续 10 周),阴性对照组C(灌胃SIP,80mg/kg,1 次/d,持续10 周),治疗组 D、E、F(腹腔注射 CP,15mg/kg,1 次/周和灌胃 SIP,剂量分别是 65、80、95mg/kg,1 次/d,持续 10周),正常的给水、喂食及饲养。10周后,颈椎处死小鼠,称重,快速取出睾丸组织,预冷的生理盐水清洗,吸干水分,称重。用预冷的0.85%的NaCl溶液将睾丸组织匀浆成10%组织匀浆液,LDH及γ-GT的活力采用试剂盒检测。
1.2.7 统计分析 数据以均数±标准差表示,组间比较采用单因素方差分析。两组间比较用t检验,*p<0.05,**p<0.01。
2 结果与分析
2.1 紫外光谱分析
经分离纯化得到的SIP组分在波长190~400nm处的光谱扫描图谱如图1。图谱显示,此多糖的特征吸收峰在190nm左右,在260及280nm未发现特征吸收峰,说明该纯化SIP不含有蛋白质和核酸成分。
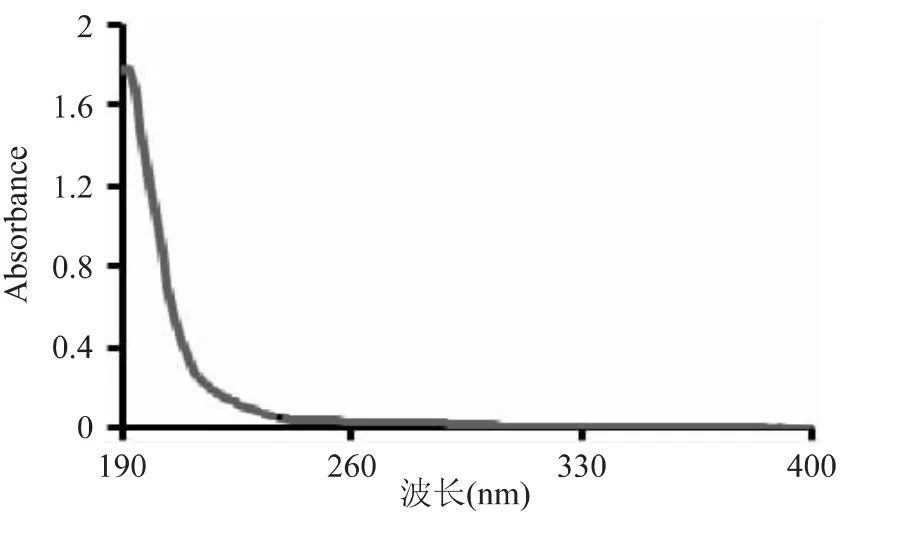
图1 SIP的UVProbe紫外扫描仪上扫描图谱Fig.1 Ultraviolet spectrum of SIP
2.2 纯度及分子量的测定
SIP的HLPC图谱(见图2)显示,SIP峰型较对称,纯度高。
根据已知葡聚糖标准品相对分子质量(M)及保留时间(T)绘制标准曲线(见图3),得到回归方程为T=-1.645lgM+15.95(R2=0.9999),SIP的保留时间为8.434min,计算得SIP重均分子量为37068u。

图2 SIP的HPLC图谱Fig.2 HLPC profiles of SIP

图3 葡聚糖分子质量标准曲线Fig.3 Calibration curve for relative molecularweight determination

表1 SIP和CP对小鼠体重、睾丸重量及睾丸指数的影响Table 1 Effect of SIP and CP on body,testicular weights and testis index
2.3 红外光谱分析
SIP的红外图谱(见图4)显示存在多糖的特征吸收峰,即在3398cm-1左右是O-H和N-H伸缩振动的特征,2800cm-1左右是糖类 C-H 伸缩振动,1423cm-1左右是C-H变角振动。另外,在1648cm-1是由羧基C=O的伸缩振动产生,在820cm-1为C-O-S伸缩振动,1235cm-1是S=O的伸缩振动,比较弱,说明存在硫酸根基团,含量测定证实存在3%硫酸根。

图4 SIP的红外图谱Fig.4 Infrared absorption spectrum of SIP
2.4 小鼠体重、睾丸重量及睾丸指数的变化
从表1数据显示,SIP能缓解CP导致的小鼠体重、睾丸重量(p<0.05,p<0.01)、睾丸指数(与模型组、空白组无显著性差异)的降低,不同治疗组间缓解效果不显著(p>0.05)。模型组与对照组相比,CP导致小鼠体重、睾丸重量、睾丸指数分别下降了15.12%(p<0.01)、25%(p<0.01)、12.48%(p<0.05)。除治疗组D外,其他治疗组的小鼠体重、睾丸重量得到明显(p<0.01)的改善,且小鼠体重与空白组无显著(p>0.05)差异。
2.5 睾丸标志性酶变化
图5显示,睾丸中γ-GT活力因SIP的治疗得到明显(p<0.01)的改善。与空白组相比,CP导致γ-GT活力提高了1.71倍。与模型组相比,治疗组降低了因CP导致γ-GT活力的增加,降低指数达35%左右,且各治疗组间无显著(p>0.05)差异,同时与空白组无差异。
图6显示,SIP能缓解CP导致的LDH活力下降。CP明显(p<0.01)降低LDH的活力,除治疗组D外,SIP治疗组LDH活力得到显著(p<0.05)改善,与空白组无显著(p>0.05)差异。

图5 睾丸中γ-GT活力Fig.5 Activity of γ-GT in testis
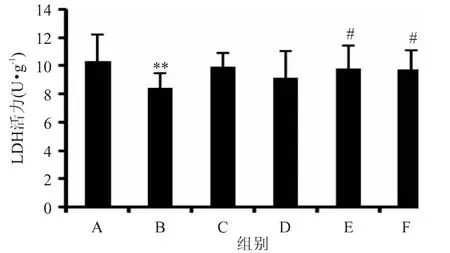
图6 睾丸中LDH活力Fig.6 Activity of LDH in testis
3 结论与讨论
众所周知,多糖活性功能与结构,包括分子量的大小、所含的官能团等是密切相关的。近年来,关于SIP的结构与功能有一系列研究,其结构证实[5]由等摩尔质量的三种单糖组成的重复单元,三种单糖分别是 N-乙酰半乳糖、岩藻糖、葡糖醛酸,结构式[-3-GlcAβ-1,4-(GalNacα-1,3-)Fucα1-]n,与本研究红外扫描图谱相符合。
SIP具有多种生物活性功能,本研究结果表明SIP能缓解CP导致的睾丸损伤,确证了我们先前的结论[6]。CP导致睾丸重量的减轻与精子形成过程及睾丸组织损伤有关[7]。LDH位于成熟或正在成熟睾丸生精细胞线粒体膜内,在质子转移的过程中起到至关重要的作用。CP降低LDH酶活力,影响精子的发生及成熟[8]。γ-GT活性与睾丸支持细胞的成熟与增殖有关,其活性的升高是由于睾丸组织受到损伤[9]。SIP对CP导致的LDH活力的降低、γ-GT活性升高有缓解作用,这可能与SIP分子量及所含硫酸根有关。本研究测得分离纯化SIP的重均分子量为37ku左右,硫酸根含量为3%,具有对睾丸损伤的保护作用。其保护作用效果及相关机制与分子大小及组成是否有关有待进一步研究。
[1]吴金龙,罗剑秋,刘华忠,等.乌贼墨多糖对冷藏鱿鱼的防腐保鲜作用研究[J].食品科学,2010,31(10):304-307.
[2]闵诗刚,王光,钟杰平,等.乌贼墨多糖对大鼠外周血及血液中抗氧化能力影响[J].食品研究与开发,2011,32(1):123-125.
[3]陆通,高春义,朱有名,等.乌贼墨升白作用的研究[J].实用中西医结合杂志,1995,8(3):163.
[4]王长云,管华诗.多糖抗病毒研究进展Ⅱ:硫酸多糖抗病毒作用[J].生物工程进展,2000,20:3-8.
[5]Takaya Y,Uchisawa H,Narumi F,et al.Illexins A、B、and C from Squid Ink Should Have a Branched Structure[J].Biochemical and Biophysical Research Communications,1996,226:335-338.
[6]乐小炎,许泽旋,师丽莎,等.乌贼墨多糖对环磷酰胺损伤小鼠生精功能的影响[J].中国海洋药物,2012,31(5):23-26.
[7]Katoh C,Kitajima S,Saga Y,Kanno J,et al.Assessment of quantitative dual-parameter flow cytometric analysis for the evaluation of testicular toxicity using cyclophosphamide-and ethinylestradiol- treated rats[J].The Journal of Toxicological Sciences,2002,27(2):87-96.
[8]Selvakumar E,Prahalathan C,Mythili Y,et al.Beneficial effects of dl-a-lipoic acid on cyclophosphamide-induced oxidative stress in mitochondrial fractions of rat testis[J].Chem Biol Intract,2005,152(1):59-66.
[9]Hodgen GD,Sherins RJ.Enzymes as markers of testicular growth and development in the rat[J].Endocrinology,1973,93(4):985-989.

