炼油厂酸性水溶液体系汽液平衡关联计算与分析
廖昌建,齐先志,刘忠生,朴 勇
(中国石化抚顺石油化工研究院, 辽宁 抚顺 113001)
炼油厂在原油加工的过程中,含硫污水主要来自常减压、催化以及加氢等工艺装置。同时,国内各个炼油厂生产规模不断的扩大以及进口原油中硫含量较高,导致含硫污水的处理量及污水中H2S和NH3的浓度均大幅增大,也增加了与之平衡的汽相物质浓度,排出大量的酸性气体,严重污染环境和影响人体健康[1]。
本文从弱电解质水溶液体系汽液平衡理论出发,系统推导了弱电解质NH3-CO2-H2S-H2O四元体系汽液相平衡关联式。并在此基础上,分析了酸性水溶液 NH3-H2S-H2O-空气平衡体系中各个影响因素对体系汽相分压的影响。
1 弱电解质汽液平衡模型
在NH3-CO2-H2S-H2O体系内,液相中存在以下化学平衡反应[2,3]。在平衡体系中,对于弱电解质稀溶液,汽液两相满足亨利定律。

式中:P —弱电解质组分汽相分压,kPa;

γ—活度系数[3];
b —弱电解质组分质量摩尔浓度,mol·kg-1。

表1 亨利常数与温度关系式系数[3]Table 1 The coefficients in the equation of Henry constants with temperature
根据体系中的化学平衡、质量守恒定律以及电荷守恒定律等,可以得到如下关系式。


A、B、C、D—K与T关系式常数,其值见表2。
根据质量守恒定律,联立公式(1-7),推导可得到公式(8)和公式(9)。

表2 化学反应平衡常数与温度关系式系数[3,4]Table 2 The coefficients in the equation of Equilibrium Constants with temperature

同理可以推导得到 CO2、H2S的汽相分压计算公式,该计算式是[H+]的一元三次方程。根据液相pH值、液相其他组分浓度和体系温度,即可求得对应组分的汽相分压。
液相中各离子组分和各分子间还存在着物料平衡和电荷平衡,各个平衡关系如下:

在 NH3-CO2-H2S-H2O体系中,在已知酸性水体系温度、总氨、总硫和总碳的条件下,联立公式(1~13)可计算得到气相各组分的汽相分压。
2 酸性水溶液体系气液平衡影响因素分析
在建立弱电解质 NH3-CO2-H2S-H2O体系汽液相平衡计算模型的基础上,本节主要考察NH3-H2S-H2O-空气体系不同NH3-H2S汽液相浓度、不同H2S/ NH3摩尔比以及温度变化对体系汽相分压的影响。在计算过程中,取体系中H2S和NH3摩尔量与空气含量比为1︰3。
2.1 NH3-H2S汽液相浓度的影响
在体系中H2S/ NH3物质摩尔比为0.7时,温度35 ℃,常压条件下,对不同 NH3-H2S汽液相浓度进行计算,以汽相组分分压为考察指标,计算结果见表3。由表可知,随液相中弱电质组分浓度增加,各组分汽相分压增大,由此表明液相组分浓度提高,加大了酸性水罐区气体排放量。
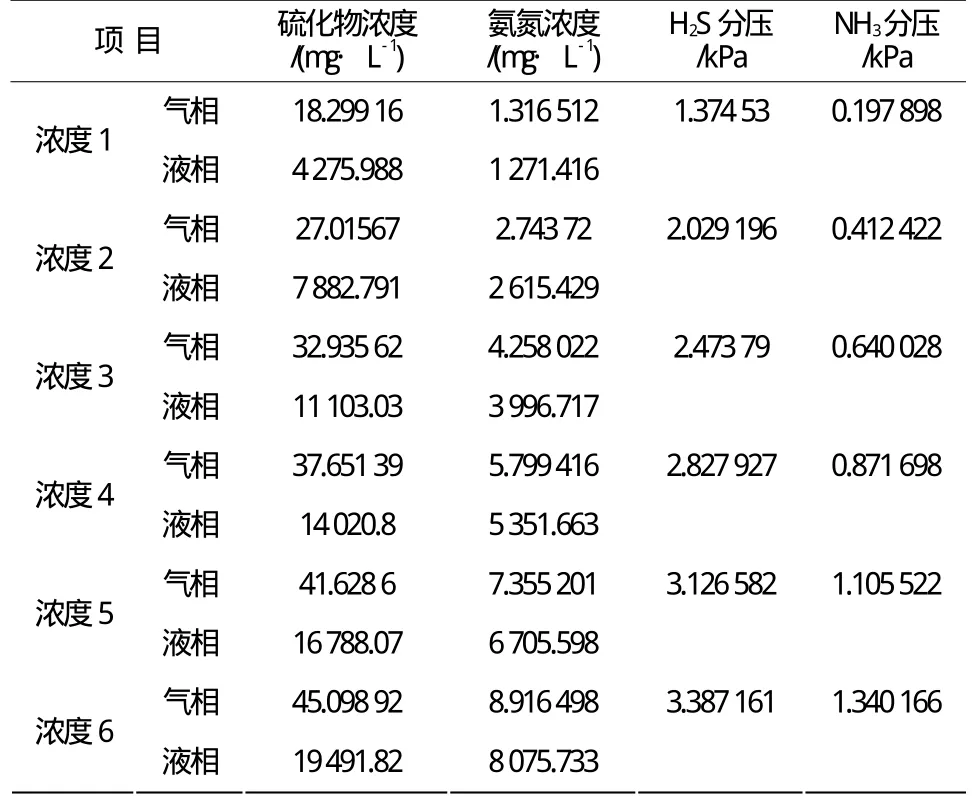
表3 NH3-H2S汽液相浓度对汽相分压影响Table 3 The effect of concentration of NH3 and H2S in the vapor and liquid phases on their vapor partial pressures
2.2 H2S/ NH3摩尔比的影响
常压下,体系温度 35℃。分析不同 H2S/ NH3比对 NH3-H2S-H2O-空气体系汽相分压的影响,计算结果见表4。

表4 H2S/ NH3摩尔比对汽相分压的影响Table 4 The effect of H2S/ NH3 molar ratio on their vapor partial pressures
由表4可知:随体系中H2S浓度增加, H2S-NH3化学平衡反应向正方向移动,引起液相中H2S、NH3浓度降低,根据亨利定律可得出,汽相中NH3浓度和分压减小。但随体系中H2S浓度增加,汽相H2S浓度增加和汽相酸性气体分压提高。
2.3 温度变化的影响
在体系H2S/ NH3物质摩尔比为0.7时,常压条件下,研究温度变化对弱电解质体系汽液平衡的影响,计算结果见表 5。由表可知,温度升高,增加了汽相中酸性气体分压或排放体积。
3 结 论
(1)本文根据弱电解质水溶液NH3-CO2-H2SH2O四元体系汽液平衡理论,系统推导了平衡体系汽液相平衡关系式,建立了汽相分压与水溶液 pH值、液相组分浓度和体系温度的关联式,为炼油厂酸性水储罐小呼吸排放气量的计算提供了依据。
(2)在建立弱电解质水溶液汽液平衡计算模型的基础上,对酸性水溶液 NH3-H2S-H2O-空气平衡体系中 NH3-H2S汽液相浓度、H2S/NH3摩尔比、温度变化对平衡汽相分压的影响进行了讨论,分析表明体系组分浓度和H2S/NH3摩尔比增加以及温度升高,皆能导致体系汽相分压提高,加大酸性气体排放。

表5 温度变化对汽相分压的影响Table 5 The effect of temperature on vapor partial pressures
[1] 杨刚.炼油厂含硫污水汽提塔的模拟与优化[D].天津:河北工业大学,2001.
[2]Edwards TJ.Maurer G.Newman J.etal.Vapor-liquid Equilibria in Multicomponent Aqueous Solutions of Volatile Weak Electrolytes[J].AIChe Journal,1978,24(6):966-976.
[3] 徐金火.汤渭龙.三种挥发性弱电解质水溶液体系汽液平衡的关联计算[J].石油大学学报,1993,7(3):81-86
[4] 魏顺安.薛荣书.H2O-NH3-CO2体系汽液平衡计算[J].化学工业与工程,2004,21(3):193-197.
[5] Kawazuish K,Prausmitz J M. Correlation of vapor-liquid equilibria for the system ammonia-carbon dioxide-water[J]. Ind Eng Chem Res,1987, 26 (7):1482-1485
[6] 杜英生,王利东,等.挥发性弱电解质水溶液汽液平衡计算[J].化学工程,1998,26(6):37-41.
[7] 陈庚华.韩世钧.氨、硫化氢和二氧化碳挥发性弱电解质水溶液的性质[J].石油学报,1985,1(1):75-94.

