小鼠frataxin抗体的制备及应用
郝双影,许芳霞,李宽钰
南京大学医学院 江苏省医学分子技术重点实验室,江苏 南京 210093
弗里德赖希共济失调 (Friedreich ataxia,FRDA) 是一种常染色体单基因突变引起的神经退行性疾病,96%的病人是由于第9号染色体上frataxin (FXN) 基因的第一个内含子中有 GAA序列大量重复扩增[1-2],造成FXN蛋白表达减少,引起FRDA的线粒体疾病。FRDA病人的主要临床表现为进行性姿势和步态的共济失调,上运动神经元功能障碍,如构音障碍、腱反射消失、深感觉丧失、心肌病、糖尿病及继发性骨骼畸形等[3-4]。早期的研究结果显示 FRDA病人包括3个主要的生化特点和病理生理学特征:细胞内铁的沉积[5];线粒体内含有铁硫簇的酶缺陷[6];在血液和尿液中存在氧化损伤的标记[7]。研究发现全身敲除Fxn的小鼠模型是胚胎致死;而分别在肌肉和神经组织突变后的小鼠模型则 FRDA症状加重。在knock-in (fxn-GAA)230小鼠模型中Fxn的表达量降低了 25%[8],在 knock-inknock-out小鼠中 Fxn的表达量是野生型的25%~35%,但这些模型小鼠并没有表现出明显的病理特征。将小鼠内源性的Fxn敲除,转入第一个内含子中GAA重复扩增的全长人源FXN的YAC转基因小鼠 YG8R则轻微地出现了顺乌头酸酶活性降低、抗氧化能力降低,并伴有神经退行性病变、心肌炎、协调能力降低、运动能力下降等症状[9]。因此,现存的几种小鼠模型都无法完全模拟FRDA病人的病情。在病人中FXN突变首先在神经系统表现出病变和损伤,而在其表达量较高、线粒体功能也很活跃的肝脏和肾脏等器官却无明显病症[10]。目前有研究发现人 FXN含有3种亚型蛋白,它们的表达具有组织特异性,该亚型蛋白的表达可能与 FRDA病人的组织特异性病变机制有关[11]。为成功建立小鼠FRDA疾病模型,我们首先需要确定小鼠体内Fxn亚型蛋白是否存在及其相应的功能。因此高度敏感和特异性的小鼠 Fxn的抗体制备是我们首先要解决的问题。
本研究通过 PCR扩增、酶切、连接、转化等常规分子克隆方法构建带有 his6标签的鼠源Fxn融合蛋白表达质粒,在大肠杆菌BL21 (DE3)中诱导表达,经过Ni-NTA柱子纯化和透析得到的纯化蛋白作为抗原免疫新西兰大白兔,制备了能够特异性识别内源Fxn的多克隆抗体。高度特异和灵敏的 Fxn抗体的获得为我们深入研究小鼠Fxn亚型蛋白的存在及其功能奠定了基础。
1 材料与方法
1.1 材料
纯种雌性新西兰大白兔购于青龙山兔场。大肠杆菌DH5α和BL21 (DE3) 及哺乳动物细胞系N2a和HEK293为本实验室保存。T4 DNA连接酶试剂盒、限制性内切酶购自Fermentas公司;2×pfuMix购自南京博尔迪公司;DNA回收试剂盒、DNA抽提试剂盒购自天恩泽公司;丽春红储存液 (10×) 购于博士德公司;辣根过氧化物酶(HRP) 标记的羊抗兔IgG购自中杉金桥公司。亚甲基双丙烯酰胺 (N,N-methylene diacrylamide,Bis)、过硫酸铵 (Ammonium persulfat)、四甲基乙二胺 (N,N,N',N'-tetramethy-lethylenediamine,TEMED) 和十二烷基磺酸钠 (Sodium dodecyl sulfate,SDS) 购自 Amresco (USA)。预染蛋白质分子量标准 (Prestained seeBlue Plus 2)购自Invitrogen (USA)。底物发光试剂盒购自 Pierce(USA)。
1.2 方法
1.2.1 重组表达载体的构建
根据小鼠FxnmRNA序列设计并合成引物,引入EcoRⅠ和XhoⅠ酶切位点 (用下划线表示)。正向引物为:F (5-CCGAATTC ATGGGCTTGGG GACATTGGACA-3);反向引物为 R (5-CCGCT CGAG TGAAGTGCCTTTTCCAGAATA-3)。以小鼠FxncDNA为模板进行PCR反应,用EcoRⅠ和XhoⅠ对扩增出的 DNA片段和含有 his6标签的质粒pET24(+) 同时进行双酶切,然后用连接试剂盒进行连接反应。将连接产物转化大肠杆菌DH5α并涂板,挑选单菌落,在 LB液体培养基中 37 ℃摇晃过夜,抽提质粒 DNA,用EcoRⅠ和XhoⅠ对质粒 DNA进行双酶切鉴定,筛选出已插入正确基因片段的重组质粒。经序列检测(上海美吉生物医药科技有限公司),成功获得含正确mFxn序列的重组质粒pET24(+)-mFxn。该质粒将在大肠杆菌中表达没有氨基端信号肽的130个氨基酸的蛋白,理论分子量为14.38 kDa。
1.2.2 融合蛋白的表达
将已含 pET24(+)-mFxn重组质粒的 BL21(DE3) 菌液37 ℃培养,当OD600值达到0.7~0.8时加入终浓度为0.2 mmol/L的IPTG诱导。分别于 0、1、2、3、4 h取 1 mL菌液,15 000 r/min、4 ℃离心 2 min,将沉淀悬浮于裂解缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L咪唑,pH 8.0) 中,加上样缓冲液后100 ℃ 加热5 min,上清上样用15% SDS-PAGE分离并用考马斯亮蓝染色。以实验所获得的最佳诱导时间进行大规模的诱导表达。
1.2.3 融合蛋白的纯化
将2 L经大规模诱导表达的菌液离心,沉淀悬浮于裂解缓冲液 (50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L咪唑,pH 8.0) 中,超声波粉碎后15 000 r/min、4 ℃ 离心15 min,将上清加入已预先平衡过的Ni-NTA柱中,过柱液收集备用。结合了 mFxn-his6融合蛋白的Ni-NTA 柱经漂洗 (50 mmol/L NaH2PO4,300 mmol/L NaCl,20 mmol/L咪唑,pH 8.0),洗脱 (50 mmol/L NaH2PO4,300 mmol/L NaCl,250 mmol/L咪唑,pH 8.0)。收集的裂解液、过柱液、漂洗液和洗脱液经15% SDS-PAGE分离后,考马斯亮蓝染色分析。
1.2.4 融合蛋白的透析
为了防止洗脱液中高浓度的咪唑对免疫兔子后抗体产生的影响,我们利用透析的方式将其去除。合并含有融合蛋白的洗脱液,加入预平衡过的离心过滤装置 (4 mL体系) 中,3 000 r/min、4 ℃离心 20 min,于过滤器中加入过滤液(50 mmol/L NaH2PO4,300 mmol/L NaCl) 补齐至4 mL,3 000 r/min、4 ℃离心20 min,收集离心管中的过滤液,备用。重复上述步骤9次,得到纯化的透析过的mFxn融合蛋白。过滤液以及浓缩后的蛋白经15% SDS-PAGE分离后,考马斯亮蓝染色分析。
1.2.5 抗体的制备和纯化
纯化的蛋白1 mg与完全佐剂 (Sigma,USA)按照 1∶1体积乳化后预免疫新西兰大白兔,两周后,再将纯化的蛋白 0.5 mg不完全佐剂按照1∶1体积乳化后进行第一次加强免疫,每隔两周加强1次,共经过3次加强免疫后收集血清。获得的抗血清经硫酸铵沉淀,得到初步纯化的抗体,进行Western blotting、免疫荧光和免疫沉淀分析。
1.2.6 抗体效价及特异性的测定
抗体的效价通过ELISA测定。将Fxn和带有his6标签的平行对照蛋白 ABCB10用 0.05 mol/L碳酸盐缓冲液 (pH 9.6) 稀释,以相同浓度的蛋白包被反应板 (100 ng)。为了进一步检测抗体的灵敏度,以不同浓度的蛋白包被反应板(0.001~1 000 ng),4 ℃过夜。弃去包被液,将板拍干,加入封闭液至满孔,置37 ℃,封闭1 h,PBST洗板3次,将板拍干。纯化后的抗体及免疫前血清分别按1∶500,1∶2 500,1∶12 500,1∶62 500,1∶312 500,1∶1 562 500,1∶7 812 500比例用稀释液 (5%脱脂牛奶,0.05%吐温-20) 稀释,同时对于不同浓度包被的反应孔,Fxn抗体按照1∶5 000用稀释液稀释,免疫前血清1∶200稀释作为阴性对照。将各溶液按每孔 100 µL体积加入已包被和封闭的反应板中 (37 ℃,2 h),用PBST洗板5次,每次1 min,将板拍干。加入 1∶10 000辣根过氧化物酶 (HRP) 标记的羊抗兔酶标抗体稀释液100 µL,37 ℃,1 h,再用PBST洗板 5次,每次 1 min,将板拍干。加入100 µL TMB显色液,于37 ℃下避光显色30 min。用2 mol/L H2SO450 µL终止反应。用酶标仪测定各孔OD450值,计算抗体效价和灵敏度。
通过Western blotting检测抗体的特异性。不同量的mFxn纯蛋白、N2a细胞和HEK293细胞裂解液以及小鼠组织抽提物经 15% SDS-PAGE电泳分离,转膜后用丽春红染色。脱色后,以1∶500稀释Fxn抗体进行4 ℃孵育过夜,以HRP标记的羊抗兔IgG为二抗,按照产品说明书,用HRP化学发光试剂盒进行检测。
1.2.7 Fxn抗体在免疫沉淀 (Immunoprecipitation,IP) 中的应用
为了检测 Fxn抗体能否应用于各类生化试验中,我们利用protein G琼脂糖珠进行IP检测。首先,平衡过的琼脂糖珠预清洗细胞和组织的抽提物 (4 ℃,2 h),去除非特异性蛋白;同时抗体与琼脂糖珠孵育 (比例为1∶5,4 ℃,2 h);然后将预清洗过的细胞裂解液或抽提物与已经结合抗体的琼脂糖珠4 ℃ 共同孵育2 h。将预清洗的琼脂糖珠,IP的过滤液 (Flowthrough) 以及IP后的样品进行Western blotting分析。
1.2.8 Fxn抗体在细胞免疫荧光(Immunofluresence) 中的应用
用终浓度为 125 nmol/L的 mitotracker(Invitrogen,USA) 染色细胞 40 min,1×PBS 洗两遍后用多聚甲醛溶液固定贴壁培养的HEK293细胞,经 0.2% Triton X-100部分裂解细胞,用 Fxn多克隆抗体为一抗,在 5%BSA/PBS中 4 ℃下过夜免疫染色内源 FXN,1×PBS漂洗3次,以Alexa-fluor 488的羊抗兔IgG(Invitrogen,USA) 在室温下黑暗处孵育1 h,激光共聚焦荧光显微镜下观察并用 OLYMPUS FLUOVIEW Ver.1.7a Viewer软件中分析图像。
2 结果与分析
2.1 重组表达载体的构建
构建的表达载体经EcoRⅠ和XhoⅠ双酶切鉴定,切出的目的片段和载体片段与预期大小一致,经测序分析,发现与NCBI数据库中公布的mFxncDNA序列一致 GenBank Accession No.NM_008044。由此表明我们成功获得了可表达带his6标签的重组质粒pET24(+)-mFxn。
2.2 重组蛋白诱导表达
重组质粒 pET24(+)-mFxn转化大肠杆菌BL21 (DE3) 诱导表达融合蛋白。结果如图1所示,随着诱导时间的增加蛋白的表达逐渐加强,当诱导时间为 2 h时已达到最高表达量 (图 1,泳道4)。后续蛋白的大量制备以此为依据。
2.3 重组蛋白纯化和抗原制备
将已成功转化重组质粒的 BL21 (DE3)经0.2 mmol/L的IPTG诱导,收集2 L菌液,超声破碎,经过 Ni-NTA柱分离纯化,洗脱产物经15% SDS-PAGE胶分析如图2A所示。被洗脱的蛋白峰主要集中在馏分1~3,随着馏分增加,被洗脱的蛋白随之减少。
为了获得高纯度的Fxn蛋白,将Ni-NTA柱纯化后含有蛋白馏分的洗脱液合并 (图 2A,泳道 E1~3),用离心过滤装置连续梯度透析,所收集的洗脱馏分如图2B所示。目的蛋白被浓缩 (泳道P),得到纯化的Fxn-his6融合蛋白。

图1 融合蛋白的诱导表达时相分析Fig. 1 Time course of his-tagged mouse Fxn expression. M: protein marker; 0−4: Coomassie Blue staining for his-tagged mFxn induced with 0.2 mmol/L IPTG for 0, 1, 2, 3, 4 hours in E. coli strain BL21(DE3).

图2 带his6标签的小鼠Fxn融合蛋白的纯化、透析和浓缩Fig. 2 Purification, dialysis, and concentrate of recombinant his-tagged mouse Fxn. (A) Purification of recombinant his-tagged mFxn protein on Ni-NTA beads and detection with Coomassie Blue stained 15% SDS-PAGE. Lysate: the lysates; FT: flow-through; W: wash; elution fractions (E1−5) were analyzed on 15% SDS-PAGE. M: protein marker. (B)Dialysis and concentrate of his-tagged mFxn and detection with Coomassie Blue stain on 15% SDS-PAGE gel. M:protein marker; E: eluate; F1−9: filter-device flow-through; P: purified, dialysed, and concentrated protein.
2.4 抗体制备及纯化
纯化的 Fxn蛋白经浓缩后与弗氏佐剂混合乳化并免疫 14~16周龄健康的雌性新西兰大白兔,再经过3次加强免疫,采取兔子心脏血获得抗血清,经硫酸铵沉淀,得到初步纯化的Fxn抗体 (见抗体应用部分)。
2.5 抗体特异性和灵敏度鉴定
为了测定该抗体的效价,我们利用 ELISA的方法,以一定浓度的抗原 (100 ng) 包被ELISA板,以500~7 812 500倍稀释的抗体与之结合,平行对照蛋白为相同浓度的在大肠杆菌中表达的带his6标记的ABCB10。ELISA数据结果表明Fxn抗体效价达1.5×106以上 (图3A)。
进一步特异性检测试验,以不同浓度的抗原Fxn (0.001~1 000 ng) 包被ELISA板,对照抗原仍为ABCB10,使用浓度与Fxn相同,以1∶5 000的稀释倍数的抗体与之结合。结果表明,Fxn抗体的特异性很高,相对亲和力达1×10−5g/L,抗原浓度为 1×10−8g/L 时还可检出 (图 3B)。
为了验证所制备抗体的质量,排除 his6-tag可能产生的影响,应用所获得的多克隆抗体按照1∶500稀释作为一抗,以辣根过氧化物酶标记(HRP) 羊抗兔IgG作为二抗,Western blotting检测抗体识别不同量的纯蛋白和细胞或小鼠组织内源Fxn的表达量。如图4A所示,Fxn抗体检测不到平行对照蛋白ABCB10-his6,但可轻易检测到 4 ng的 Fxn蛋白,而相同浓度稀释的 his6抗体两种蛋白Fxn和ABCB10都检测不到,当蛋白浓度增加到μg级,his6标记的Fxn和ABCB10均被检出。图4B显示随着Fxn纯蛋白量的不断减少,Western blotting检测到的条带由强变弱,当蛋白量减少到0.16 ng时 (图4B,泳道4),仍能够检测到Fxn蛋白的存在。
本实验制备的抗体不仅可识别体外表达的免疫原纯蛋白,而且也能识别小鼠细胞系 (N2a,图4B泳道5) 和小鼠组织 (心脏,图4B泳道7)的内源性Fxn。该抗体还可以特异性地识别人源细胞系HEK293的内源性FXN (图4B,泳道6)。

图3 ELISA检测Fxn抗体的效价和特异性Fig. 3 Titration (A) and specificity (B) of Fxn antibody detected by ELISA.

图4 Western blotting检测Fxn抗体的滴度和特异性Fig. 4 Titration and specificity detection of polyclonal antibody of Fxn by Western blotting. (A) Exclusion of immunogenicity of his6 tag. Different amounts of purified protein are indicted. (B) The high sensitivity and specificity of purified antibody detected by Western blotting with different amount of purified Fxn protein and lysates from cell lines N2a and HEK293 or from mouse tissue heart. 1−4: 20, 4, 0.8, 0.16 ng of purified mouse Fxn protein. 5−7: cell lines N2a and HEK293, mouse tissue heart.
2.6 抗体的应用
为了进一步检验该抗体除 Western blotting外是否可以用在其他研究工作中,我们检测了该抗体在免疫沉淀和免疫荧光中的灵敏度与特异性。利用protein G琼脂糖珠结合Fxn抗体,小鼠细胞系和组织裂解液为目标蛋白来源。免疫沉淀结果表明Fxn抗体能有效地识别内源性的Fxn并能从细胞或组织裂解液中把 Fxn分离出来(图 5)。
FXN是一种重要的线粒体蛋白,作为铁的伴侣分子,它可以调控线粒体内铁的动态平衡。为了从细胞水平证明自制的多克隆抗体的特异性和灵敏度 (in vivo),应用所获得的抗体,我们对内源 FXN进行了细胞内的定位实验。通过免疫荧光方法,可以清楚地观察到 FXN定位于线粒体内 (比较图6A、6B和6C)。

图5 利用免疫沉淀的方法Fxn抗体能有效分离内源性的小鼠FxnFig. 5 Isolation of endogenous mouse Fxn by Fxn polyclonal antibody with immunoprecipitation. Lysates extracted from cell line N2a and mouse tissues were applied. P: preclean of the lysates with protein G-coupled agarose beads; FT: flowthrough after IP; IP:IP sample; Ab: antibody alone; Fxn: purified protein mouse Fxn.
3 讨论
本研究成功构建了表达带有his6标签的Fxn的载体,并在大肠杆菌中诱导表达。高度纯化的Fxn蛋白作为免疫原,免疫兔子得到抗Fxn的血清,纯化后得到了高敏感性和高特异性的Fxn抗体。和其他商业销售的抗体相比,其灵敏度要高出一个数量级以上 (数据未显示)。针对以前使用的 FXN抗体只对人源样品免疫印迹效果较好,对鼠源Fxn敏感性差的问题,本抗体的制备为利用小鼠模型研究FRDA疾病创造了有利的条件。
对 FRDA的研究在铁代谢[12-15]、心血管疾病[13]、糖尿病[16]和神经退行性疾病[13,17-18]等领域引起了广泛的关注,其原因就是 FXN在线粒体的功能维持方面起到了重要作用,但其具体的功能还不是很确定。目前普遍接受的观点是 FXN作为铁伴侣分子,在铁硫簇的合成过程中提供铁,为线粒体电子传递链的正常进行提供必要的辅基[6,19-21]。我们的前期研究结果也表明FXN可以和与铁硫簇合成相关的其他核心蛋白相互作用,有助于铁硫簇的合成[11]。除了核心组分外,FXN很可能还与其他因子共同作用[22]。本抗体的产生将有助于鉴定新的与FXN相互作用蛋白,也有助于诠释FXN蛋白的功能。
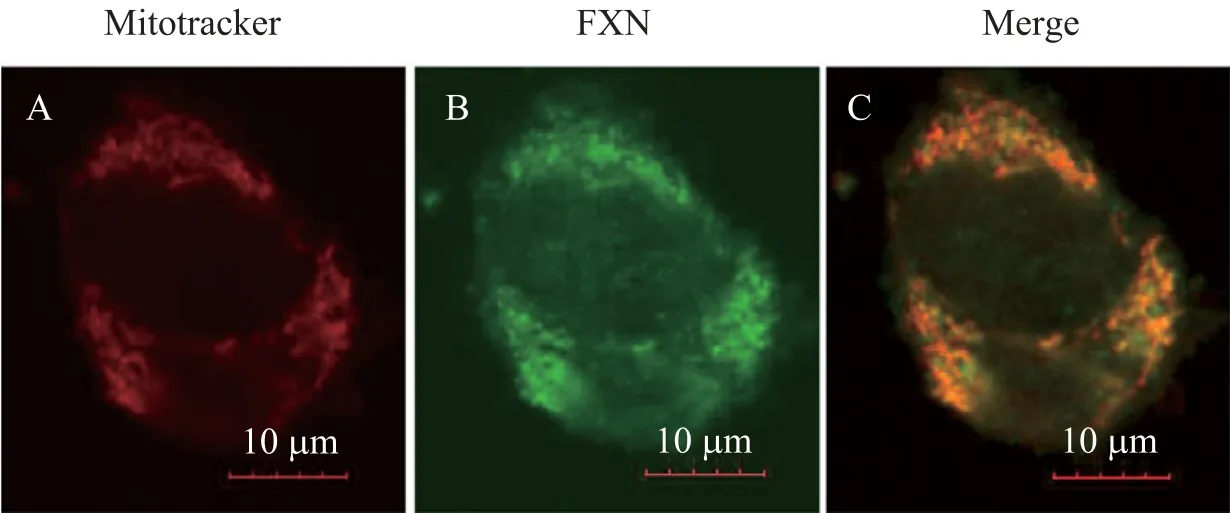
图6 利用免疫荧光Fxn抗体能检测位于线粒体中的内源性FXNFig. 6 Mitochondrial localized FXN in HEK293 cells detected by immunoflurescence. HEK293 cells were co-stained with Mitotracker and Alexafluor488-conjugated anti-rabbit IgG secondary antibody against the primary antibody of Fxn.(A) Mitotracker for mitochondria (red). (B) Frataxin (green). (C) Merge for the colocalization of mitochondrial marker and FXN.
最近的GAA重复扩增介导的Fxn表达沉默的小鼠模型没有体现FRDA病人的典型特征,加之GAA重复扩增的不稳定性为FRDA疾病的研究带来了瓶颈[23-25]。我们前期的研究结果发现两种新的 FXN亚型蛋白 (Ⅱ和Ⅲ型)特异性表达在病人受损严重的小脑和心脏组织中,增加心脏特异性的亚型蛋白Ⅲ的表达可以明显增加线粒体顺乌头酸酶活性,增加小脑特异性的亚型蛋白Ⅱ的表达可以阻止细胞的氧化损伤[11]。这就预示了亚型蛋白的表达可能与 FRDA疾病的发病机制有关。该抗体的产生也将有助于小鼠体内亚型蛋白的鉴定及其功能的检测,为建立Fxn亚型蛋白缺失的FRDA小鼠模型奠定了基础。
[1]Campuzano V, Montermini L, Lutz Y, et al. Frataxin is reduced in Friedreich ataxia patients and is associated with mitochondrial membranes. Hum Mol Genet, 1997, 6(11): 1771−1780.
[2]Campuzano V, Montermini L, Molto MD, et al.Friedreich's ataxia: autosomal recessive disease caused by an intronic GAA triplet repeat expansion.Science, 1996, 271(5254): 1423−1427.
[3]Durr A, Cossee M, Agid Y, et al. Clinical and genetic abnormalities in patients with Friedreich's ataxia. N Engl J Med, 1996, 335(16): 1169−1175.
[4]Harding AE. Friedreich's ataxia: a clinical and genetic study of 90 families with an analysis of early diagnostic criteria and intrafamilial clustering of clinical features. Brain, 1981, 104(3): 589−620.
[5]Lamarche JB, Cote M, Lemieux B. The cardiomyopathy of Friedreich's ataxia morphological observations in 3 cases. Can J Neurol Sci, 1980, 7(4):389−396.
[6]Rotig A, de Lonlay P, Chretien D, et al. Aconitase and mitochondrial iron-sulphur protein deficiency in Friedreich ataxia. Nat Genet, 1997, 17(2): 215−217.
[7]Emond M, Lepage G, Vanasse M, et al. Increased levels of plasma malondialdehyde in Friedreich ataxia. Neurology, 2000, 55(11): 1752−1753.
[8]Rai M, Soragni E, Jenssen K, et al. HDAC inhibitors correct frataxin deficiency in a Friedreich ataxia mouse model. PLoS ONE, 2008, 3(4): e1958.
[9]Al-Mahdawi S, Pinto RM, Ismail O, et al. The Friedreich ataxia GAA repeat expansion mutation induces comparable epigenetic changes in human and transgenic mouse brain and heart tissues. Hum Mol Genet, 2008, 17(5): 735−746.
[10]Koeppen AH, Michael SC, Knutson MD, et al. The dentate nucleus in Friedreich's ataxia: the role of iron-responsive proteins. Acta Neuropathol, 2007,114(2): 163−173.
[11]Xia H, Cao Y, Dai X, et al. Novel frataxin isoforms may contribute to the pathological mechanism of friedreich ataxia. PLoS ONE, 2012, 7(10): e47847.
[12]Cossee M, Puccio H, Gansmuller A, et al. Inactivation of the Friedreich ataxia mouse gene leads to early embryonic lethality without iron accumulation. Hum Mol Genet, 2000, 9(8): 1219−1226.
[13]Puccio H, Simon D, Cossee M, et al. Mouse models for Friedreich ataxia exhibit cardiomyopathy, sensory nerve defect and Fe-S enzyme deficiency followed by intramitochondrial iron deposits. Nat Genet, 2001,27(2): 181−186.
[14]Babcock M, de Silva D, Oaks R, et al. Regulation of mitochondrial iron accumulation by Yfh1p, a putative homolog of frataxin. Science, 1997, 276(5319):1709−1712.
[15]Radisky DC, Babcock MC, Kaplan J. The yeast frataxin homologue mediates mitochondrial iron efflux. Evidence for a mitochondrial iron cycle. J Biol Chem, 1999, 274(8): 4497−4499.
[16]Ristow M, Mulder H, Pomplun D, et al. Frataxin deficiency in pancreatic islets causes diabetes due to loss of beta cell mass. J Clin Invest, 2003, 112(4):527−534.
[17]Simon D, Seznec H, Gansmuller A, et al. Friedreich ataxia mouse models with progressive cerebellar and sensory ataxia reveal autophagic neurodegeneration in dorsal root ganglia. J Neurosci, 2004, 24(8):1987−1995.
[18]Martelli A, Napierala M, Puccio H. Understanding the genetic and molecular pathogenesis of Friedreich's ataxia through animal and cellular models. Dis Model Mech, 2012, 5(2): 165−176.
[19]Shan Y, Cortopassi G. HSC20 interacts with frataxin and is involved in iron-sulfur cluster biogenesis and iron homeostasis. Hum Mol Genet, 2012, 21(7):
1457−1469.
[20]Schmucker S, Martelli A, Colin F, et al. Mammalian frataxin: an essential function for cellular viability through an interaction with a preformed ISCU/NFS1/ISD11 iron-sulfur assembly complex.PLoS ONE, 2011, 6(1): e16199.
[21]Prischi F, Konarev PV, Iannuzzi C, et al. Structural bases for the interaction of frataxin with the central components of iron-sulphur cluster assembly. Nat Commun, 2010, 1: 95.
[22]Gakh O, Bedekovics T, Duncan SF, et al. Normal and Friedreich ataxia cells express different isoforms of frataxin with complementary roles in iron-sulfur cluster assembly. J Biol Chem, 2010, 285(49):38486−38501.
[23]Pollard LM, Sharma R, Gomez M, et al.Replication-mediated instability of the GAA triplet repeat mutation in Friedreich ataxia. Nucleic Acids Res, 2004, 32(19): 5962−5971.
[24]Chandok GS, Patel MP, Mirkin SM, et al. Effects of Friedreich's ataxia GAA repeats on DNA replication in mammalian cells. Nucleic Acids Res, 2012, 40(9):3964−3974.
[25]Pollard LM, Bourn RL, Bidichandani SI. Repair of DNA double-strand breaks within the (GAA*TTC)n sequence results in frequent deletion of the triplet-repeat sequence. Nucleic Acids Res, 2008,36(2): 489−500.

