枯草芽孢杆菌(Bacillus subtilis)HW201的酶学特性及沤麻试验研究
于丽萍,郭立姝,殷 博,王笑庸,曹亚彬,陈立娟
(黑龙江省科学院微生物研究所,哈尔滨 150010)
脱胶是制约亚麻产业发展的主要瓶颈之一。现行的温水沤麻方法存在着时间长、产量低、质量不稳定和污染严重等突出问题。针对这些问题,我国的科技工作者早在上世纪50年代就进行了相应的研究,先后开展了加化学助剂、立沤、水煮、太阳能、加稀土、充气等新工艺研究,并取得了较好的结果,其中一些技术也曾应用于生产。在上世纪70年代,基于沤麻基本原理,亚麻快速生物脱胶技术开始出现,并随亚麻纺织行业的兴盛而快速发展。在此方面的研究中,中国农业科学院麻类研究所、齐齐哈尔大学、湖南农业大学、黑龙江大学、东北农业大学等单位先后进行了深入的研究,丰富了脱胶理论,开发了具有实际意义的应用技术。王立群等[1]使用枯草芽孢杆菌,使亚麻果胶含量降低到4.0% ~4.5%,出麻率提高30%,改善了纤维强度和外观质量。彭源德等[2-3]研究的生物脱胶技术,其脱胶时间缩短70%以上,长麻率提高31%左右,纤维强度提高25.9%,BOD5和SS排放总量分别减少33%和89%以上。刘晓兰、江洁等[4-5]利用费氏芽孢杆菌,使亚麻脱胶周期缩短30%,麻纤维质量有明显改善。吴艳丽等[6]使用地衣芽孢杆菌进行快速脱胶,与对照相比,加菌沤麻液的果胶酶、木聚糖酶酶活均提高了50%以上,沤麻周期缩短了19% ~53%,减少了沤麻废水对环境的污染。何连芳、孙玉梅等[7]采用优势菌的脱胶周期比对照缩短50%左右,而且麻的纤维质量明显得以改善。黄小龙、孙焕良等[8-11]系统研究了南方亚麻微生物脱胶的理论与技术,完善了亚麻脱胶的理论,技术在应用中取得了良好的效果。亚麻快速生物脱胶技术的使用,有效地解决现行脱胶技术中存在的诸多问题,突破产业化发展的瓶颈,促进行业发展壮大,对亚麻种植业、纺织加工业的发展有极为重要的推动作用。
1 材料与方法
1.1 基础材料
亚麻原茎来自黑龙江省亚麻研究所,试剂为分析纯。
1.2 培养基与培养方法
营养琼脂培养基制备方法参考中国普通微生物菌种保藏管理中心主编“菌种目录第三版”[12]。果胶—蛋白胨琼脂平板的培养基组成:果胶 0.5% ~2.0%,蛋白胨1.0%,氯化钠0.5%,琼脂 1.5% ~2.0%。产酶液体培养基组成:亚麻原茎2.0% ~5.0%,硫酸铵0.1%。固体培养采用恒温30℃静止培养;液体产酶试验采用30℃、120r/min摇床培养。
1.3 生理特性试验
革兰氏染色方法,芽孢染色方法,过氧化氢酶试验,厌氧生长试验,V.P反应及V.P反应后pH试验,在叠氮化钠(0.02%)中生长试验,在氯化钠7%中生长试验,在pH5.7培养基中生长试验,淀粉水解试验,酪素水解试验,酪氨酸水解试验,马尿酸水解试验,丙酸盐利用试验,柠檬酸盐利用试验,利用葡萄糖、阿拉伯糖、木糖、甘露醇产酸试验,利用葡萄糖产气试验。具体方法参见微生物学实验手册[13]中的描述。
1.4 酶活性的测定方法
蛋白酶测定采用福林法,测定环境其中碱性蛋白酶采用0.05M硼酸盐缓冲剂(pH10),中性蛋白酶采用0.02M磷酸盐缓冲剂(pH7.5),酸性蛋白酶采用0.1M乳酸盐缓冲剂(pH3.5)。纤维素酶分别采用滤纸崩溃法与CMC糖化力法,测定环境采用0.02M磷酸盐缓冲剂(pH7.5)。淀粉酶用碘检查法测定,测定环境采用0.02M磷酸盐缓冲剂(pH7.5)。果胶酶中果胶脂酶(PE)通过羧基释放量测定,测定环境采用0.05M磷酸盐缓冲剂(pH7.5);聚半乳糖醛酸裂解酶(PGL)通过不饱和糖醛酸释放量测定,测定环境采用0.05M甘氨酸—氢氧化钠缓冲液(pH9.0);内切聚半乳糖醛酸酶(endo-PG)采用黏度法测定,测定环境为0.05M甘氨酸—氢氧化钠缓冲液(pH9.0);外切聚半乳糖醛酸酶(exo-PG)通过还原力变化测定,0.05M甘氨酸—氢氧化钠缓冲液(pH9.0)。酶活力具体方法依据《酶制剂工业》[14]中的描述进行。
1.5 PGL 基本性质
在35℃反应条件下,调整反应系统的pH,研究pH对PGL的影响。在pH7.0的条件下,调整反应温度,研究温度对PGL的影响。反应系统中分别加入1.0mmol/L的各种金属离子,然后测定酶活力,以未加入为对照,研究金属离子对 PGL的影响。酶液在0.05M的磷酸盐缓冲液(pH7.0)中,在不同的温度下保温10min后,立即取样测定剩余的酶活力,以Omin处理为对照,研究PGL的温度稳定性。
1.6 沤麻基本条件
亚麻原茎截成5cm的小段且混合均匀,精确称重后直立装入适当的小烧杯中,补加10倍重量的水及菌液,淹没其顶部,烧杯上盖平皿以减少水分蒸发,在32℃恒温箱中静止处理。
1.7 HW201在亚麻沤麻过程中的作用
基本沤麻系统经过2次灭菌处理以保证系统的无菌状态,接种HW201后进行沤麻处理,以不接种为对照,通过检测沤麻过程微生物生长和原茎减重率情况,确定HW201发挥的作用。减重率指沤麻过程中重量减少的百分比。
1.8 杂菌确定
在沤麻系统中,通过平板分离观察菌落形态与显微观察菌体形态,除HW201以外,其余皆计为杂菌。
2 结果与讨论
2.1 培养特性
目的菌株在果胶—蛋白胨琼脂平板上生长时,随果胶浓度的提高,菌株产色素量也随之提高,菌落周围颜色加深,菌落直径也随之加大,说明目的菌株能有效利用果胶类物质作为碳源,具有分解果胶的能力。在以玉米粉—豆粕粉组成的培养基中摇床培养时,在48h后开始产生色素,培养基颜色由淡青色逐渐加深,在72h后变成棕黑色。目的菌株在普通的营养琼脂培养基上生长良好,菌落污白色,边缘不整齐,表面有皱褶,表面干燥,菌落中部凹陷,四周凸起,在斜面上培养时生长良好,呈峡谷状。在营养琼脂上生长48h的菌体,革兰氏染色阳性,在显微镜下观察时,呈长杆状,多数单生,极少量两杆直线相连;芽孢近中生,卵圆形,不膨大(图1);在水片的显微镜观察时,菌体有运动性,表明鞭毛的存在。
2.2 菌株鉴定
依据《伯杰氏细菌鉴定手册》第八版[15]中的芽孢杆菌分类标准和周德庆主编《微生物学实验手册》[13]中的方法,对目的菌株进行了生理特性试验(表1)。根据试验的结果,确定目的菌株是枯草芽孢杆菌(Bacillus subtilis)。为进一步确定目的菌株的种属地位,利用BioFosun微生物鉴定系统,选择BioFosun GB3测试版,对目的菌株进行了鉴定。在测试版上呈现的图谱,经过BioFosun菌种鉴定系统判定,确定目的菌株为枯草芽孢杆菌(Bacillus subtilis),定名为枯草芽孢杆菌(Bacillus subtilis)HW201。
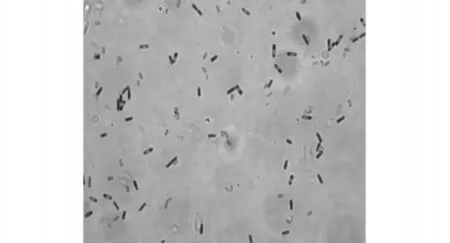
图1 目的菌株在营养琼脂上生长48h后的菌体形态(1200×)Fig.1 The growth form on nutrient agar after 48h of Bacillus subtilis HW201

表1 目的菌株的部分生理特性Tab.1 The physiological characteristics of Bacillus subtilis HW201
2.3 产酶特性
产酶培养基以切成小段的亚麻茎秆和0.1%硫酸铵组成。在培养基中接种目的菌株,保温30℃ ~32℃,摇床培养72h后测定各种酶的活性(表2)。在此条件下,目的菌株不产生纤维素酶,产生微弱的蛋白酶和淀粉酶,在检测的各种果胶酶中,聚半乳糖醛酸裂解酶(PGL)的含量最丰富,另外也产生了少量的果胶酯酶(PE),而聚半乳糖醛酸酶(endo-PG)和聚半乳糖醛酸酶(exo-PG)未检测出。
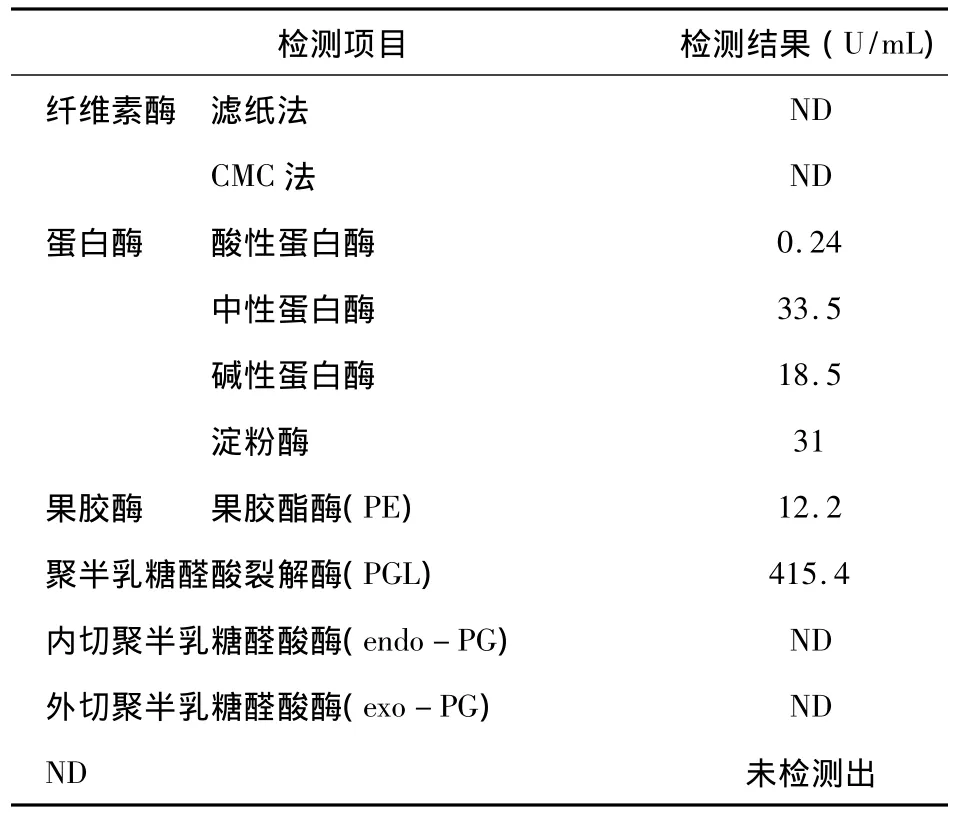
表2 目的菌株的产酶特性Tab.2 The enzyme peoperties of the Bacillus subtilis HW201
基于聚半乳糖醛酸裂解酶(PGL)在脱胶过程中起主要作用,笔者研究了聚半乳糖醛酸裂解酶(PGL)的主要性质。试验结果表明,该酶在中性及35℃的条件下表现出最大的活性,与温度相比较,pH对酶活力的影响更大(图2)。酶液在pH 7.0的缓冲溶液中,在不同的温度下保温10min后,立即取样测定剩余的酶活力,以0h酶活力为100%计算相对酶活力,结果表明,该酶在50℃以下时酶活力稳定,高于此温度后酶活力逐渐下降;该酶在沸水中处理10min后酶活力残余15%以下,处理30min后完全失活(图3)。分别在反应底物溶液中加入1.0mmol/L的各种金属离子,然后测定酶活力,以未加入任何离子的酶活力为100%。结果表明,在此浓度下Ca2+、Mg2+对酶有明显的激活作用,Cu2+、Fe2+、Zn2+、Mn2+有不同程度的抑制作用,其中 Mn2+的抑制率达95%(图4)。
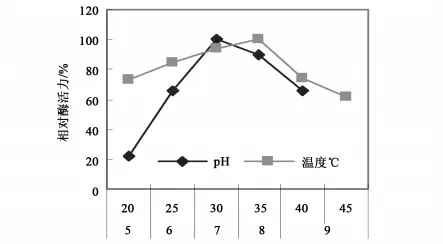
图2 温度及pH对PGL酶活性的影响Fig.2 The effected on enzime activity of PGL pH and temperature
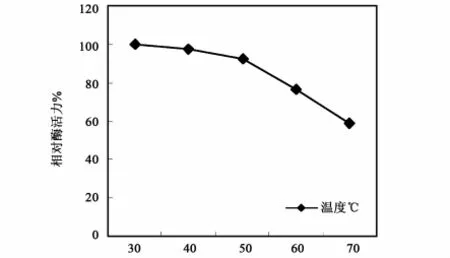
图3 PGL的温度稳定性Fig.3 The temperature stability of PGL
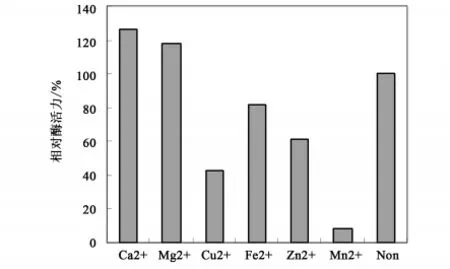
图4 金属离子对PGL酶活力的影响(1.0mM/L)Fig.4 The effect on enzyme actuvity of PGL by matel ions
2.4 HW201对亚麻沤麻过程的影响
用10倍重量0.4%尿素溶液浸没切成小段的亚麻原茎,接种0.2%菌液,置32℃保湿温箱中静止培养,观察沤麻过程中各种成分的变化情况。结果表明沤麻液中HW201的生长持续到36h,以后趋于稳定;随沤麻进程的进行,杂菌生长也同样迅速,在36~48h时达到稳定,并在数量上超过HW201(图5);HW201可以在沤麻液中生长并发挥其加速沤麻的作用。沤麻液中总糖、可溶性氮、可溶性磷的消耗与微生物的生长相对应,在36h前迅速下降,以后消耗速度缓慢,与后期微生物的生长呈现的停滞相一致,而可溶性氮的含量在后期的回升是菌体死亡后自溶释放出含氮物质的结果(图6和图7)。对沤麻进程中的pH,前期下降,以后又缓慢回升,但总体上稳定在5.8~6.9。以0.4%尿素溶液直接浸泡亚麻原茎作对照,进行亚麻原茎减重试验的结果表明,HW201的作用在12h后开始显现,并在随后的进程中明显提高沤麻液对亚麻原茎的减重效果(图8)。说明HW201对原茎中不溶性物质的溶出是十分有利的。
2.5 枯草芽孢杆菌HW201沤麻条件
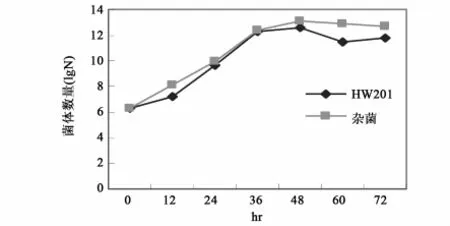
图5 沤麻过程中HW201与杂菌的变化Fig.5 The change of Bacillus subtilis HW201 and the other bacteria in Retting process for flax
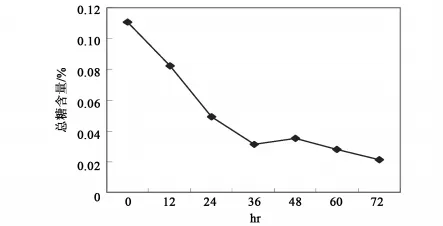
图6 接种HW201对沤麻过程中溶性总糖的影响Fig.6 The effects on the total soluble sugar in the retting process by Inoculated Bacillus subtilis HW201
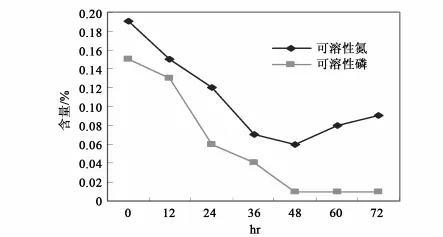
图7 接种HW201对沤麻过程中溶性氮磷的影响Fig.7 The effects on the total soluble nitrogen and phosphorus in the retting process by Inoculated Bacillus subtilis HW201
为了解传统温水沤麻工艺中的各种工艺参数对HW201沤麻作用效果的影响,进行了单因子试验研究。在沤麻水中添加了0.4%尿素,温度、pH、固液比和接种量以试验要求确定,沤麻时间48h,以亚麻原茎减重率作为沤麻效果和进程的指标。结果表明,适宜的沤麻温度与HW201的适宜生长温度是一致的,在32℃ ~38℃的范围内都取得了较好的减重效果,34℃时减重率最大(图9);初始pH值也表现出类似的结果,在中性附近条件下,减重率较大,与HW201的生长要求也是一致的。但试验过程中观察到偏酸性的环境中,前期沤麻液色度比较重,暗示了酸性条件可以加快可溶性物质的溶出速度;随接种量的提高,原茎减重率呈现出上升趋势,总体上对原茎减重率影响不大;随固液比的降低,原茎减重率上升趋势,显微观察沤麻液中的微生物丰度也随之上升,表明低的固液比条件下,沤麻液中营养相对丰富,有利于微生物的生长。
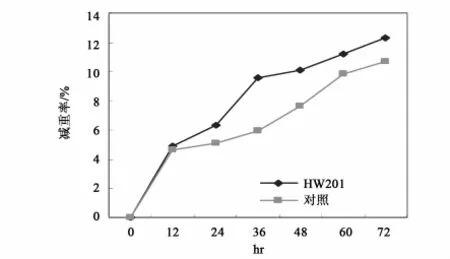
图8 接种HW201对沤麻过程中亚麻原茎减重影响Fig.8 The effects on the reductive Weight in the retting process by Inoculated Bacillus subtilis HW201
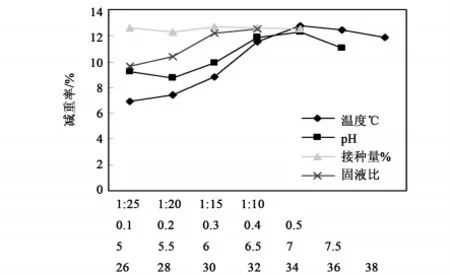
图9 沤麻条件对HW201作用效果的影响Fig.9 The effect on retting results by the conditions
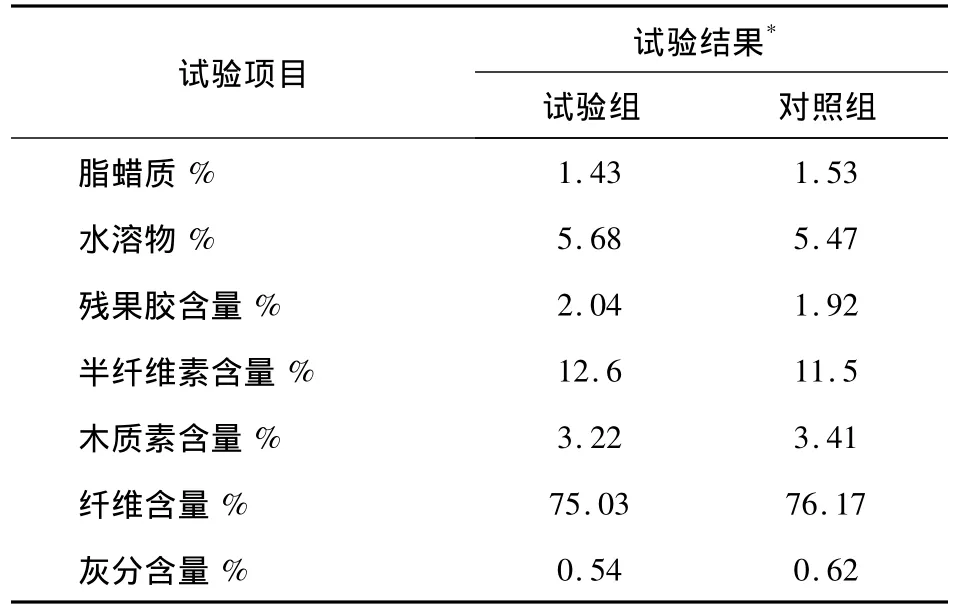
表3 HW201沤麻试验结果Tab.3 The results of joint retting with Bacillus subtilis HW201 and penetration enhancers
2.6 枯草芽孢杆菌HW201沤麻效果
沤麻试验在1 000mL烧杯中进行,亚麻原茎切成12cm长小段,紧密地竖直装入杯中,重量为85g左右,加沤麻水浸没亚麻原茎,高出约0.5cm,实际加水量约760mL;沤麻水含0.4%尿素、0.2%枯草芽孢杆菌HW201菌液;静止保温32℃,沤麻至终点;终点以经验判断。以清水直接沤麻作为对照试验。沤麻结束后的麻茎,扒取亚麻纤维进行成分测定(表3),总体上两者比较一致,使用新的沤麻方法达到了传统工艺的水平。
3 结语
在亚麻温水沤麻过程中,其沤麻液的基本环境适合一些细菌的生长,在前期进行的分离筛选过程中,观察到原始沤麻液中的微生物区系主体是芽孢杆菌、假单胞菌及其他一些种属的细菌。本研究中的目的菌株分离自沤麻液,在沤麻试验中表现优异,经鉴定是一株枯草芽孢杆菌(Bacillus subtilis)。在加菌温水沤麻其他一些研究结果中,使用的微生物集中在芽孢杆菌属,如费氏芽孢杆菌、环状芽孢杆菌、地衣芽孢杆菌、枯草芽孢杆菌等,研究结果与之是一致的。针对目的菌株进行的产酶试验,没有检测出纤维素酶,同时进行的长达一周的滤纸崩解试验,滤纸没有明显变化,试验结果表明目的菌株对亚麻纤维不会产生降解作用。目的菌株产生少量的果胶脂酶(PE)与比较丰富聚半乳糖醛酸裂解酶(PGL),它们是脱胶过程中的主力酶,其最适的作用条件与沤麻条件基本一致,能够保证其酶解作用的高效进行。沤麻液中的各种金属离子对聚半乳糖醛酸裂解酶(PGL)有不同的影响,控制Ca2+、Mg2+在适当的浓度对促进脱胶有重要作用,而为保证沤麻过程的顺利进行,沤麻液中 Cu2+、Fe2+、Zn2+、Mn2+尤其是 Mn2+的含量需要得到控制。
对于亚麻原茎提取液的成分分析和进行的枯草芽孢杆菌HW201培养试验的结果皆表明,沤麻液中的氮源缺乏,需要补充。在补充0.4%尿素的条件下,枯草芽孢杆菌HW201能够在沤麻液中进行生长和繁殖。在严格无菌条件下,利用HW201进行纯菌沤麻和原沤麻液直接浸泡的结果差异说明了HW201在沤麻过程中起到的作用,同时也再次证明了沤麻过程中微生物的重要性。在沤麻液中,HW201和其他杂菌的生长是同步进行的,与沤麻液中营养物质的消耗是相对应的,由于人为接种HW201的因素,使HW201的起始丰度较大,在沤麻前期HW201的数量一直占有优势,在后期可能是因为营养物质的匮乏使得HW201生长停滞,而杂菌得到更大的发展空间。在试验的沤麻条件中,固液比对沤麻有比较大的影响,降低固液比后沤麻液中的微生物生长更加旺盛,明显缩短了沤麻周期,沤麻处理后的麻纤维在化学成分上与传统生产工艺基本一致。
[1]王立群,关凤芝.亚麻微生物脱胶技术的研究[J].中国麻作,1995,17(1):34-36.
[2]彭源德,刘正初.亚麻快速生物脱胶技术研究·I亚麻快速脱胶菌株的选育[J].中国麻业,2003,25(3):135-138.
[3]彭源德,刘正初.亚麻快速生物脱胶技术工厂化生产研究[J].中国农业科学,2005,38(4):849-853.
[4]刘晓兰,郑喜群.生物法亚麻原茎脱胶过程及新工艺[J].应用与环境工程学报,2001,(4):392-395.
[5]江洁,刘晓兰.添加NH4HCO3对亚麻生物脱胶的影响[J].应用与环境生物学报,2004,10(1):53-55.
[6]吴丽艳,段继强.亚麻脱胶茵的分离、筛选和鉴定[J].云南大学学报,2007,29(4):419-423.
[7]何连芳,孙玉梅.亚麻微生物脱胶优势菌的选育及其应用[J].工业微生物,2005,35(4):25-28.
[8]黄小龙,孙焕良.南方亚麻微生物脱胶技术及其理论研究·Ⅳ酶法脱胶菌种的分离与鉴定[J].湖南农业大学学报,2004,30(1):14-16.
[9]黄小龙,孙焕良.南方亚麻微生物脱胶技术及其理论研究·Ⅱ主要外界因子对果胶酶及亚麻脱胶效果的影响[J].中国麻业,2003,25(4):193-195.
[10]黄小龙,孙焕良.南方亚麻天然水沤法脱胶影响因子的研究[J].湖南农业大学学报,2003,29(4):271-274.
[11]陈灿,孙焕良.南方亚麻微生物脱胶技术及其理论研究·2麻茎特性对亚麻脱胶的影响[J].中国麻作,2000,22(2):37-40.
[12]中国普通微生物菌种保藏管理中心.菌种目录(第三版)[K].北京:中国农业科技出版社,1997.
[13]周德庆.微生物学实验手册[K].上海:上海科学技术出版社,1986.
[14]张树政.酶制剂工业(下册)[M].北京:科学出版社,1984.
[15]布坎南RE,吉本斯.伯杰细菌鉴定手册(第8版)[K].北京:科学出版社,1984.

