真菌诱导子与吸附树脂对新疆紫草毛状根中萘醌积累的影响
张璞,王芳,朱查山
新疆农业大学农学院,新疆 乌鲁木齐 830052
真菌诱导子与吸附树脂对新疆紫草毛状根中萘醌积累的影响
张璞,王芳,朱查山
新疆农业大学农学院,新疆 乌鲁木齐 830052
张璞, 王芳, 朱查山. 真菌诱导子与吸附树脂对新疆紫草毛状根中萘醌积累的影响. 生物工程学报, 2013, 29(2): 214−223.
Zhang P, Wang F, Zhu CS. Influence of fungal elicitor and macroporous resin on shikonin accumulation in hairy roots ofArnebia euchroma(Royle) Johnst. Chin J Biotech, 2013, 29(2): 214−223.
通过考察真菌诱导子与吸附树脂对新疆紫草毛状根中萘醌积累的影响,获得真菌诱导子与吸附树脂对萘醌类物质积累的最佳处理,为规模化生产提供依据。以新疆紫草毛状根为试验材料,将黑曲霉、米曲霉诱导子及其混合诱导子、大孔吸附树脂添加到 M-9培养基中,采用分光光度法测定毛状根总萘醌含量。试验结果表明:在毛状根培养10 d时以2.5∶50的比例添加混合诱导子,总萘醌含量是对照的2.28倍;在此结果基础上,在培养第0天添加大孔吸附树脂NKA-9,总萘醌含量最高是对照的3.71倍;黑曲霉诱导子与米曲霉诱导子有协同效应;在生物反应器中添加混合诱导子及大孔吸附树脂NKA-9,其总萘醌含量是对照的4.17倍。米曲霉诱导子、混合诱导子对毛状根增殖有促进作用;同时添加大孔吸附树脂NKA-9及混合诱导子能提高毛状根总萘醌含量。生物反应器培养毛状根为今后利用新疆紫草毛状根规模化生产总萘醌提供了理论参考。
新疆紫草,毛状根,总萘醌,真菌诱导子,大孔吸附树脂
新疆紫草Arnebia euchroma(Royle) Johnst是我国传统药用紫草类植物中临床药效最好的一种[1-2],主要化学成分为萘醌类色素、多糖及脂肪酸,具有抗生育、抗炎、抗肿瘤、杀菌、抗病毒和免疫调节等作用[3]。由于多年的滥采滥挖,新疆紫草野生资源日益减少,造成目前市场供不应求的局面,给临床使用、中成药加工等带来很大影响。毛状根是利用发根农杆菌 Ri质粒诱发的结果,具有生长迅速、分支多,在无激素培养基上能够自主、持续生长,有效成分高且含量稳定的特性,是大量生产药用植物有效成分的新方法。新疆紫草毛状根[4]提取物具有抑菌[5]、抗氧化[6]作用,可作为原料进行开发利用。因此,对新疆紫草毛状根的培养条件进行研究具有重要的现实意义。研究表明真菌诱导子能够促进和提高紫草细胞[7-11]的萘醌含量,刘长军等[12]在新疆紫草细胞培养中添加真菌诱导子,发现黑曲霉诱导子促进紫草素合成效果最好,并且能够促进细胞紫草素的外排。傅旭庆等[13]在紫草细胞培养中,加入米根霉粗提物可显著提高紫草宁色素产量,并可加快胞内色素分泌到培养液中的速率和数量。大孔吸附树脂具有较强的吸附能力,能够减弱对次生代谢物反馈抑制作用。罗雪梅等[14]在硬紫草细胞培养中添加大孔吸附树脂,发现其对紫草素具有良好的吸附能力,可用于细胞培养中紫草素的提取。吴频梅等[15]采用大孔吸附树脂吸附分离藏红花培养液中藏红花苦素,认为方法可行,前景广阔。目前还未见到大孔吸附树脂及真菌诱导子用于新疆紫草毛状根的研究报道。本研究主要考察了真菌诱导子与大孔吸附树脂的添加时间、添加量对毛状根的增殖及总萘醌的积累,对生物反应器放大培养新疆紫草毛状根进行了初探,旨在为新疆紫草毛状根的规模化生产提供依据。
1 材料与方法
1.1 材料
1.1.1 试验材料与菌株
新疆紫草毛状根[4]由本课题组提供;黑曲霉Aspergillusniger与米曲霉Aspergllus oxyzae由新疆农业大学农学院病理实验室提供。
1.1.2 培养基及试剂
SH培养基[16],M-9培养基[16],PDA马铃薯真菌培养基,NKA-9大孔吸附树脂 (日本三菱产),丙酮,无水乙醇、4% NaOH和5 mol/L HCl溶液等。
1.1.3 主要试验仪器
721-型紫外分光光度计 (武汉爱斯佩科学仪器有限公司),高压灭菌锅 (上海博迅实业有限公司),超净工作台 (苏州净化),微量移液器(DRAGONMED PROLINE),电子天平(METTLER TOLEDO),温控气浴摇床 (金坛市精达仪器制造有限公司),电热鼓风干燥箱 (上海博迅实业有限公司),循环水式多用真空泵 (郑州长城科工贸有限公司),2 L气升式生物反应器(购于中国科学院过程工程研究所)。
1.2 方法
由于紫草素及其衍生物的合成呈非偶联型,即紫草素及其衍生物是在毛状根生长停止后才进行合成的,因此,新疆紫草毛状根的液体培养采用“二阶段培养法”:第一阶段以毛状根生物学产量的增殖为目的,第二阶段以毛状根生产紫草素及其衍生物为目的。具体参见芦苇华等[16]的方法。
1.2.1 毛状根扩繁
将2~4 cm的毛状根接种在装有50 mL SH培养基的 250 mL锥形瓶中,蔗糖 30 g/L,肌醇1 g/L,水解酪蛋白0.5 g/L。培养液pH 5.8,在20~25 ℃,摇床速度 (100±10) r/min,暗培养条件下进行振荡培养15 d收获,备用。
1.2.2 毛状根生产阶段
将 1.2.1培养的毛状根接种在装有 100 mL M-9培养基的250 mL锥形瓶中,接种量2 g/瓶,培养基pH 5.8,蔗糖30 g/L。在20~25 ℃、摇床转速为 (100±10) r/min下暗培养。培养25 d收获,灭菌吸水纸吸干其表面水分,称重,计算毛状根增殖倍数。增殖倍数=(M2−M1)/M1,M1为接种时毛状根鲜重,M2为培养一定时间后毛状根鲜重。提取毛状根总萘醌并测定A516,计算其平均含量。每个处理3次重复,计算平均值。
1) 真菌诱导子添加量摇瓶试验。在接种时,分别将米曲霉、黑曲霉按照诱导子匀浆液/M-9培养基体积比为0.5 mL∶50 mL、1 mL∶50 mL、1.5 mL∶50 mL、2 mL∶50 mL 和 2.5 mL∶50 mL的梯度比例添加至M-9培养基中,不添加真菌诱导子为对照 (CK),对照同样分做两组,用于确定未处理同批接种物之间是否存在差异。
2) 真菌诱导子添加时间摇瓶试验。将黑曲霉按照诱导子匀浆液/M-9培养基体积比为1.5 mL∶50 mL添加。混合曲霉诱导子按照 (米曲霉诱导子匀浆液+黑曲霉诱导子匀浆液)/M-9培养基体积比为 (1+1.5) mL∶50 mL添加。添加时间梯度为培养0 d、5 d、10 d、15 d和20 d。
3) 大孔吸附树脂NKA-9添加量摇瓶试验。按照质量梯度2 g/瓶、4 g/瓶和6 g/瓶添加大孔吸附树脂NKA-9于M-9培养基中。混合曲霉诱导子按照 (米曲霉诱导子匀浆液+黑曲霉诱导子匀浆液)/M-9培养基体积比为(1+1.5) mL∶50 mL在培养10 d添加。
4) 真菌诱导子和大孔吸附树脂的反应器试验。将毛状根接种在装有1 700 mL M-9培养基的2 L气升式反应器中,培养基pH 5.8,培养温度20~25 ℃,通气量0.4 vvm,接种量90 g,培养第0 d加入51 g活化好的吸附树脂NKA-9。混合曲霉诱导子按照 (米曲霉诱导子匀浆液+黑曲霉诱导子匀浆液)/M-9培养基体积比为2.5 mL∶50 mL、培养10 d添加 (依据真菌诱导子添加量摇瓶试验结果)。不添加为对照 (CK)。暗培养 25 d收获,称重、计算增殖倍数,测定A516,计算总萘醌含量。
1.2.3 真菌诱导子制备
刮取米曲霉、黑曲霉少量孢子分别接种于PDA真菌液体培养基中,在 25~26 ℃、(120±5) r/min、暗培养5 d收获菌球,将菌球用蒸馏水充分洗涤后,匀浆2 980×g离心5 min,取沉淀加入 10倍体积的蒸馏水,放入灭菌锅中121 ℃灭菌20 min后抽滤,滤液即为真菌诱导子粗提物。分装滤液,冷藏于冰箱。
1.2.4 大孔吸附树脂处理
将未使用过的大孔吸附树脂在丙酮溶液中浸泡5 h,过滤后加入1.5倍的丙酮进行淋洗,然后用蒸馏水冲洗至无色并使溶液显中性,再用4% NaOH溶液和5 mol/L HCl溶液分别冲洗树脂,每次都用蒸馏水冲洗至中性,湿法保存待用。
1.2.5 大孔吸附树脂洗脱及总萘醌含量测定
将吸附了总萘醌的大孔吸附树脂浸入100 mL无水乙醇中,在25 ℃、100 r/min条件下振摇10 h,用双层纱布过滤,滤液补充至100 mL,精密量取滤液5 mL,置25 mL量瓶中,加无水乙醇至刻度,摇匀。采用分光光度法测定A516。萘醌含量=(A516/242)×10×V×n,其中,V为培养液的体积(mL);n为稀释倍数。每个处理3次重复,计算平均值及标准差。
1.2.6 毛状根总萘醌提取及其含量测定
采用中国药典中记载的测定羟基萘醌总色素的方法进行测定。具体方法:取培养一定时间的毛状根适量,于50 ℃干燥3 h,粉碎 (过三号筛) 精密称取约0.5 g,置100 mL 量瓶中,加95%无醇至刻度,4 h内时时振摇,过滤,精密量取续滤液5 mL于25 mL容量瓶中,加无水乙醇至刻度,摇匀。采用分光光度法在516 nm的波长处测定吸光度A516,按左旋紫草素(C16H16O5) 的吸收系数为242 计算,即得毛状根萘醌含量 (%)=(A516/242)×10×100%。每个处理3次重复,计算平均值及标准差。
1.2.7 培养液中紫草素及其衍生物的萃取及含量测定
将培养一定时间的毛状根培养液与等体积的石油醚混合,在分液漏斗中振荡,静置,分液,反复萃取至无色,合并萃取液,采用分光光度法测定萃取液的A516,培养液中萘醌含量=(A516/242)×10×V×n,其中,V为培养液的体积(mL);n为稀释倍数。总萘醌含量=毛状根萘醌含量+培养液萘醌含量。每个处理3次重复,计算平均值及标准差。
所有数据采用SPSS19进行统计分析。
2 结果与分析
2.1 真菌诱导子添加量对摇瓶培养的毛状根增殖倍数的影响
图1结果显示,米曲霉诱导子不同添加量其毛状根增殖倍数均较对照及黑曲霉诱导子高,米曲霉诱导子粗提物/M-9培养基体积比为0.5 mL∶50 mL时,毛状根增殖倍数达峰值,为2.55倍;黑曲霉诱导子粗提物/M-9培养基体积比为1.5 mL∶50 mL时,毛状根增殖倍数达峰值,为1.28倍。表明低浓度的米曲霉诱导子对毛状根增殖有较明显促进效应。方差分析结果表明两种诱导子之间无显著差异,但与对照均具有显著差异 (P=0.05)。
2.2 真菌诱导子添加量对摇瓶培养的总萘醌含量的影响
图2结果显示,凡添加真菌诱导子的总萘醌含量均较对照高,并且随着添加量的增加,两种真菌诱导子的总萘醌含量均呈先升后降趋势,但达峰值的添加量有所不同,且浓度均较低。黑曲霉诱导子添加量在1.5 mL∶50 mL时总萘醌含量为0.85%,米曲霉诱导子添加量在1 mL∶50 mL时为0.81%,两种诱导子之间无显著性差异,但与对照均具有显著差异 (P=0.05)。表明两种真菌诱导子在低浓度时均可促进萘醌的积累。

图1 不同诱导子对毛状根增殖的影响Fig. 1 Effects of different elicitors on hairy roots proliferation. CK: control.
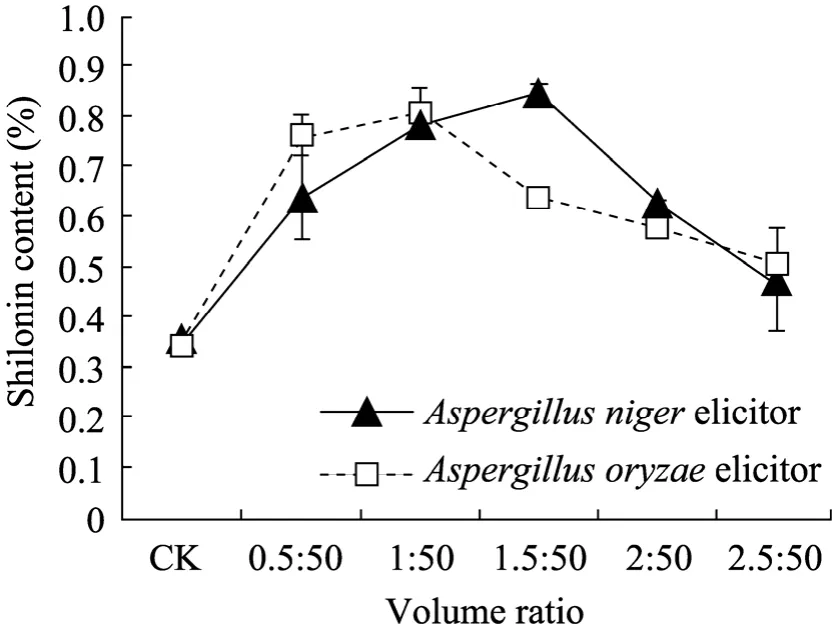
图2 真菌诱导子添加量对总萘醌含量的影响Fig. 2 Effects of fungal elicitor adding quantity on total naphthoquinone content. CK: control.
2.3 真菌诱导子添加时间对摇瓶培养的毛状根增殖倍数的影响
在上述试验结果基础上,图3结果显示,随着真菌诱导子添加时间的延迟,两种真菌诱导子的毛状根增殖倍数均呈先升后降趋势,且均在培养15 d时添加达峰值,添加黑曲霉诱导子、混合诱导子的毛状根增殖倍数分别为 7.03倍、6.34倍,方差分析表明,黑曲霉诱导子促进毛状根增殖效果优于混合诱导子 (P=0.01)。表明真菌诱导子具有促进毛状根增殖的效果。
2.4 真菌诱导子添加时间对摇瓶培养的总萘醌含量的影响
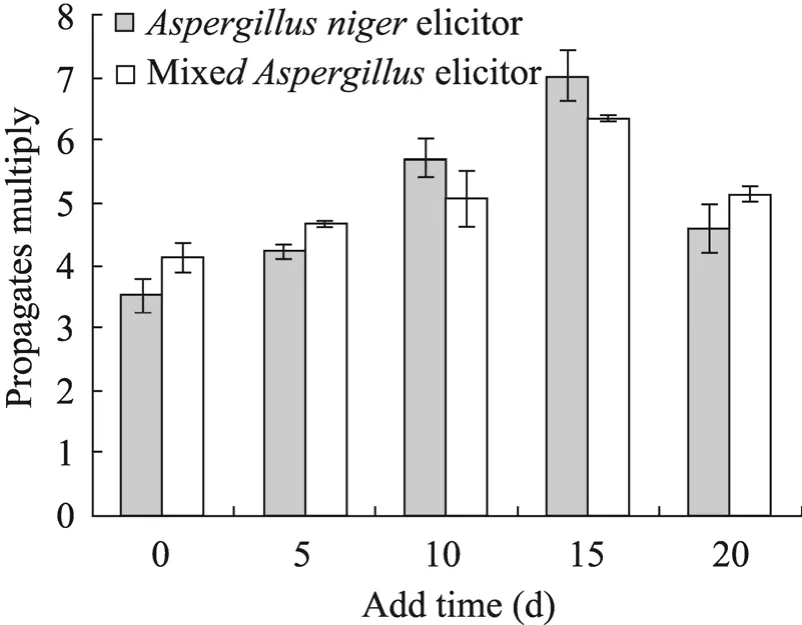
图3 真菌诱导子添加时间对毛状根增殖的影响Fig. 3 Effects of fungal elicitor adding time on hairy roots proliferation.
在上述试验基础上,图4结果显示,随着添加时间的延迟,两种真菌诱导子的总萘醌含量均呈先升后降趋势,但达峰值的时间有所不同,混合诱导子在培养 10 d时添加其总萘醌含量达峰值为1.55%,黑曲霉诱导子在培养5 d时添加总萘醌含量达峰值为 1.50%,两者之间无显著差异,但两者与对照相比均有显著差异 (P=0.05),分别较对照高0.87%、0.42%。即黑曲霉诱导子处理的萘醌积累时间长,要早添加,如果延迟添加,萘醌含量下降但幅度较小。混合诱导子处理的萘醌积累所需时间稍短,如果延迟添加,萘醌含量下降且幅度较大。表明黑曲霉诱导子的作用效应较混合诱导子的弱,黑曲霉诱导子与米曲霉有协同效应。
试验发现,当培养5 d时添加真菌诱导子,两种处理的培养液萘醌含量基本一致,总萘醌含量以黑曲霉诱导子处理的效果优于混合诱导子的处理 (图4),进一步说明黑曲霉诱导子与米曲霉具有协同效应,混合诱导子中的米曲霉诱导子具有促进萘醌类物质向细胞外释放的作用。
2.5 大孔吸附树脂添加量对摇瓶培养的毛状根增殖及总萘醌含量的影响
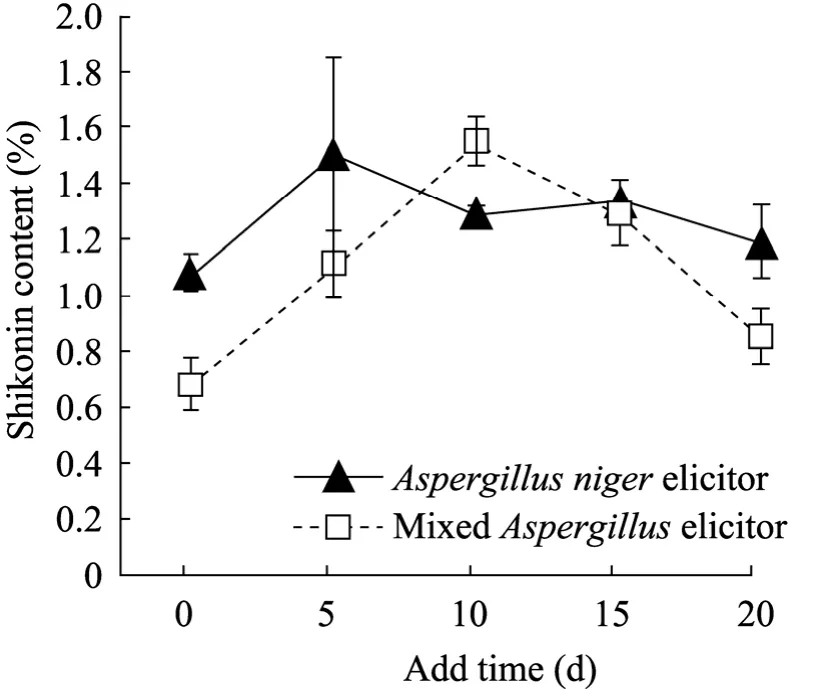
图4 真菌诱导子添加时间对总萘醌含量的影响Fig. 4 Effects of fungal elicitor adding time on total naphthoquinone content.

图 5 大孔吸附树脂添加量对毛状根增殖和萘醌积累的影响Fig. 5 Effects of macroporous adsorption resin adding quantity on hairy roots proliferation and total naphthoquinone content.
在2.4试验结果的基础上,图5结果显示,随着大孔吸附树脂添加量的增加,毛状根增殖倍数呈下降趋势,添加量为2 g/瓶时毛状根增殖倍数最高为 8.17倍,明显较对照高 (P=0.05),是对照的1.38倍。添加树脂的3个处理总萘醌含量均明显较对照高,大孔吸附树脂添加量为4 g/瓶时总萘醌含量最高为5.49%,是对照的3.71倍。表明添加树脂明显促进萘醌类物质的合成和积累,综合考虑毛状根增殖及萘醌含量,以添加2 g/瓶的树脂为宜。3个处理间萘醌含量无明显差异。
2.6 混合诱导子、大孔吸附树脂对反应器中的毛状根增殖倍数及总萘醌含量的影响
在上述试验结果的基础上,单独添加混合诱导子及混合诱导子与大孔吸附树脂同时添加,图6结果显示,毛状根增殖倍数及总萘醌含量均高于对照,以混合诱导子与大孔吸附树脂同时添加的毛状根增殖倍数及总萘醌含量最高,分别为4.23倍、4.5%,总萘醌含量是对照的4.17倍。表明混合诱导子与大孔吸附树脂共同作用有利于毛状根萘醌类物质在反应器中的合成及向培养液中分泌。至于总萘醌含量较摇瓶培养低的原因可能是毛状根在反应器中的各项参数不同所致,有待进一步研究。
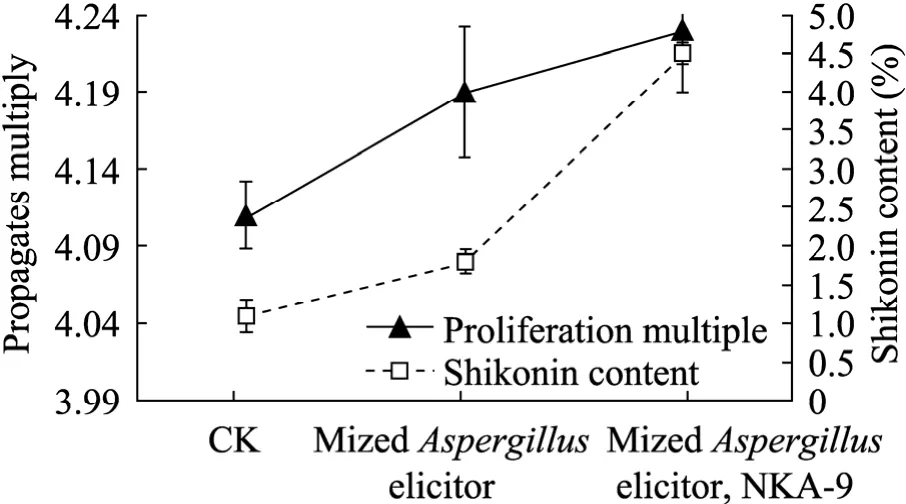
图6 不同处理对毛状根增殖、萘醌积累的影响Fig. 6 Effects of different treatment on hairy roots proliferation and naphthoquinone accumulation. CK:control.
3 讨论
3.1 真菌诱导子与植物次生代谢物
许多研究表明,真菌诱导子的种类、浓度及添加时间影响植物次生代谢物的产量。刘峻等[9]研究认为黑曲霉诱导子能提高人参毛状根总苷含量,并可促进人参毛状根的生长。王剑文等[17]采用黄花蒿内生炭疽菌细胞壁寡糖提取物处理可促进毛状根青蒿素的合成,青蒿素含量较对照高出64.29%。晏琼等[18]、王学勇等[19]认为酵母提取物与非生物诱导子具有协同作用,其诱导效果比单独使用某一种诱导子的诱导效果更好,这种相互作用可以更有效地促进次生代谢产物的合成。在紫草细胞培养的研究中,刘长军等[12]对 4种真菌诱导子的作用研究认为,黑曲霉诱导子对紫草细胞次生代谢产物效果最好,而宁文等[20]则认为米曲霉诱导子效果最好。本研究中,单独使用黑曲霉诱导子及添加混合曲霉诱导子均能促进萘醌的积累,这一结果与刘峻等[9]、晏琼等[18]、刘长军等[12]、宁文等[20]的一致。可见不同种类的真菌诱导子适合不同的培养材料,真菌诱导子促进细胞次生代谢物含量的提高具有普遍性。
在毛状根培养过程中,真菌诱导子的诱导效果与诱导子浓度、作用时间密切相关[18],这可能与真菌诱导子的组分[21]抑或含量有关,而这又取决于真菌的培养时间及培养条件。王红等[22]采用大丽花轮枝孢、葡枝根霉和束状刺盘孢等3种真菌诱导子处理青蒿毛状根,均能促进毛状根中青蒿素的积累,在加入诱导子4 d后毛状根中的青蒿素含量最高。宁文等[21]在颠紫草细胞培养第8 d时加入米曲霉诱导子,12 h后细胞内的紫草素含量即开始增加。傅旭庆等[13]在6 d加入米根霉,促进紫草细胞中紫草素含量提高的作用最大,较对照高2.24倍。本研究中采用培养5 d的米曲霉、黑曲霉诱导子,在毛状根培养5 d、10 d时添加,总萘醌含量均达最高,此结果与宁文等[21]、傅旭庆等[13]类似,表明不适宜的添加时间影响毛状根的生长代谢,从而影响总萘醌的合成。
3.2 大孔吸附树脂的作用
罗雪梅等[14]在硬紫草细胞培养 4 d时加入R-A树脂色素产量提高两倍;谢文化等[23]认为树脂的添加量为 6.7%时,色素的产量比常规培养分别增加了5.2倍、6倍。反应器与AB-8树脂柱相偶联进行同时分离色素的培养实验,结果使色素产量增加了5.3倍。孟琴等[24]在培养硬紫草细胞8 d时加入大孔吸附树脂,继续培养6 d后,紫草素产率提高了76.4%;曹琳等[25]在丹参毛状根培养生产丹参酮的研究中认为大孔树脂 X-5可以在丹参毛状根培养生产丹参酮的过程中有效地对丹参酮进行原位富集,总丹参酮吸附率达到92.4%。上述研究表明,无论是细胞培养还是毛状根培养,大孔吸附树脂均具有使细胞内次生代谢物向外不断排放、从而使其产量提高的作用。芦韦华等[26]单独添加大孔吸附树脂 NKA-9总萘醌含量为3.64%。本研究添加大孔吸附树脂NKA-9同时加入混合诱导子总萘醌含量较对照增加了3.71倍,表明大孔吸附树脂与真菌诱导子具有协同作用。当培养25 d后毛状根呈无色半透明状,培养液为淡黄色,NKA-9树脂呈紫红色,说明总萘醌在新疆紫草毛状根和培养液中的含量极低,表明大孔吸附树脂 NKA-9具有降低细胞内萘醌浓度的作用,这与罗雪梅[14]、谢文化[23]、孟琴[24]、曹琳[25]等的研究结果一致。试验过程中发现,对照的培养液中萘醌含量不到 0.1%,说明萘醌主要积累在毛状根内,添加树脂的毛状根、培养液中萘醌含量均为0,说明毛状根合成的所有萘醌被大孔吸附树脂所吸附,萘醌未在毛状根内产生积累,表明新疆紫草毛状根在培养过程中添加大孔吸附树脂及真菌诱导子可有效克服萘醌的反馈抑制现象,从而大幅度提高萘醌产量。本研究采用3种真菌诱导子及大孔吸附树脂进行研究,结果表明混合曲霉诱导子10 d添加的萘醌含量略高于黑曲霉诱导子5 d添加的,笔者推测米曲霉诱导子具有促进毛状根萘醌的释放效果,因此认为混合曲霉诱导子效果最好,但其成分及最适比例有待进一步研究。
根据本研究结果综合考虑,毛状根生产萘醌过程中大孔吸附树脂与真菌诱导子具有协同作用,且添加大孔吸附树脂尤为重要。试验表明过量的树脂影响毛状根生长,降低萘醌总产量,增加成本,因此综合考虑大孔吸附树脂 NKA-9添加量不超过4 g/100 mL为宜。
4 结论
毛状根培养10 d时按照混合诱导子与M-9培养基为2.5 mL∶50 mL的体积比添加可促进萘醌积累。大孔吸附树脂与真菌诱导子具有协同作用,可大幅提高新疆紫草毛状根萘醌含量(5.49%),此结果为新疆紫草毛状根规模化生产奠定了理论基础。
致谢:感谢新疆农业大学农学院罗明教授在翻译修改上所提供的帮助。
[1]Xiao J, Yang YG, Guo YM, et al. Advances in tissue culture ofArnebia euchroma. Acta Bot Boreal-Occid Sin, 2004, 24(8): 1560−1564 (in Chinese).
肖洁, 杨映根, 郭奕明, 等. 新疆紫草组织培养的研究进展. 西北植物学报, 2004, 24(8):1560−1564.
[2]Ge F, Wang XD, Wang YC. Advances in studies on medicinal Radix Arnebiae Seu Lithospermi. Chin Trad Herbal Drugs, 2003, 34(9): 6−10 (in Chinese).
葛锋, 王晓东, 王玉春. 药用紫草的研究进展.中草药, 2003, 34(9): 6−10.
[3]Zhang XJ, Mu K, Yang SS, et al. Influence of polysaccharides of lithospermum erythrorhizon on fluidity and band-3 protein level of red cells membrance of S180mice. Asia-Pacific Trad Med,2007, 3(9): 32−35 (in Chinese).
张秀娟, 穆坤, 杨姗姗, 等. 紫草多糖对S180荷瘤小鼠红细胞膜流动性与带3蛋白的影响. 亚太传统医药, 2007, 3(9): 32−35.
[4]Chen YF, Lu WH, Wang F, et al. Induction and culture of hairy roots fromArnebia euchroma(Royle) Johnst. Acta Bot Boreal-Occid Sin, 2008,28(12): 2423−2428 (in Chinese).
陈永芳, 芦韦华, 王芳, 等. 新疆紫草毛状根的诱导及培养. 西北植物学报, 2008, 28(12):2423−2428.
[5]Li CF, Wang F, Ma H, et al. Study on antibacterial activity ofArnebia euchroma(Royle) Johnst hairy roots extract. J Agri Univ Hebei, 2010, 33(3):92−96 (in Chinese).
李翠芳, 王芳, 麻浩, 等. 新疆紫草毛状根提取物的抑菌活性研究. 河北农业大学学报, 2010,33(3): 92−96.
[6]Li CF, Wang F, Ma H, et al. Study on antioxidant activity ofArnebia euchroma(Royle) Johnst hairy roots. Xinjiang Agri Sci, 2010, 47(2): 291−295 (in Chinese).
李翠芳, 王芳, 麻浩, 等. 新疆紫草毛状根提取物的抗氧化活性研究. 新疆农业科学, 2010,47(2): 291−295.
[7]Li CF, Li XR, Wang F, et al. Analysis on content of Total sugar and polysaccharides fromArnebia euchroma(Royle) Johnst hairy roots. Acta Bot Boreal-Occid Sin, 2010, 30(1): 180−183 (in Chinese).
李翠芳, 李新仁, 王芳, 等. 新疆紫草毛状根总糖及多糖含量分析. 西北植物学报, 2010, 30(1):180−183.
[8]Zhai XL, Fan GZ, Zhan YG. Accumulation of triterpenoids inBetula platyphyllasuspension culture induced by a fungal elicitor. Sci Silvae Sin,2011, 47(6): 42−47 (in Chinese).
翟俏丽, 范桂枝, 詹亚光. 真菌诱导子促进白桦悬浮细胞三萜的积累. 林业科学, 2011, 47(6):42−47.
[9]Liu J, Ding JY, Zhou QG, et al. Studies on influence of funal elicitor on hairy root ofPanax ginsengbiosynthesis ginseng saponin and biomass.China J Chin Mater Med, 2004, 29(4): 18−21 (in Chinese).
刘峻, 丁家宜, 周倩耘, 等. 真菌诱导子对人参毛状根皂苷生物合成和生长的影响. 中国中药杂志, 2004, 29(4): 18−21.
[10]Zhang XF, Zhang RT, Wang NN, et al. Effects of fungal elicitors on accumulation of indole alkaloids inCatharanthus roseuscalli. Chin Trad Herbal Drugs, 2004, 35(2): 201−204 (in Chinese).
张向飞, 张荣涛, 王宁宁, 等. 真菌诱导子对长春花愈伤组织中吲哚生物碱积累的影响. 中草药, 2004, 35(2): 201−204.
[11]Chen C, Fu CH, Jiang GM, et al. Relationship between phenolics content and Taxol production in Taxus cells. J Huazhong Agri, 2005, 24(1): 83-87(in Chinese).
陈超, 付春华, 姜革民, 等. 红豆杉细胞中的酚类化合物含量与紫杉醇产量之间的关系. 华中农业大学学报, 2005, 24(1): 83-87.
[12]Liu CJ, Hou SS. Effects of fungal encitors on the cell growth and the shikonin biosynthesis in Amebta euchroma cells in suspen-sion culture. Acta Photophys Sin, 1998, 24(1): 6−10 (in Chinese).刘长军, 侯嵩生. 真菌诱导子对新疆紫草悬浮培养细胞的生长和紫草素合成的影响. 植物生理学报, 1998, 24(1): 6−10.
[13]Fu XQ, Lü DW. Effects of rhizopus oryzae elicitor on shikonin secretion in suspension cultures ofArnebia euchroma. Acta Photophys Sin, 1998,24(4): 380−384 (in Chinese).
傅旭庆, 吕德伟. 米根霉诱导因子对紫草细胞培养中紫草宁色素分泌的影响. 植物生理学报,1998, 24(4): 380−384.
[14]Luo XM, Yuan LH, Zhou ML, et al. Enhanced productions of shikonin derivatives ofLithospermum erythrorhizoncell suspension cultures in situ extraction. J Nanjing Univ Chem Technol, 1996, 18(2): 12−16 (in Chinese).
罗雪梅, 袁丽红, 周名立, 等. 吸附树脂对紫草细胞培养生产紫草色素的原位提取. 南京化工大学学报, 1996, 18(2): 12−16.
[15]Wu PM, Yuan LH, Huang J, et al. Separation of crocin and picrocrocin from saffron cell culture broth by macroporous resin adsorption. Food Sci,2011, 32(24): 7−12 (in Chinese).
吴频梅, 袁丽红, 黄晶, 等. 利用大孔吸附树脂吸附分离藏红花细胞培养液中藏红花素和藏红花苦素. 食品科学, 2011, 32(24): 7−12.
[16]Lu WH, Chen YF, Wang F, et al. Effects of physical and chemical conditions onArnebia euchroma(Royle) Johnst hairy roots and Shikonin and its derivatives. J Huazhong Agri Univ, 2012,31(1): 50−54 (in Chinese).
芦韦华, 陈永芳, 王芳, 等. 理化条件对新疆紫草毛状根培养及紫草素含量的影响. 华中农业大学学报, 2012, 31(1): 50−54.
[17]Wang JW, Zheng LP, Tan RX. The preparation of an elicitor from a fungal endophyte to enhance artemisinin production in hairy root cultures ofArtemisia annuaL. Chin J Biotech, 2006, 22(5):829−834 (in Chinese).
王剑文, 郑丽屏, 谭仁祥. 促进黄花蒿发根青蒿素合成的内生真菌诱导子的制备. 生物工程学报, 2006, 22(5): 829−834.
[18]Yan Q, Hu ZD, Wu JY. Synergistic effects of biotic and abiotic elicitors on the production of tanshinones inSalvia miltiorrhizahairy root culture. China J Chin Mater Med, 2006, 31(3):14−17 (in Chinese).
晏琼, 胡宗定, 吴建勇. 生物与非生物诱导子协同作用对丹参毛状根培养生产丹参酮的影响. 中国中药杂志, 2006, 31(3): 14−17.
[19]Wang XY, Cui GH, Huang LQ, et al. Effects of elicitors on tanshinone class composition accumulation inSalvia miltiorrhizahairy roots.China J Chin Mater Med, 2007, 32(10): 106−108.
王学勇, 崔光红, 黄璐琦, 等. 诱导子对丹参毛状根中丹参酮类成分积累影响. 中国中药杂志,2007, 32(10): 106−108.
[20]Ning W, Cao RQ. Fractionation and biological activity ofaspergillus oryzaeelicitor promoting biosynthesis of shikonin derivative. Acta Bot Sin,1996, 38(5): 32−39 (in Chinese).
宁文, 曹日强. 促进紫草色素合成的米曲霉诱导子的纯化和活性鉴定. 植物学报, 1996, 38(5):32−39.
[21]Ning W. Study on the mechanisms of regulating shikonin derivatives in onosma paniculatum cell cultures byAspergillus oryzaeelicitors[D].Nanjing: Nanjing University, 1995 (in Chinese).
宁文. 米曲霉诱导物调节滇紫草细胞紫草色素合成机制的研究[D]. 南京: 南京大学, 1995.
[22]Wang H, Ye HC, Li GF, et al. Effects of fungal elicitors on cell growth and artemisinin accumulation in hairy root cultures ofArtemisia annua.Acta Bot Sin, 2000, 42(9): 905−909 (in Chinese).
王红, 叶和春, 李国凤, 等. 真菌诱导子对青蒿发根细胞生长和青蒿素积累的影响. 植物学报,2000, 42(9): 905−909.
[23]Xie WH, Liang SZ, Yu RQ, et al. Shikonin production by cell culture ofLithospermum erythrorhizonwith resin adsorbent. J South China Univ Technol: Nat Sci, 1999, 27(6): 27−31 (in Chinese).
谢文化, 梁世中, 余若黔, 等. 添加吸附树脂紫草细胞培养生产紫草色素. 华南理工大学学报:自然科学版, 1999, 27(6): 27−31.
[24]Meng Q, Xue L. Investigation on adsorption of lithospermum erythrorhizon onto fungal cell wall polysaccharides. Chin J Chem Engin, 2003, 11(4):464−466.
[25]Cao L. In situ extraction effect of macroporous resins on tanshinones inSalvia miltiorrhizahairy root culture. China J Chin Mater Med, 2007,32(17): 1752−1754 (in Chinese).
曹琳. 大孔树脂在丹参毛状根培养生产丹参酮过程中的原位富集. 中国中药杂志, 2007, 32(17):1752−1754.
[26]Lu WH, Pan Q, Wang F, et al. Influence of culture conditions onArnebia euchromahairy roots growth and shikonin content. Acta Botan Boreali-Occident Sin, 2012, 32(8): 1686−1691(in Chinese).
芦韦华, 潘颀, 王芳, 等. 培养条件对新疆紫草毛状根生长及紫草素含量的影响. 西北植物学报, 2012, 32(8): 1686−1691.
September 22, 2012; Accepted: November 19, 2012
Fang Wang. Tel: +86-991-8762261; E-mail: Wangfang1hao@126.com
新疆维吾尔自治区自然科学基金 (No. 200821170) 资助。
Influence of fungal elicitor and macroporous resin on shikonin accumulation in hairy roots ofArnebia euchroma(Royle) Johnst
Pu Zhang, Fang Wang, and Chashan Zhu
College of Agronomy,Xinjiang Agricultural University,Urumqi830052,Xinjiang,China
In order to investigate the effects of fungal elicitor and macroporous adsorption resin on shikonin accumulation in hairy roots of arnebia euchroma (Royle) Johnst, we used spectrophotometry to determine the total naphthoquinone content of the hairy roots, by adding different volume ratio ofAspergillus nigerelicitor,Aspergillus oryzaeelicitor, and the macroporous resin into the M-9 liquid medium at different culture time. The results show that the total naphthoquinone content was 2.28 times higher than the control when we added mixed elicitorsof Aspergillus nigerandAspergillus oryzaeat the ratio of 2.5:50 in the 10th day of hairy roots cultivating. The total naphthoquinone content was 3.71 times higher than that of the control, when we added macroporous adsorption resin NKA-9.Aspergillus nigerelicitor exhibited synergistic effect withAspergillus oryzaeelicitor to enhance the naphthoquinone. Also, the total naphthoquinone level was 4.17 times higher than that of the control by adding mixed fungal elicitor and macroporous adsorption resin NKA-9 in the bioreactor.Aspergillus oryzaeand mixed elicitor could promote the hairy roots proliferation, and macroporous adsorption resin NKA-9 and mixed elicitor increased the total naphthoquinone content. In summary, the measure developed forArnebia euchroma(Royle) Johnst hairy roots cultivating in bioreactors may potential for large-scale production of naphthoquinone.
Arnebia euchroma(Royle) Johnst, hairy roots, shikonin, fungal elicitor, macroporous adsorption resin
Supported by: Natural Science Foundation of Xinjiang Uygur Autonomous Region of China (No. 200821170).
(本文责编 陈宏宇)

