钼靶下导丝定位活检在诊断触诊阴性乳腺病灶中的应用
卫文俊,陶霖玉,齐柯,王玉蓉,曾凤好,黄银平,张好云,冯铎
(广东医学院附属南山医院甲状腺乳腺外科,广东深圳 518052)
乳腺癌是我国近年来增长幅度最大的恶性肿瘤之一,其发病率、死亡率及绝对患病例数呈明显上升趋势[1]。早期发现、早期诊断、早期治疗仍是提高乳腺癌生存率、改善预后的关键。随着钼靶X线检查方法在乳腺疾病诊断中的应用,乳腺隐匿性病变的发现越来越多,对不可触及的乳腺可疑病变如何尽早地确立诊断并采取适当的治疗,对早期诊断、提高乳腺癌患者的生存率具有重要意义。基于此,本研究对我院52例钼靶检查发现可疑病变,而临床触诊阴性、彩超无阳性发现的乳腺病灶进行了钼靶下导丝定位活检术,现将结果报道如下。
1 资料与方法
1.1 一般资料
选择2009年5月至2012年6月间在本院就诊的临床乳腺触诊阴性、彩超检查无特殊阳性发现、乳腺钼靶检查提示高度可疑恶性病变的患者52例,均为女性,年龄34~71岁,中位年龄46岁。就诊原因:体检钼靶检查发现21例,乳房胀痛23例,乳头溢液5例,乳癌术后常规对侧乳腺检查3例。钼靶显示:沙粒样、簇状钙化25例,毛刺状小结节13例,结构扭曲8例,多种征象混合表现者6例;BI-RADS分类:4级40例,5级12例。
1.2 导丝定位
术前1~2 h在放射科行钼靶引导下导丝定位。使用美国HOLOGIC钼靶数字乳腺机。采用巴德乳腺定位针,将内芯导丝前端“Y”倒钩预置于定位针内。所有患者均先常规拍摄钼靶X线轴位和侧斜位片。
定位方法:将可疑病变置于加压板方形窗口内,取轴位或侧位显示病变部位,标记病变位置及穿刺点,消毒皮肤,以0.5%利多卡因局部麻醉,在标记穿刺点用巴德乳腺定位针穿刺,再分别取轴位和侧位,进一步确定穿刺的位置和深度,穿刺针尖到达病灶边缘或内部后将导丝推入,使前端打开并固定于病变组织内,即原位释放(图1)。
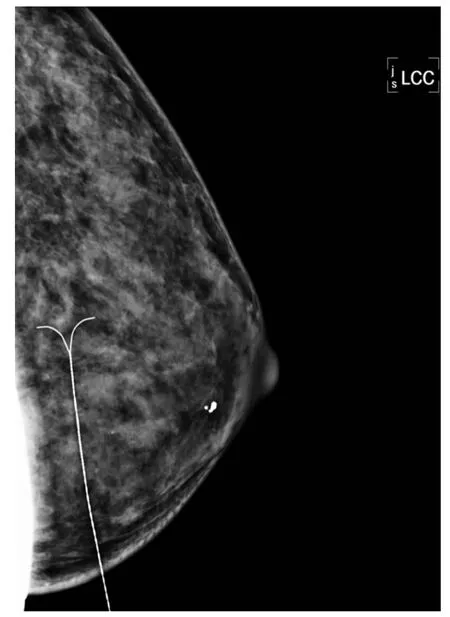
图1 导丝原位释放、固定于病变部位Fig 1 The guide wire was released in situ,and fixed in the lesion
1.3 手术活检
钼靶下导丝定位后2 h内行手术活检。以0.5%利多卡因局部浸润麻醉,术中根据导丝的位置和方向设计手术切口,沿导丝引导方向,充分暴露导丝所在腺体,达导丝尖端位置,准确切除导丝定位的病变区并将切除的组织块再行钼靶X线摄片以检验病灶切除是否完全(图2),而后分别行快速冰冻和常规病理检查,根据病理诊断结果作相应的治疗。

图2 切除病变组织标本钼靶复检Fig 2 The tissue of breast lesion was rechecked after resection
2 结 果
本组52例患者行钼靶引导下导丝定位均一次操作成功,定位满意,手术切除准确,无导丝折断或移位现象,无感染、血肿等并发症。术后病理检查提示:恶性病变16例(30.8%),其中浸润性导管癌7例,导管原位癌6例,导管内癌早期浸润2例,浸润性小叶癌1例;按照 AJCC第6版乳腺癌分期标准:0期2例(12.5%),Ⅰ期8 例(50%),Ⅱ期 5 例(31.3%),Ⅲ期1例(6.2%)。良性病变36例(69.2%),其中乳腺增生症15例,纤维腺瘤7例,轻~中度非典型增生5例,炎症性病变4例,导管内乳头状瘤3例,乳腺导管扩张症2例。
恶性病变根据情况行保乳或改良根治术,良性病变行病变部位或区段切除术,乳腺癌检出率为30.8%,诊断准确率为100% 。52例患者术后随访均行彩超检查,平均随访14(6~32)个月,原乳腺病灶位置均未发现复发及可疑病变,16例恶性病变中有1例术后26个月出现肺转移,经化疗后病情稳定。
3 讨 论
在全球范围内,女性乳腺癌发病率均呈明显上升趋势,但在过去几十年里,北美和欧洲等许多西方国家的乳腺癌死亡率却呈现逐年下降趋势,究其原因,很大程度上是由于乳腺钼靶X线筛检的普及使更多的早期乳腺癌得以发现以及治疗水平的提高[2-3]。有研究[4]表明,触诊阴性的乳腺癌较可触及肿块的乳腺癌恶性程度明显低,并且肿瘤细胞的核异型性、生物学活性和转移潜能也均降低,因此,及早发现触诊阴性的乳腺高度可疑病变并确立诊断是提高乳腺癌早期诊断的关键。钼靶X线摄片是发现早期乳腺病变的一种较为敏感的方法,与单凭触诊检查相比,其诊断准确率明显提高,成为乳腺疾病常规检查手段[5]。来自美国癌症研究中心的1项大型研究表明,自检并不能降低乳腺癌病死率,唯一能降低病死率的筛查方法是乳腺钼靶X线摄片[6]。本研究发现,在52例临床触诊阴性的病例中,钼靶检查发现乳腺恶性病变16例(30.8%),其中0期2例(12.5%),Ⅰ期8例(50%),以早期病变为主。因此,钼靶X线摄片是筛查早期乳腺癌最重要的方法,但如何使钼靶检查发现的可疑病变及早得到明确诊断并及时得到全面治疗,一直是临床面临的问题。
病理诊断是判断乳腺病变良恶性的“金标准”,以往,对无法扪及肿块者行手术活检带有一定的盲目性。一方面,常常会造成手术范围扩大,给患者造成不必要的伤害;另一方面,更为严重的是病灶切除不准确,存在漏诊的可能性,使早期乳腺癌无法获得及时诊断,从而延误病情。因此,对乳腺可疑病灶的术前定位显得尤为重要。
目前常用的定位方法有超声定位[7]、MRI定位和钼靶定位。对于在彩超下发现的微小囊实性病变,可行超声引导下定位活检或真空辅助旋切活检,但彩超对微小钙化不够灵敏,对结构扭曲病变也较难区分,具有一定的局限性。如本研究中,所有病例彩超检查均报告为乳腺增生等改变,未提示明显恶性病变。MRI引导下定位对设备要求较高,且成本较高,尚不能普遍开展。乳腺钼靶定位是在钼靶X线引导下通过乳腺穿刺将金属导丝引入病灶部位,原位释放并固定,确保了定位的精确性,这样既能准确切除病变又能最大限度地缩小手术范围,尤其对表现为恶性钙化或结构扭曲病变的定位切除更具优势,该方法可操作性强、安全性高、并发症少,被越来越多地应用于临床[8-10]。本组52例患者均一次定位成功,在导丝的引导下术中均准确切除病变组织,诊断准确率100%,效果满意。
对于临床触诊阴性的乳腺病灶行钼靶下导丝定位活检,须注意以下几点:(1)选择合适病例。根据美国放射协会制定的BI-RADS分类标准,BI-RADS 5级为高度可疑恶性病灶,其恶性比率达77% ~97%,对这类病变行切除活检既具有诊断意义又能起到治疗作用,因此认为切除活检是此类病变最佳的处理方法[11-13];BI-RADS 4级为可疑恶性,建议活检。本组患者中,BI-RADS 5级12例,其中11例为恶性病变,1例为中度不典型增生,恶性比例为91.6%,与文献[12]报道相符;BI-RADS 4级40例,其中5例为恶性病变,4例为轻~中度不典型增生,31例为良性病变,恶性比例为12.5%;BI-RADS 4级恶性比例明显较BI-RADS 5级低,故在活检病例的选择上,对于钼靶报告BIRADS 5级的病例为活检的绝对指征,对于钼靶报告BIRADS 4级的病例,需结合患者的年龄、家族史、月经状况等综合考虑,对高度可疑病例,也应积极手术活检。本组中有5例术后病理诊断为轻—中度不典型增生。目前多数学者将乳腺导管上皮和小叶上皮非典型增生视为乳腺癌的癌前病变,其发生浸润性癌的危险性是一般人群的4~5倍[14],因此,对于此部分病例的手术切除活检更具意义。(2)定位的准确与否对手术活检的结果至关重要,术前常规拍摄钼靶X线轴位和侧斜位片,术中需用带方形窗口加压板固定,取轴位或侧位再次定位,穿刺后确定穿刺针达病变位置及深度无误后再释放、固定导丝。(3)定位后较短时间内手术,避免患者活动后定位导丝弯曲、折断、移位等。本组病例均在定位后2 h内行手术活检,均一次成功。(4)活检切口的选择要适当,确保活检切口在下一步手术中能被切除这样避免了因活检切口切除不完整而导致局部复发的可能性。(5)病变组织切除后,标本需再次行钼靶X线检查并与术前所示病灶对比,以证实病变组织完全切除,避免漏切,保证活检的准确性。
总之,钼靶下导丝定位活检可以有效提高乳腺可疑病灶切除的准确性及乳腺癌的早期诊断率,是临床触诊阴性、彩超无特异发现的乳腺可疑病变的一种安全、可行、确切的重要诊断方法,值得临床推广。
[1]杨玲,李连弟,陈育德,等.中国乳腺癌发病死亡趋势的估计与预测[J].中华肿瘤杂志,2006,28(6):438-440.
[2]ALTHUIS M D,DOZIER J D,ANDERSON W F,et al.Global trends in breast cancer incidence and mortality 1973-1997[J].Int J Epidemiol,2005,34(2):405-412.
[3]AUTIER P,BONIOL M,La VECCHIA C,et al.Disparities in breast cancer mortality trends between 30 European countries:retrospective trend analysis of WHO mortality database[J].BMJ,2010,341:c3620.
[4]SKINNER K A,SILBERMAN H,SPOSTO R,et al.Palpable breast cancers are inherently different from nonpalpable breast cancers[J].Ann Surg Oncol,2001,8(9):705-710.
[5]雷益,朱嘉英,李顶夫,等.乳腺疾病的X线钼靶与MRI对比研究[J].中华放射学杂志,2004,38(8):864-867.
[6]THOMAS D B,GAO D L,RAY R M,et al.Randomized trial of breast self-examination in Shanghai:final results[J].J Natl Cancer Inst,2002,94:1445-1457.
[7]姜华,国光菊,刘刚.超声引导下组织切取活检对乳腺癌Ⅱ、Ⅲ级预防的价值[J].现代医学,2011,39(5):575-577.
[8]VUORELA A L,AHONEN A.Preoperative stereotactic hookwire localization of no palpable breast lesions with and without the use of a further stereotactic check film[J].Anticancer Res,2000,20(2B):1277-1279.
[9]HEMMER P H,KLAASE J M,MASTBOOM W J,et al.The continued utility of needle localised biopsy for non-palpable breast lesions[J].Eur J Surg Oncol,2004,30(1):10-14.
[10]KOUSKOS E,GUI G P,MANTAS D,et al.Wire localisation biopsy of non-palpable breast lesions:reasons for unsuccessful excision[J].Eur J Gynaecol Oncol,2006,27(3):262-266.
[11]MARKOPOULOS C,KOUSKOS E,REVENAS K,et al.Open surgical biopsy for nonpalpable breast lesions detected on screening mammography[J].Eur J Gynaecol Oncol,2005,26(3):311-314.
[12]WIRATKAPUN C,LERTSITHICHAI P,WIBULPHOLPRASERT B.Positive predictive value of breast cancer in the lesions categorized as BI-RADS category 5[J].J Med Assoc Thai,2006,89(8):1253-1259.
[13]HOOMTJE L E,PEETERS P H,MALI W P,et al.Is stereotactic large-core needle biopsy beneficial prior to surgical treatment in BI-RADS 5 lesions?[J].Breast Cancer Res Treat,2004,86(2):165-170.
[14]COSTA A,ZANINI V.Precancerous lesions of the breast[J].Nat Clin Pract Oncol,2008,5(12):700-704.
——导丝概述及导丝通过病变技巧

