早产儿视网膜病变小鼠模型视网膜PEDF的表达和血清PEDF水平的变化及其意义
张梅虹 章学英 杜鹃
(复旦大学附属金山医院儿科,上海 201508)
早产儿视网膜病变(retinopathy of prematurity,ROP)是一种增殖性视网膜病变,是儿童致盲的主要眼病之一。目前研究[1]认为,ROP是由于早产儿视网膜发育不全及病理性新生血管形成所致。血管新生是血管生成刺激因素和血管生成抑制因素相互作用的结果。色素上皮衍生因子(pigment epi-thelium derived factor,PEDF)是目前已知的天然存在于眼内的最强新生血管抑制因子,它能拮抗多种促血管生长因子,有效抑制视网膜新生血管的生长,而不干扰视网膜血管的正常发育[2]。本实验通过观察高氧诱导的ROP小鼠模型视网膜PEDF的表达及血清PEDF水平的变化,探讨PEDF在ROP小鼠模型不同阶段中的作用,为临床研究ROP提供实验依据。
1 资料与方法
1.1 实验动物及分组 选择7日龄健康C57BL/6J新生小鼠112只,雌雄不拘,新生小鼠未断奶,与哺乳母鼠一同饲养,平均每窝6只。C57BL/6J新生小鼠为清洁级动物,由上海必凯实验动物有限公司提供。将新生小鼠按照随机数字表随机分为模型组(n=56)与对照组(n=56)。模型组新生小鼠于生后第7天与哺乳母鼠一起置于密闭氧箱内饲养,氧箱一端为进气孔,接入湿化的氧气和氮气的混合气体,氧气流量3~4 L/min,氮气流量0.5~1 L/min;另一端为出气孔,氧箱顶端有测氧孔,连接氧气分析仪(美国Ceramatec公司生产,型号:OM-25AE),每天监测氧浓度5次,使氧箱内氧浓度维持在(75±2)%,控制室温在(23±2)℃,日光照明。每2 d打开氧箱更换母鼠、垫料,添加饲料和水。在高氧环境中饲养5 d,于生后第12天返回到空气环境中与母鼠共同饲养。对照组新生小鼠和哺乳母鼠一起在(23±2)℃环境中饲养。
1.2 视网膜铺片的制作(ADP酶组织化学法) 2组分别取生后第12、14、17天新生小鼠各3只(6只眼),腹腔内注射氯胺酮40~50 mg/kg麻醉,4%多聚甲醛溶液左心室灌注后,立即摘取眼球并将其固定于4%多聚甲醛溶液中,4℃过夜。解剖显微镜下沿角膜缘后约1 mm处环行剪开,去除角膜、晶状体、玻璃体、巩膜、脉络膜,以视乳头为中心作4~5个放射状切口;用0.05 mol/L的Tris-马来酸缓冲液(pH7.2)漂洗;37℃反应液中孵育15 min[反应液:浓度0.2 mol/L的Tris-马来酸缓冲液(pH7.2)中加入3 mmol/L硝酸铅、6 mmol/L氯化镁、1 mg/mL ADP,ADP由美国Sigma公司提供];漂洗后用10%硫化铵显色,甘油明胶封片。在光学显微镜下观察视网膜血管发育及增生的情况。
1.3 视网膜冷冻切片的制作 2组分别取生后第12、17、22天新生小鼠各5只(10只眼),氯胺酮麻醉,4%多聚甲醛灌注后摘取眼球,剪去角膜和前房,除去玻璃体,将剩下的眼球壁标本放入4%多聚甲醛中固定1 h;用0.1 mol/L磷酸盐缓冲液(PBS)清洗标本后置于30%蔗糖中,4℃过夜。吸去标本上液体,浸入OCT液中,在-20℃冷冻切片机上,做与视神经矢状轴平行的厚6μm的连续切片,选取切片时避开视乳头周围。
1.4 视网膜新生血管内皮细胞核计数 2组分别取生后第12、17、22天新生小鼠各5只(10只眼),每只眼球每间隔30μm(5张)取1张切片,共取10张切片,HE染色,在光学显微镜下计数每张切片上突破视网膜内界膜并与内界膜有紧密联系的新生血管内皮细胞核的数目,计算平均每只眼球每张切片的内皮细胞核数目。
1.5 免疫组化法检测视网膜PEDF的表达 2组分别取生后第12、17、22天新生小鼠各5只(10只眼),每只眼球每间隔30μm(5张)取1张切片,共取10张切片,按试剂盒要求进行免疫组化操作。一抗:兔抗小鼠PEDF多克隆抗体,1∶100稀释,由美国ADL公司提供;二抗(即用型):二步法羊抗兔IgG[辣根过氧化物酶(HRP)],由北京中杉金桥生物技术有限公司提供。以切片中见棕黄色颗粒(DBA染色)为阳性。PEDF表达强度判断:以细胞浆着棕褐黄色颗粒为阳性细胞,在高倍显微镜(×400)下随机选取10个视野,计数每个高倍镜视野的细胞数及阳性细胞数,计算平均每只眼球每张切片的阳性细胞百分率。
1.6 血清PEDF检测 2组分别取生后第7、12、17、22天新生小鼠各8只,用摘除眼球法采血(0.3~0.5)mL,静置30 min,3000 r/min离心10 min,分离血清,-20℃保存。血清PEDF采用双抗体夹心 ABC-酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)法检测。操作方法按照试剂盒说明书。试剂盒由上海森雄科技实业有限公司提供(一抗由美国ADL公司生产)。
1.7 统计学处理 采用STATA7.0统计分析软件进行统计学分析。计量资料结果以均数±标准差()表示,2组间结果的比较采用非配对t检验,多组间结果的比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 视网膜新生血管形态学及定量观察
2.1.1 视网膜新生血管形态学观察 与对照组比较,模型组小鼠在生后第12天(出氧箱当天),视网膜血管管径变细、分支减少、走行僵直,中央部视网膜可见大片无灌注区,周边部视网膜仍可见部分小血管结构;在生后第14天(出氧箱后2 d),视网膜血管明显扩张、迂曲,在视网膜灌注区和无灌注区交界的视网膜中周部开始出现少量新生血管;在生后第17天(出氧箱后5 d)视网膜血管更加扩张、迂曲,大量的新生血管形成,血管网结构及分布极其紊乱,可见新生血管丛、微血管瘤及渗出。见图1。
2.1.2 视网膜新生血管的定量观察 对照组小鼠视网膜未见或极少见突破内界膜的血管内皮细胞核。模型组小鼠在生后第17天和第22天时可见较多突破内界膜长入玻璃体的血管内皮细胞核,单独或成簇出现,与对照组同时点以及同组第12天比较,差异有统计学意义(P<0.01和0.05)。见表1、图2。
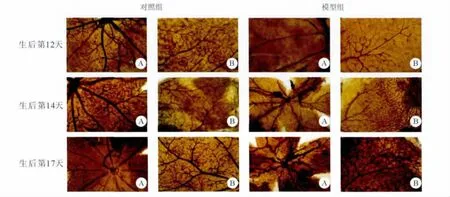
图1 新生小鼠视网膜血管铺片(A:×40,B:×400,ADP酶组织化学染色)
表1 新生小鼠视网膜不同时点突破内界膜的血管内皮细胞核计数()

表1 新生小鼠视网膜不同时点突破内界膜的血管内皮细胞核计数()
注:与同组生后第12天比较,*P<0.05
组别 n 眼 生后第12天 生后第17天 生后第22天 F值 P值模型组 5 10 0.7±1.1 69.4±9.3* 76.0±8.4* 332.86 0.000对照组 5 10 0.9±1.0 1.5±1.2 1.3±1.1 0.34 0.713 t值 -0.39 24.26 27.58 P值 0.705 0.000 0.000
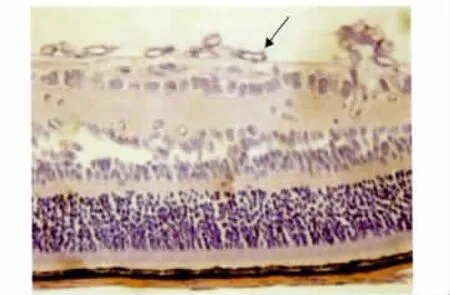
图2 模型组新生小鼠生后第17天视网膜组织切片(×400,HE染色)
2.2 不同时点视网膜PEDF的表达 新生小鼠PEDF蛋白阳性表达产物呈棕黄色。见图3。对照组小鼠视网膜PEDF蛋白在生后第12天时开始略有表达,第17天时视网膜各层均可见阳性表达,第22天时维持高表达,第17天和第22天时均高于第12天时,差异有统计学意义(P<0.05)。模型组生后第12天时PEDF阳性细胞百分率显著高于对照组,第17天时则显著低于对照组,差异有统计学意义(P<0.01)。见表2。
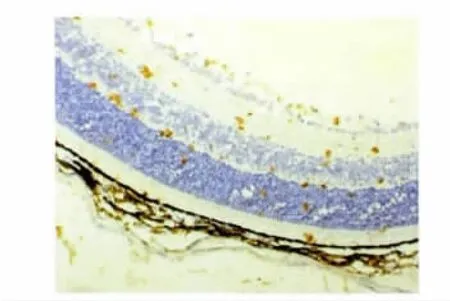
图3 模型组新生小鼠生后第12天视网膜PEDF的表达(×100,DBA染色)
2.3 血清PEDF水平的变化 对照组小鼠血清PEDF水平随日龄的增大而呈波动性变化:生后第7天和第12天时PEDF水平较低,第17天时增高(P<0.05),第22天时又降至较低水平。模型组小鼠血清PEDF水平较低,生后第17天低于对照组(P<0.05),生后第22天显著低于对照组(P<0.01)。见表3。
表2 2组新生小鼠不同时点视网膜PEDF蛋白的表达(,%)
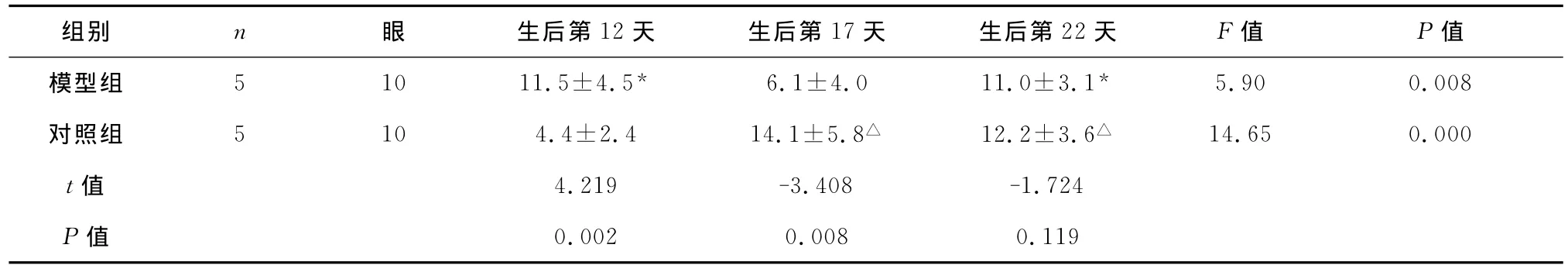
表2 2组新生小鼠不同时点视网膜PEDF蛋白的表达(,%)
注:与同组生后第17天比较,*P<0.05;与同组生后第12天比较,△P<0.05
?
表3 不同时间点血清PEDF水平(,ng/L)
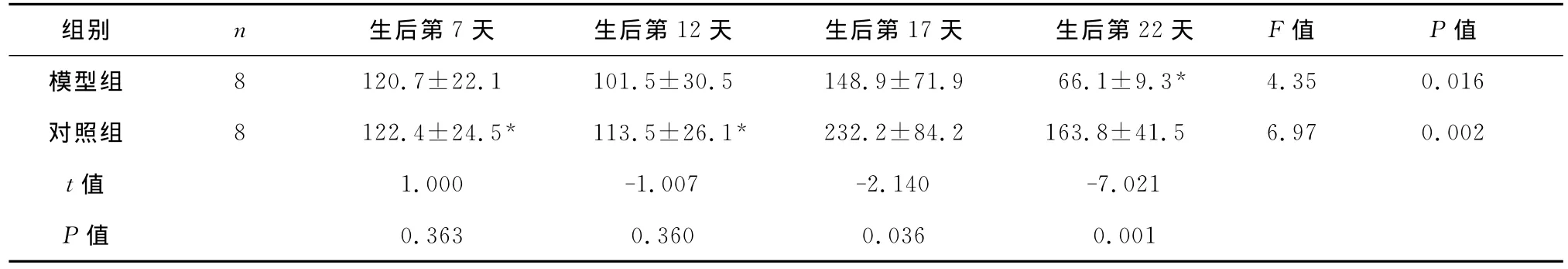
表3 不同时间点血清PEDF水平(,ng/L)
注:与同组生后第17天比较,*P<0.05
?
3 讨 论
C57BL/6J小鼠视网膜血管在生后第7天开始发育,此时视网膜血管发育最接近人类早产儿视网膜血管的特点;而小鼠视网膜血管至第21天发育成熟时,则相当于人类胎儿孕4~5个月时的表现,因此本研究利用高氧后的相对低氧条件制作小鼠ROP模型。本研究应用ADP酶法制作的视网膜铺片,可清晰显示视网膜浅层、深层及新生血管的分布和形态。在高氧环境中,模型组小鼠视网膜血管发育停止;相对低氧后,中央部视网膜出现大片无灌注区,中周部的灌注区与无灌注区交界处有新生血管形成,生后第17天时达到高峰。通过对突破视网膜内界膜的血管内皮细胞核计数,可对视网膜新生血管进行定量观察,模型组小鼠生后第17天和第22天时突破视网膜内界膜的血管内皮细胞核计数显著多于对照组。模型组眼部血管改变与ROP的视网膜病变相似,ROP动物模型建立成功。
PEDF是一种多功能的糖蛋白,在人体和人眼组织中广泛分布,其具有多种生物学活性,是天然存在于眼内的血管生长抑制剂,可抑制包括血管内皮生 长 因 子 (vascular endothelial growth factor,VEGF)在内的多种血管生成诱导物的活性。本研究中,模型组小鼠在生后第12天时,视网膜PEDF蛋白过度表达,在一定程度上抑制了小鼠视网膜血管的正常发育,从而导致视网膜组织缺血缺氧;在生后第17天、第22天时,模型组小鼠视网膜PEDF蛋白表达显著降低,而此期视网膜血管的增生也处于活跃期,其原因可能有两方面:一方面当PEDF蛋白表达减少时,其对视网膜血管增生的抑制作用大大减弱,另一方面由于视网膜组织缺血缺氧可诱导VEGF的过度表达,从而促进视网膜血管的增生,导致 ROP的发生[4]。
本研究还显示,ROP模型组小鼠血清PEDF水平的变化趋势与对照组相似,但整体水平较低,于生后第17天、第22天时ROP模型组小鼠血清PEDF水平低于对照组,而此期ROP模型组小鼠视网膜新生血管数也增多,提示血清PEDF水平的下降与视网膜新生血管的形成具有一定的相关性。但是,从本研究结果来看,模型组小鼠视网膜新生血管第17天时较第12天时增多,而ROP组血清PEDF水平生后第22天时才较第12天时降低,提示血清PEDF的降低在时相上滞后于视网膜血管的增生,因此对可能发生ROP的高危儿动态监测血清PEDF水平并不能更早地预测ROP的发生。
本研究已证实PEDF在ROP的发生发展中起着重要的作用,但是如何早期发现和早期干预PEDF的异常表达从而预防ROP的发生还需要更深入的研究。
[1] Smith LE.IGF-1 and retinopathy of prematurity in the preterm infant[J].Biol Neonate,2005,88(3):237-244.
[2] 孔怡淳,韩梅,赵堪兴.高氧诱导小鼠视网膜病变模型中血管内皮生长因子和色素上皮衍生因子的表达及意义[J].中华眼科杂志,2008,44(8):734-740.
[3] Matsuoka M,Ogata N,Otsuji T,et al.Expression of pigment epithelium derived factor and vascular endothelial growth factor in choroidal neovascular membranes and polypoidal choroidal vasculopathy[J].Br J Ophthalmol,2004,88(6):809-815.
[4] 刘欣,王伟,王安茹,等.血氧浓度波动致新生大鼠增生性视网膜病变的机制研究[J].中华儿科杂志,2007,45(1):7-13.

