饲粮维生素A添加水平对43~63日龄黄羽肉鸡生长性能和抗氧化指标的影响
洪 平 蒋宗勇 蒋守群 周桂莲 郑春田 林映才
(广东省农业科学院畜牧研究所,畜禽育种国家重点实验室,农业部动物营养与饲料(华南)重点实验室,广东省动物育种与营养公共实验室,广东省畜禽育种与营养研究重点实验室,广州 510640)
维生素A是维持动物正常生长发育所必需的脂溶性维生素,具有广泛的生理作用,如维持视力正常、促进生长、提高机体免疫力等[1]。饲粮中含量过低会产生干眼病、食道黏膜组织变形、器官上皮纤毛与分泌细胞角质化等典型缺乏症状,还会导致动物抗氧化能力减弱[2]。NRC(1994)[3]根据早期研究结果推荐肉仔鸡饲粮维生素A的最低需要量为1 500 IU/kg,我国《鸡饲养标准》(NY/T 33—2004)[4]推荐黄羽肉鸡饲粮维生素A添加水平为5 000 IU/kg。然而,在现代集约化养殖模式下,肉鸡常受到各种应激的干扰,如夏季高温环境[5]、饲养密度大[6]、饲料油脂含量高[7-8]等,会降低其生长性能和肉品质,影响上市日龄和出售。因此在肉鸡标准的推荐基础上增加或减少维生素A添加水平,研究其对机体抗氧化功能和肉品质的影响,对弄清肉鸡在不同生产目的下的供给量具有重要意义。故本试验以黄羽肉鸡为研究对象,旨在探讨饲粮添加不同水平维生素A对43~63日龄黄羽肉鸡生长性能、抗氧化能力和肉品质的影响,为确定黄羽肉鸡饲粮中维生素A适宜供给量提供理论依据。
1 材料与方法
1.1 试验设计
试验采用单因子完全随机分组设计。选用43日龄黄羽肉公鸡1 080只,根据体重均衡原则随机分成6个处理,每个处理6个重复,每个重复30只鸡。
1.2 试验饲粮
试验采用玉米-豆粕型基础饲粮,其营养水平参考我国《鸡饲养标准》(NY/T 33—2004)[4]。根据中国饲料成分表(第15版)计算饲料配方。处理1为空白对照组,饲喂基础饲粮(表1),不添加任何形式的维生素A,其维生素A含量实测值为208 IU/kg,处理 2、3、4、5、6 分别在基础饲粮中添加 750、1 500、3 000、6 000、1 2000 IU/kg 维生素A,以维生素A醋酸酯(由帝斯曼维生素有限公司生产)形式添加,各组饲粮除维生素A含量不同以外,其他营养水平基本一致。参照蒋守群等[9]的研究方法,1~42日龄所有鸡均饲喂相同饲粮,其中维生素A添加水平根据NRC(1994)[3]推荐量(1 500 IU/kg)设定。
1.3 试验动物与饲养管理
由广东省农业科学院畜牧研究所智威农业科技股份有限公司购入1日龄健康、发育良好的岭南快长型黄羽肉鸡公雏若干只。试鸡地面平养,自由采食与饮水,其他按常规饲养操作规程进行。
1.4 样品采集与处理
试验结束时,每个重复挑选2只接近平均体重的试鸡,称活重后,翅静脉采血,静置后,3 000 r/min离心15 min,制备血清,分装于 Ep管中,-20℃冻存,待测血清生化指标。采血后试鸡颈部放血致死,剖摘肝脏(去胆囊),冻存备用。完整摘取两侧胸肌和腿肌,去除脂肪和结缔组织,称重并记录。
1.5 测定指标与方法
1.5.1 生长性能
试验开始和结束前1天20:00断料供水,次日08:00以重复为单位称重,并统计耗料量,计算平均日增重、平均日采食量和料重比。
1.5.2 血清、肝脏和胸肌生化指标
血清和肝脏维生素A含量的测定参照许蕴等[10]和廖俊仪[11]的高效液相色谱法。血清、肝脏和胸肌总抗氧化能力(T-AOC),谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量采用紫外分光光度计(Biomate 5型,美国热电公司)测定,试剂盒购自南京建成生物工程研究所。具体操作参照试剂盒说明进行。肝脏和胸肌匀浆液蛋白质含量采用考马斯亮蓝法进行测定。
GSH-Px活性单位定义为:每0.1 mL血清在37℃反应5 min,扣除非酶促反应作用,使反应体系中谷胱甘肽(GSH)浓度降低1 μmol/L为1个酶活性单位(U),或者每分钟内每毫克蛋白质扣除非酶促反应的作用,使反应体系中GSH浓度降低1 μmol/L为1个酶活性单位。
1.5.3 胸肌物理指标
1.5.3.1 剪切力
试鸡宰后完整地割取右侧胸肌,剔除表面脂肪,平放塑料袋内,置于4℃冰箱中24 h,再于室温下放置1 h后,打开塑料袋,将温度计插入肌肉中心部位,放于80℃恒温水浴中加热,至肌肉中心温度达70℃时迅速取出冷却,按与肌纤维呈垂直方向修剪成截面为1 cm×1 cm、长约4 cm的肉条,在室温条件下用嫩度仪(INSTRON4411型,英斯特朗公司,美国)分别对3个部位进行剪切,每个样品测定10个剪切力值,取平均值,以牛顿(N)为单位表示。
1.5.3.2 肉色
试鸡宰后取整块胸肌样,用保鲜膜包裹好贮存于4℃冰库,分别在45 min、24 h后取出,在正常室内光线下放在白色托盘上,用色差计(CR-410型,美能达公司,日本)测定胸肌内侧的肉色的亮度(L*)值、红度(a*)值、黄度(b*)值,每个肉样测定3次,取平均值。
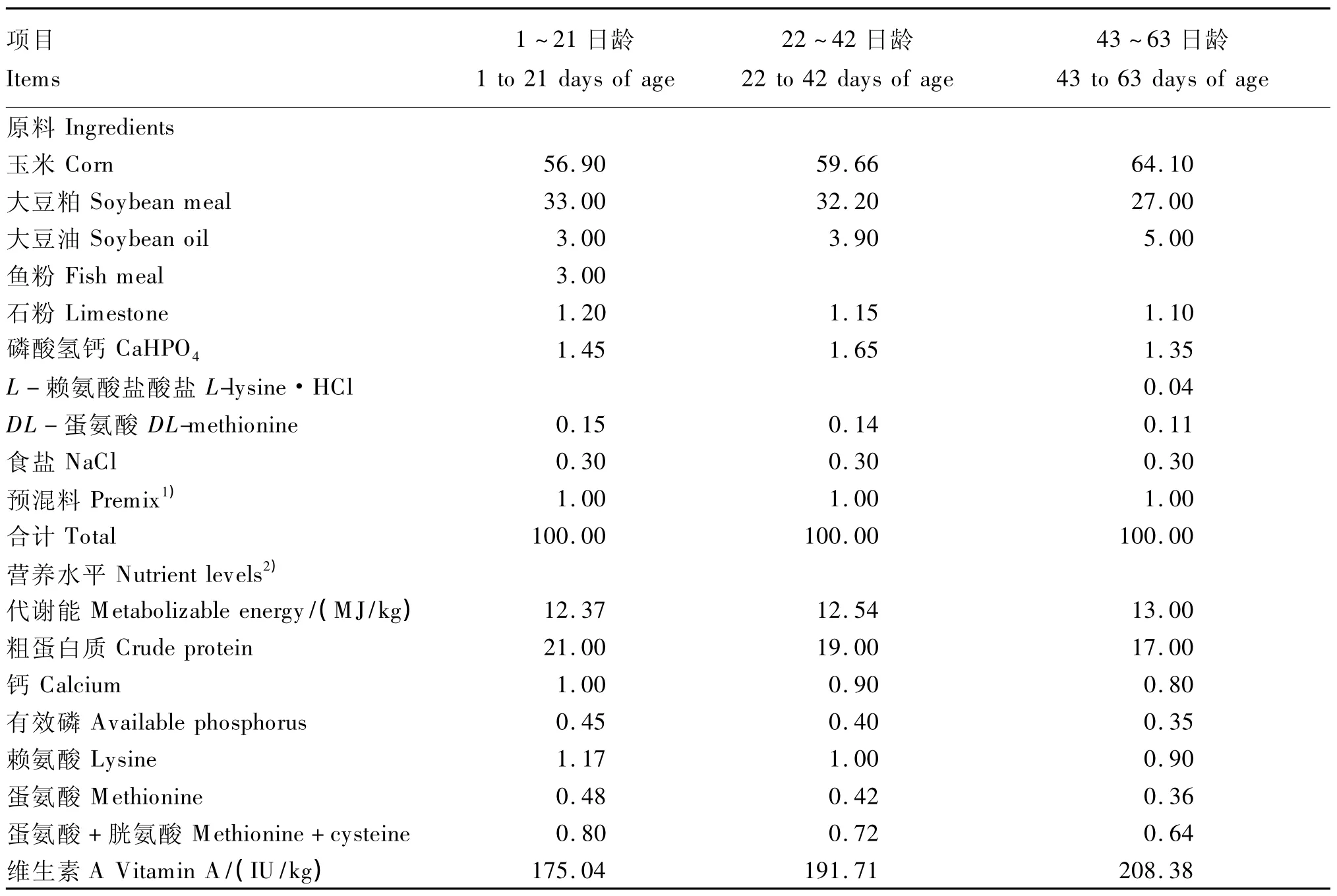
表1 基础饲粮组成及营养水平(饲喂基础)Table 1 Composition and nutrient levels of basaldiets(as-fed basis) %
1.5.3.3 失水率
试鸡宰后取胸肌,顺着肉样肌纤维方向切成1 cm厚肉片,修成长3 cm、宽2 cm的长条,称重后将肉样置于2层医用纱布之间,上下各垫4层滤纸,滤纸外各放一块硬质塑料板,置于压力仪(YYW-2型,南京土壤仪器厂,南京)平台上,匀速摇动摇把,加压至35 kgf(1 kgf=9.8 N),并保持5 min,撤除压力后即称量压后肉样重,每个肉样测定2个平行样。
失水率(%)=[(压前肉样重-压后肉样重)/压前肉样重]×100。
1.5.3.4 pH
试鸡宰后取整块胸肌样用保鲜膜包裹好贮存于4℃冰库,分别于45 min、24 h取出,用便携式pH计(HI8424型,北京Hanna仪器科学技术有限公司,北京)测定胸肌内侧3个不同点,结果取3点pH的平均值。
1.5.3.5 肌内脂肪含量
利用脂肪检测仪(Soxtec Avanti 2055,FOSS,瑞典)检测肌内脂肪含量。取左侧胸肌,除去外层肌膜、脂肪组织以及胸肌中的筋膜,切成小块,再用搅肉机将肉搅拌粉碎,取25 g左右平铺于塑料平皿中,精确称量并记录鲜肉重量后放入-80℃冰箱,预冷24 h,然后放入冷冻干燥仪(ALPHA2-4,CHRIST,德国)中至肉样完全干燥,取出置于65℃鼓风干燥箱(101A-2,新诺仪器厂,上海)中干燥2 h,再在干燥器中冷却30 min后称重,并记录干样重量;使用粉碎机将干样粉碎。上机前,精确称取粉碎后干样2~3 g,全部移入滤纸筒内;将滤纸筒放入脂肪抽提器内进行抽提;取下铝杯,于105℃干燥箱(101A-2,新诺仪器厂,上海)干燥2 h后,放入干燥器内冷却30 min后称量。
鲜肉肌内脂肪含量(%)=100×(1-鲜肉水分含量)×(抽提后油杯重-抽提前油杯重)/抽提前上样量。
1.6 数据分析
应用SAS 8.2软件的GLM程序进行单因素方差分析,在差异显著的基础上再进行Duncan氏法多重比较,显著水平为 P<0.05,结果用平均值±标准误表示。
2 结果与分析
2.1 饲粮维生素A添加水平对43~63日龄黄羽肉鸡生长性能的影响
由表2可知,随着饲粮维生素A添加水平的升高,试鸡63日龄体重(末重)、平均日采食量、平均日增重均呈先上升后下降二次曲线变化(P=0.004 8;P=0.003 6;P=0.006 5)。添加 1 500、3 000、6 000、12 000 IU/kg维生素A组试鸡63日龄体重和平均日增重差异不显著(P>0.05),但均显著高于空白对照组(P<0.05)。各维生素A添加组试鸡平均日采食量差异不显著(P>0.05),但均显著高于空白对照组(P<0.05)。各处理间料重比无显著差异(P>0.05)。上述结果提示,在本试验条件下,43~63日龄阶段饲粮维生素A添加水平为1 500 IU/kg时试鸡即可获得较好的生长性能,加上基础饲粮中的维生素A含量208 IU/kg,则相应的饲粮维生素A适宜水平为1 708 IU/kg。
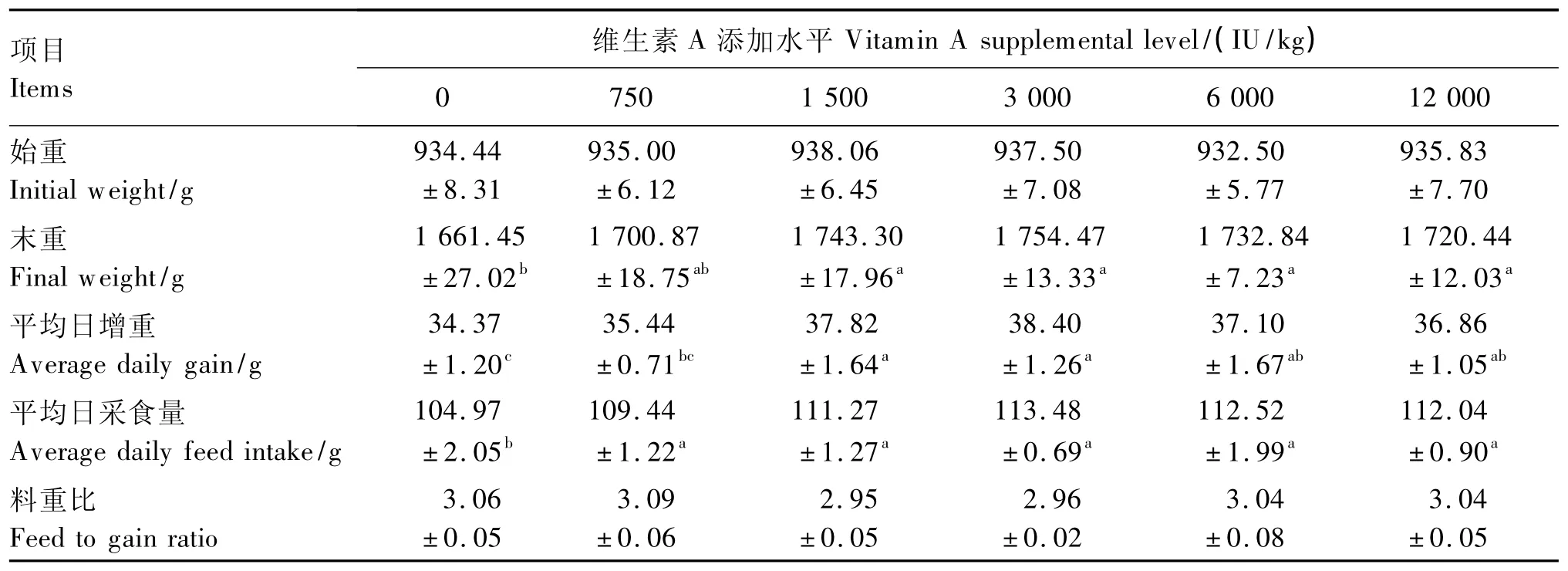
表2 饲粮维生素A添加水平对43~63日龄黄羽肉鸡生长性能的影响Table 2 Effects of vitamin A supplemental level on growth performance of yellow-feathered broilers aged from 43 to 63days
2.2 饲粮维生素A添加水平对63日龄黄羽肉鸡血清生化指标的影响
由表3可知,63日龄试鸡血清维生素A含量随着饲粮维生素A添加水平的升高呈线性上升变化(P <0.000 1)。其 中 添 加 3 000、6 000、12 000 IU/kg维生素A组试鸡血清维生素A含量显著高于空白对照组(P<0.05),而添加12 000 IU/kg维生素A组试鸡血清维生素A含量显著高于其他各组(P<0.05)。
随着饲粮维生素A添加水平的升高,试鸡血清 T-AOC,GSH-Px、T-SOD、CAT 活性均呈先上升后下降的二次曲线变化(P<0.000 1;P<0.000 1;P <0.000 1;P=0.019 1)。各维生素 A添加组试鸡血清T-AOC显著高于空白对照组(P<0.05),且添加3 000 IU/kg维生素A组试鸡血清T-AOC最强,显著高于空白对照组和添加750、6 000、12 000 IU/kg维生素 A 组(P <0.05)。饲粮维生素A添加水平为3 000 IU/kg时,试鸡血清GSH-Px、T-SOD、CAT活性最高,显著高于空白对照组(P<0.05),但添加1 500 IU/kg维生素A组试鸡血清GSH-Px、CAT活性与添加3 000 IU/kg维生素A组差异不显著(P>0.05)。
随着饲粮维生素A添加水平的升高,试鸡血清MDA含量呈先下降后上升二次曲线变化(P=0.048 9)。饲粮维生素A添加水平为3 000 IU/kg时,试鸡血清MDA含量最低,显著低于空白对照组和添加750 IU/kg维生素A组(P<0.05),但与其他添加组差异不显著(P>0.05)。
根据试验结果,以血清各项生化指标和MDA含量为判定指标,饲粮添加3 000 IU/kg维生素A时,63日龄试鸡血清抗氧化性能最佳,加上基础饲粮中的维生素A含量208 IU/kg,则相应的饲粮维生素A适宜水平为3 208 IU/kg。
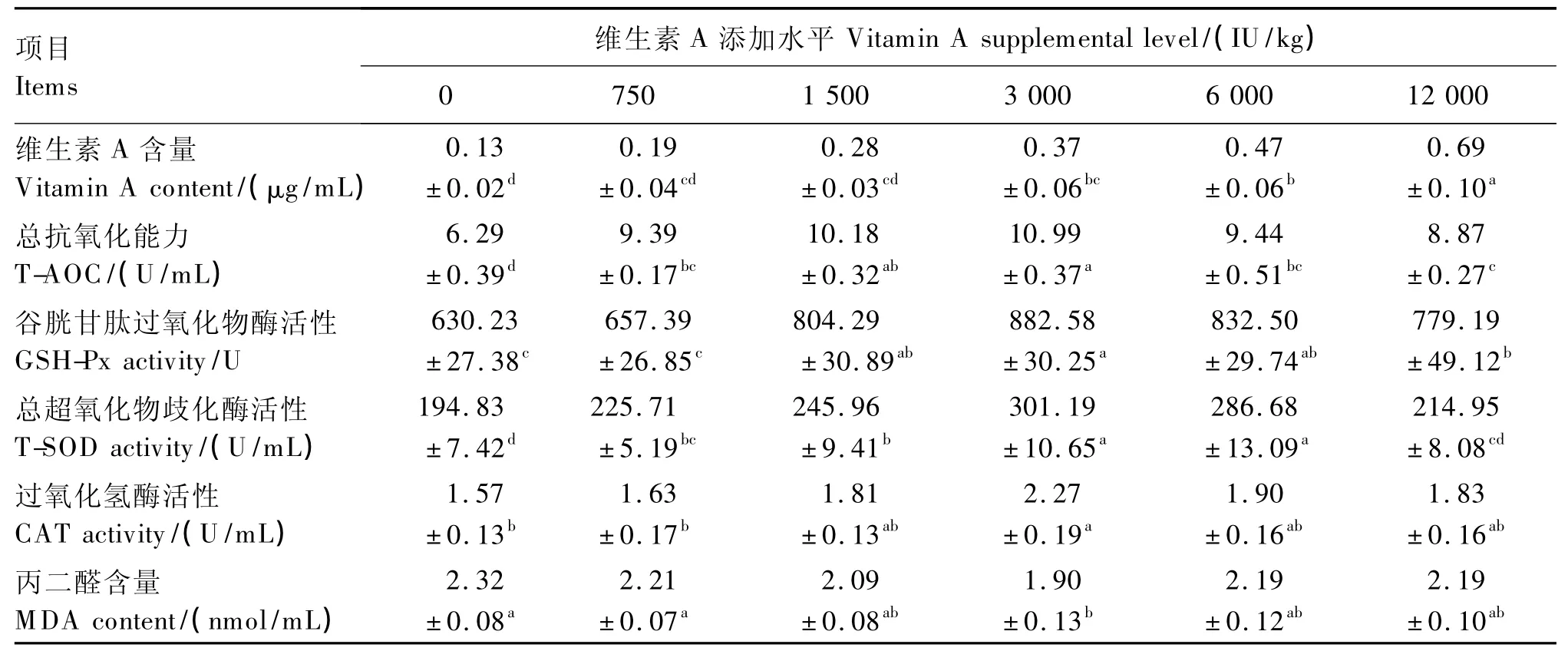
表3 饲粮维生素A添加水平对63日龄黄羽肉鸡血清生化指标的影响Table 3 Effects of vitamin A supplemental level on biochemical parameters in serum of yellow-feathered broilers aged 63days
2.3 饲粮维生素A添加水平对63日龄黄羽肉鸡肝脏生化指标的影响
由表4可知,肝脏中维生素A含量随着饲粮维生素A添加水平的升高呈线性上升变化(P<0.000 1)。添加6 000、12 000 IU/kg维生素 A 组显著高于其他各组(P<0.05),而添加12 000 IU/kg维生素A组又显著高于添加6 000 IU/kg维生素 A 组(P <0.05)。
随着饲粮维生素A添加水平的升高,试鸡肝脏 T-AOC,GSH-Px、T-SOD、CAT 活性呈先升高后下降的二次曲线变化(P=0.047 2;P=0.011 4;P <0.000 1;P=0.003 9)。添加 3 000 IU/kg维生素A组肝脏T-AOC最强,显著高于空白对照组(P<0.05);添加3 000 IU/kg维生素 A组肝脏GSH-Px活性最高,显著高于空白对照组和添加12 000 IU/kg维生素 A 组(P<0.05)。添加1 500、3 000、6 000 IU/kg维生素 A组试鸡肝脏T-SOD活性最高,显著高于空白对照组和添加750 IU/kg维生素 A 组(P<0.05),但与添加12 000 IU/kg维生素A组差异不显著(P>0.05)。各维生素A添加组试鸡肝脏CAT活性差异不显著(P>0.05),但均显著高于空白对照组(P<0.05)。
随着饲粮维生素A添加水平的升高,试鸡肝脏MDA含量呈先下降后升高的二次曲线变化(P=0.002 0)。饲粮维生素 A添加水平为3 000 IU/kg时,试鸡肝脏MDA含量最低,显著低于空白对照组和添加750、1 500、12 000 IU/kg维生素 A 组(P<0.05)。
根据试验结果,以肝脏各项生化指标和MDA含量为判定指标,饲粮添加3 000 IU/kg维生素A时,63日龄试鸡肝脏抗氧化性能最佳,加上基础饲粮中的维生素A含量208 IU/kg,则相应的饲粮维生素A适宜水平为3 208 IU/kg。

表4 饲粮维生素A添加水平对63日龄黄羽肉鸡肝脏生化指标的影响Table 4 Effects of vitamin A supplemental level on biochemical parameters in liver of yellow-feathered broilers aged 63days
2.4 饲粮维生素A添加水平对63日龄黄羽肉鸡胸肌生化指标的影响
由表5可知,随着饲粮维生素A添加水平的升高,试鸡胸肌的T-AOC呈先上升后下降的二次曲线变化趋势(P=0.058 9),GSH-Px、T-SOD 活性呈先上升后下降的二次曲线变化(P=0.017 3;P=0.000 6)。添加3 000 IU/kg维生素A组试鸡胸肌T-AOC最强,显著高于空白对照组(P<0.05),而与其他添加组差异不显著(P >0.05)。添加3 000 IU/kg维生素A组试鸡胸肌GSH-Px活性最高,显著高于空白对照组和添加6 000、12 000 IU/kg维生素A组(P<0.05)。添加750、1 500、3 000 IU/kg维生素A组试鸡胸肌T-SOD活性最高,显著高于空白对照组和其他添加组(P<0.05)。添加3 000 IU/kg维生素A组试鸡胸肌CAT活性最高,显著高于空白对照组(P<0.05)。
随着饲粮维生素A添加水平的升高,试鸡胸肌MDA含量在数值上先下降后升高(P=0.051 1)。饲粮维生素A添加水平为3 000 IU/kg时,试鸡胸肌MDA含量最低,显著低于空白对照组和添加12 000 IU/kg维生素A组(P<0.05),而与其他添加组差异不显著(P>0.05)。
根据试验结果,以胸肌各项生化指标和MDA含量为判定指标,饲粮添加3 000 IU/kg维生素A时,63日龄试鸡胸肌抗氧化性能最佳,加上基础饲粮中的维生素A含量208 IU/kg,则相应的饲粮维生素A适宜水平为3 208 IU/kg。
2.5 饲粮维生素A添加水平对63日龄黄羽肉鸡胸肌肉品质的影响
由表6可知,随着饲粮维生素A添加水平的升高,试鸡宰后45 min胸肌pH呈先上升后下降的二次曲线变化(P=0.000 9);试鸡宰后24 h胸肌pH呈先上升后下降二次曲线变化(P=0.002 8)。饲粮维生素A添加水平为6 000 IU/kg时,试鸡宰后45 min胸肌pH显著高于空白对照组和添加750、1 500、3 000 IU/kg 维生素 A 组(P <0.05)。饲粮维生素A添加水平为6 000 IU/kg时,试鸡宰后24 h胸肌pH显著高于空白对照组和添加750、1 500、12 000 IU/kg维生素 A 组(P <0.05)。
随着饲粮维生素A添加水平的升高,试鸡宰后45 min胸肌L*值呈先下降后上升二次曲线变化(P=0.039 6)。饲粮添加1 500 IU/kg维生素A时,试鸡宰后45 min胸肌L*值显著低于空白对照组和添加750、6 000、12 000 IU/kg维生素A组(P<0.05);饲粮添加6 000 IU/kg维生素 A时,试鸡宰后45 min胸肌a*值显著高于空白对照组和其他维生素A添加组(P<0.05);饲粮添加不同水平维生素A对试鸡宰后45 min胸肌b*值影响不显著(P>0.05)。饲粮添加不同水平维生素A对试鸡宰后24 h胸肌L*值和b*值影响不显著(P>0.05);饲粮添加6 000 IU/kg维生素 A时,试鸡宰后24 h胸肌a*值显著高于空白对照组和添加750、1 500、12 000 IU/kg维生素 A组(P<0.05),但与添加3 000 IU/kg维生素A组差异不 显著(P>0.05)。
随着饲粮维生素A添加水平的升高,试鸡宰后45 min、24 h胸肌失水率呈线性下降变化(P=0.003 8;P=0.001 9)。添加 3 000 IU/kg 维生素A组试鸡宰后45 min胸肌失水率最低,显著低于空白对照组(P<0.05),而与其他添加组差异不显著(P>0.05);添加3 000 IU/kg维生素A组试鸡宰后24 h胸肌失水率也最低,显著低于空白对照组和添加750 IU/kg维生素A组(P<0.05),但添加 1 500、3 000、6 000、12 000 IU/kg 维生素 A 组间差异不显著(P>0.05)。
添加 1 500、3 000、6 000、12 000 IU/kg 维生素A组试鸡宰后24 h胸肌剪切力差异不显著(P>0.05),但均显著低于空白对照组和添加750 IU/kg维生素 A 组(P <0.05)。
随着饲粮维生素A添加水平的升高,试鸡胸肌肌内脂肪含量呈先上升后下降的二次曲线变化(P=0.010 9)。添加6 000 IU/kg维生素A组试鸡胸肌肌内脂肪含量显著高于空白对照组(P<0.05),而与其他维生素 A添加组差异不显著(P >0.05)。
可见,饲粮添加维生素A对试鸡胸肌pH、剪切力、肉色L*值和a*值、失水率、肌内脂肪含量影响显著。综合肉品质指标考虑可知,在本试验条件下,饲粮添加3 000~6 000 IU/kg维生素A时,63日龄黄羽肉鸡获得较好肉品质,加上基础饲粮中的维生素A含量208 IU/kg,则相应的饲粮维生素A适宜水平为3 208~6 208 IU/kg。
3 讨论
3.1 饲粮维生素A添加水平对黄羽肉鸡生长性能的影响
维生素A是动物正常生长的必需微量营养素,限制维生素A摄入会降低血清胰岛素样生长因子-1(IGF-1)和甲状腺素水平,从而导致生长性能下降[12]。本研究表明,饲粮添加 1 500~12 000 IU/kg维生素A时可显著提高43~63日龄黄羽肉鸡的63日龄体重、平均日增重和平均日采食量,而对料重比无显著影响。高士争等[13]研究指出,饲粮不添加维生素A的肉鸡生长速度显著降低。而饲粮维生素A过量也可引起肉鸡生长性能的下降,有研究表明,饲粮维生素A添加水平为30 000、60 000 IU/kg时爱拔益加(AA)肉鸡生长速度和饲料转化率显著降低[14]。张海琴[15]研究表明,饲粮维生素A添加水平为3 000 IU/kg时,可使AA肉鸡获得最大生长速度,添加水平大于15 000 IU/kg时,生长速度呈下降趋势。以上研究均证实,饲粮添加适宜维生素A能促进肉鸡发挥最佳生长性能。因此,饲粮添加适量维生素A对于促生长具有积极意义。
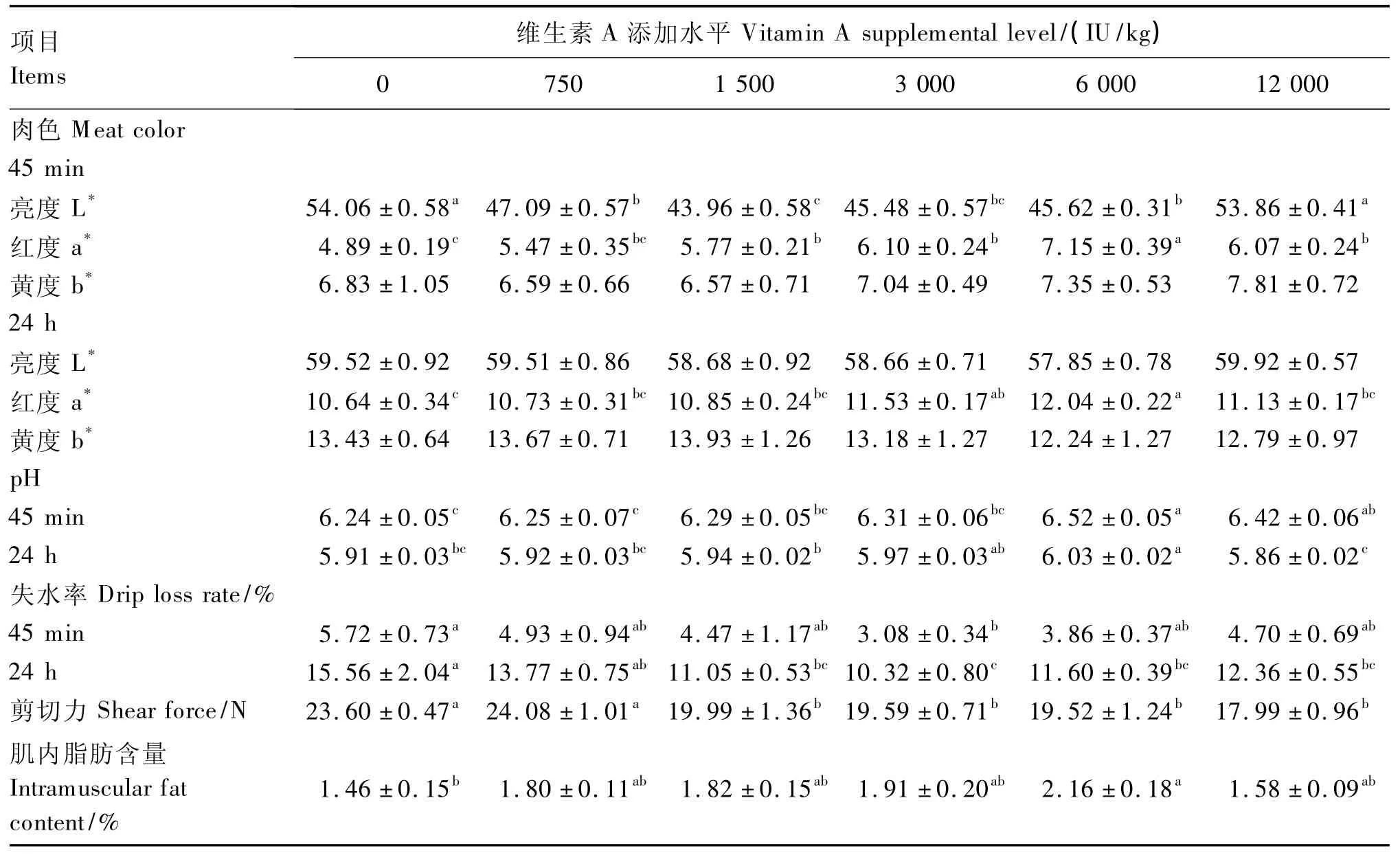
表6 饲粮维生素A添加水平对63日龄黄羽肉鸡胸肌肉品质的影响Table 6 Effects of vitamin A supplemental level on meat quality in breast muscle of yellow-feathered broilers aged 63days
3.2 饲粮维生素A添加水平对黄羽肉鸡血清和肝脏维生素A含量的影响
肝脏是机体储存维生素A的主要器官,健康动物肝脏中维生素A含量占机体总量的90%以上,因此肝脏维生素A含量是评定机体维生素A营养状况的重要指标[16]。同时,血清维生素A含量也能在一定程度上反映机体维生素A营养状况[17]。饲粮维生素A水平与肝脏和血清维生素A含量之间存在剂量反应关系[18],饲粮维生素A添加水平在一定范围内时可以促进血清维生素A含量的升高以及肝脏维生素A的沉积,但是当饲粮维生素A水平超过一定值时,血清维生素A含量不再增加,即达到平台期,表示体内维生素A储备趋于稳定或平衡。结合血清和肝脏维生素A含量考虑可知,43~63日龄黄羽肉鸡饲粮维生素A适宜添加水平为3 000~6 000 IU/kg。
3.3 饲粮维生素A添加水平对黄羽肉鸡抗氧化性能的影响
维生素A含有β-白芷酮环和多烯烃疏水链结构,在体外试验和动物试验中均被证实是一种重要的非酶系统的抗氧化剂[19-22]。MDA是脂质过氧化反应链式终止阶段产生的小分子产物,其含量可以间接反映自由基的产生情况和机体组织细胞的脂质过氧化程度;GSH-Px是清除体内H2O2和许多有机氢过氧化物的重要抗氧化物质;SOD是能够有效清除超氧化物阴离子自由基的一类重要的抗氧化酶;CAT主要负责清除体内多余的H2O2;T-AOC可反映机体抗氧化水平的高低,是机体抗氧化能力的标志。这些均是反映机体脂质氧化程度和抗氧化性能的重要指标。
本试验结果表明,饲粮添加3 000 IU/kg维生素A时,试鸡血清、肝脏和胸肌中MDA含量显著降低,揭示添加适量维生素A能降低机体脂质过氧化程度。此外维生素A能提高抗氧化酶活性,提高机体清除自由基的能力,维持机体氧化还原平衡[23-25]。本研究也证实了这一观点,添加3 000 IU/kg维生素A能显著提高试鸡血清和肝脏中GSH-Px活性。本试验结果还表明,饲粮添加高剂量(12 000 IU/kg)维生素A对于降低机体脂质过氧化反应、提高机体抗氧化能力无益。Felipe等[26]和林映才等[27]分别通过体外试验和仔猪试验也得出类似结论。这可能是因为过量维生素A阻碍了维生素E的吸收[19],降低了血浆和肝脏维生素E含量[28-31]。因此,推测过量维生素A不能进一步提高试鸡抗氧化能力并出现部分负作用,可能是影响了维生素E的吸收、利用,使体内维生素E水平降低,进而影响了机体抗氧化能力。
3.4 饲粮维生素A添加水平对黄羽肉鸡胸肌肉品质的影响
脂质氧化是肉品质下降的主要原因,而鸡肉中富含多不饱和脂肪酸,极易发生脂质氧化。肌肉中的脂质氧化通常起始于亚细胞膜(线粒体膜、微粒体膜)上的高度不饱和磷脂部分[32]。一方面,膜磷脂的氧化会导致细胞膜和亚细胞膜流动性下降,正常的膜结构和功能丧失,肌肉汁液渗出,肉品质下降。另一方面,脂质氧化过程产生的自由基直接充当了肌肉色素发生氧化的激发剂,间接破坏了色素还原酶系统,导致肉色变差,肉品质下降。饲粮中添加适量维生素A能抑制脂质和色素氧化,降低肌肉滴水损失,并增加肌肉的嫩度[33]。维生素A完全或轻度缺乏均可以使脂质过氧化反应明显增强,而抗氧化能力明显减弱[2]。
肉色是反映肉品质外观的重要指标,主要由L*值、a*值、b*值表示。L*值受肉品颜色饱和度、肉样表面的液体渗出量和测定环境光线的影响。a*值受肌红蛋白存在状态的影响,反映肌肉的新鲜度。b*值表示肉样的黄度,随着贮存时间的延长,有时会因肌肉表面的寄生菌代谢产生硫化氢、氧,与肌红蛋白结合形成硫化肌红蛋白,在光线的反射下硫化肌红蛋白会使肌肉的b*值升高,肌肉品质下降。李新花[34]研究表明,饲粮添加一定量的维生素A、维生素E可以显著降低肉鸡宰后胸肌的L*值、显著升高a*值,但对b*值作用不显著。本研究也发现,饲粮添加750~6 000 IU/kg维生素A时,试鸡宰后45 min胸肌肉色L*值显著降低,且以1 500 IU/kg添加水平最佳;饲粮分别添加1 500~12 000 IU/kg维生素A和3 000~6 000 IU/kg维生素 A时,试鸡宰后45 min、24 h胸肌肉色 a*值显著升高,且均以6 000 IU/kg添加水平最佳;饲粮添加不同水平维生素A对试鸡胸肌肉色b*值无显著影响。
pH是反映宰杀后机体肌糖原酵解速度和强度的重要指标。肌肉pH下降的速度和强度对一系列肉质性状产生决定性的影响,直接影响肌肉的系水力、嫩度、颜色及其保存。肌肉呈酸性首先导致肌肉蛋白质变性,使肌肉系水力降低、颜色变白。谢华等[35]研究表明,pH与系水力呈正相关。肌肉较高的pH下降速率和较低的最终pH会导致较高的汁液流失率。目前,关于饲粮维生素A水平对肉品pH的影响尚未见报道,本试验发现,饲粮添加6 000 IU/kg维生素A时,63日龄黄羽肉鸡宰后45 min、24 h胸肌pH显著升高。
失水率是指在外力作用下从肌肉蛋白质系统释放出的液体量占原肌肉重的百分比。肌肉pH变化、脂质氧化程度、蛋白质含量等因素均会影响肌肉失水率。维生素A作为一种脂溶性维生素,极易进入细胞膜,淬灭氧自由基,切断细胞膜上多不饱和脂肪酸产生的氧自由基链式反应,保护细胞膜结构与功能的完整性,从而防止肌肉汁液渗出,提高肌肉持水性能,改善肉品质。王文娟等[36]研究表明,饲粮添加维生素A可显著降低肉牛肌肉失水率。本试验结果也显示,饲粮添加3 000 IU/kg维生素A时,试鸡宰后45 min胸肌失水率显著下降,添加1 500~12 000 IU/kg维生素A时,试鸡宰后24 h胸肌失水率显著下降,而添加3 000 IU/kg维生素A时,试鸡胸肌抗氧化性能也最佳,MDA含量最低。可见,适宜饲粮维生素A水平对改善鸡胸肉失水率具有显著效果。
嫩度也是肉品质的一个重要方面,受多种因素的影响,主要取决于肌肉中肌原纤维状态、结缔组织和肌内脂肪含量[36]。饲粮中添加适量维生素A能增加肌肉的嫩度[33]。本试验结果表明,饲粮添加的维生素A水平等于或高于1 500 IU/kg时,试鸡胸肌剪切力值显著降低,说明饲粮添加适量维生素A能改善肌肉的口感。
肌内脂肪含量也受饲粮维生素A水平的影响,有研究表明,维生素A的衍生物之一视黄酸能调控生长激素的基因表达[37],维生素A缺乏会导致血清生长激素水平下降[38],而生长激素能降低脂肪沉积和牛肉大理石纹[39],因此维生素A可通过调控生长激素进而影响肌内脂肪含量。此外,肌内脂肪含量对肌肉的嫩度和多汁性影响较大,主要表现为肌肉大理石纹与嫩度存在高度相关[40]。本试验表明,饲粮添加6 000 IU/kg维生素A时,试鸡胸肌肌内脂肪含量显著增加。这从影响肌肉嫩度的原因之一进一步证实了饲粮维生素A水平对鸡胸肉嫩度的改善作用。
综合考虑各项肉品质指标可知,饲粮添加3 000~6 000 IU/kg维生素A时,试鸡胸肌肉品质最佳。同时,胸肌抗氧化性能最佳的饲粮维生素A适宜添加水平为3 000 IU/kg,这就较为合理地解释了肥育期饲粮添加维生素A可通过其抗氧化作用、抑制脂质氧化来改善肉品质的机制。因此,在肉鸡生产中,针对高温气候,尤其是我国南方夏季的持续高温天气,适当提高饲粮维生素A的添加水平在一定程度上可以缓解热应激,提高肉品质。
4 结论
综合考虑可知,饲粮分别添加1 500、3 000 IU/kg和3 000~6 000 IU/kg维生素A时,试鸡可获得较好的生长性能、抗氧化能力和肉品质,加上基础饲粮中的维生素A含量208 IU/kg,则相应的饲粮维生素A适宜水平分别为1 908、3 208 IU/kg和3 208~6 208 IU/kg。
[1] ROSS S A,MC CAFFERY P J,DRAGER U C,et al.Retinoids in embryonaldevelopment[J].Physiological Reviews,2000,80(3):1021-1054.
[2] 李英哲,黄连珍,周丽玲.维生素A缺乏对大鼠脂质过氧化和抗氧化系统的影响[J].营养学报,2001,23(1):1-5.
[3] NRC.Nutrient requirements of poultry[S].9th ed.Washington,D.C.:National Academy Press,1994.
[4] 中华人民共和国农业部.NY/T 33—2004鸡饲养标准[S].北京:中国农业出版社,2004.
[5] DONKOH A.Ambient temperature:a factor affecting performance and physiological response of broiler chickens[J].International Journal of Biometeorology,1989,33:259-265.
[6] IMAEDA N.Influence of the stockingdensity and raering season on incidence of suddendeath syndrome in broiler chickens[J].Poutry Science,2000,79:201-204.
[7] LATOUR M A,PEEBLES E D,BOYLE C R,et al.The effects ofdietary fat on growth performance,carcass composition,and feed efficiency in the broiler chick[J].Poultry Science,1994,73:1362-1369.
[8] DU M,AHN D U.Effect ofdietary conjugated linoleic acid on the growth rate of live birds and on the abdominal fat content and quality of broiler meat[J].Poultry Science,2002,81:428-433.
[9] 蒋守群,周桂莲,蒋宗勇,等.饲粮维生素E水平对43~63日龄黄羽肉鸡肉品质和抗氧化功能的影响[J].动物营养学报,2012,24(4):646-653.
[10] 许蕴,马经野,付林.反相高效液相色谱法测定人血清中维生素 A含量[J].深圳中西医结合杂志,2005,15(3):175-182.
[11] 廖俊仪.高效液相色谱法测定肝脏中的维生素A[J].暨南大学学报:自然科学版,1992,13(1):51-56.
[12] OKA A,DOHGO T,JUEN M,et al.Effects of vitamin A on beef quality,weight gain,and serum concentration of thyroid hormones,insulin-like growth factor-1,and insulin in Japanese black steers[J].Animal Science and Technology,1998,69(2):90-99.
[13] 高士争,雷风.维生素A对肉鸡免疫功能的影响[J].黑龙江畜牧兽医,1999(6):3-5.
[14] 王石莹.日粮维生素A对肉鸡生长、营养物质消化率及骨骼钙磷代谢的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2009.
[15] 张海琴.维生素A、D对肉鸡生长、免疫、钙磷代谢的影响及其交互作用的研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2006.
[16] KELLEY S K,GRENN M H.Plasma retinol is a majordeterminant of vitamin A utilization in rats[J].The Journal of Nutrition,1998,12(10):1767-1773.
[17] GREEN M H,GREEN J B,BERG T,et al.Vitamin A metabolism in rat liver:a kinetic model[J].American Journal of Physiology,1993,264:509-521.
[18] ROSS A C,ZOLFAGHARI R.Regulation of hepatic retinol metabolism:perspectives from studies on vitamin A status[J].The Journal of Nutrition,2004,134:269-275.
[19] MCDOWELL L R.Vitamins in animal nutrition-comparativeaspectsto human nutrition[M]//MCDOWELL L R.Vitamin A and E.London:Academic Press,1989:93-131.
[20] TESORIERE L,CIACCIO M,BONGIORNO A,et al.Antioxidant activity of all-trans-retinol in homogeneous solution and in phosphatidylcholine liposomes[J].Archives of Biochemistry and Biophysics,1993,307:217-223.
[21] SUSAN A K,WILLIAM F Z.Antioxidant activity of retinol,glutathione,and taurine in bovine photoreceptor cell membranes[J].Experimental Eye Research,1999,68(6):693-702.
[22] PALACIOS A,PIERGIACOMI V A,CATALA A,et al.Vitamin A supplementation inhibits chimiluminescence and lipid peroxidant in isolated rat liver microsomes and mitochondria[J].Molecular and Cellular Biochemistry,1996,154:77-82.
[23] TOM W M,PRASONGWATANA V,BOYDE T R C.The effects of vitamin A nutritional status on glutathione levels and microsomal lipid peroxidation in rat lung[J].Cellular and Molecullar Life Sciences,1985,41(8):1046-1047.
[24] 李彦,杨在宾,杨维仁,等.饲粮中维生素A和维生素E水平对肉鸡抗氧化和免疫性能的影响[J].动物营养学报,2008,20(4):417-422.
[25] 刘汝祥,侯明海,李彦芹,等.不同水平维生素A对荷斯坦种公牛血清指标的影响[J].畜牧与兽医,2008,40(10):37-40.
[26] FELIPE D,FÁBIO K,MARA S B,et al.Retinol supplementation induces oxidative stress and modulates antioxidant enzyme activities in rat sertoli cells[J].Free Radical Research,2001,34(4):395-404.
[27] 林映才,蒋宗勇,郭吉余,等.VitA水平对仔猪免疫功能、肝脏VitA含量和抗氧化能力的影响[C]//第四届全国饲料营养学术研讨会论文集.北京:中国农业出版社,2002:19-23.
[28] SKLAN D,DONOGHUE S.Vitamin E response to highdietary vitamin A in the chick[J].The Journal of Nutrition,1982,112:759-765.
[29] SKLAN D.Effect of high vitamin A or tocopherol intake on hepatic lipid metabolism and intestinal absorption and secretion of lipids and bile acids in the chick[J].British Journal of Nutrition,1983,50:409-416.
[30] ABAWI F G,SULLIVAN T W.Interactions of vitamins A,D3,E and K in thediet of broiler chicks[J].Poultry Science,1989,68(11):1490-1498.
[31] HOPPE P P,SCHÖNER F J,FRIGG M.Effects ofdietary retinal on hepatic retinal storage and on plasma and tissue alpha-tocopherol in pigs[J].International Journal of Vitamin Research,1992,62(2):121-129.
[32] GRAY J I,PEARSON A M.Rancidity and warmed-over flavour[J].Advances in Meat Research,1987(3):221-269.
[33] WANG W J,WANG S P,DONG Y S,et al.Effects of vitamin A supplementation on growth performance,carcass characteristics and meat quality in Limosin×Luxi crossbreed steers fed a wheat straw-baseddiet[J].Meat Science,2007,77:450-458.
[34] 李新花.维生素A、E、C对肉仔鸡生产性能、肉品质及血清生化指标的影响[D].硕士学位论文.乌鲁木齐:新疆农业大学,2006.
[35] 谢华,张春晖,王永林.猪PSE肉的pH值判定及其与汁液流失关系的研究[J].肉类工业,2006(10):45-46.
[36] 王文娟,汪水平,龚月生,等.日粮维生素A水平对肉牛牛肉品质的影响[J].西北农林科技大学学报,2007,35(8):75-81.
[37] BEDO G,SANTISTEBAN P,ARANDA A.Retinoic acid regulates growth hormone gene expression[J].Nature,1989,339(6221):231-234.
[38] AKAZAWAN,TANTIGUCHIK,MIKAMIS.Effects of vitamin Adeficiency on the function of pituitary-gonadal system in male rats[J].Japanese Journal of Veterinary Science,1989,51(6):1209-1217.
[39] DALKE B S,ROEDER R A,KASSER T R,et al.Dose-response effects of recombinant bovine somatotropin implants on feedlot performance in steers[J].Journal of Animal Science,1992,70(7):2130-2137.
[40] 陈代文,张克英,胡祖禹.猪肉品质特征的形成原理[J].四川农业大学学报,2002,20(1):60-66.

