板栗总苞多酚提取工艺优化及其抗氧化性研究
石恩慧 郭凯军 李 红 谷明灿 鲁 琳** 贾昌喜**
(1.北京农学院食品科学与工程学院,北京 102206;2.农产品有害微生物及农残安全检测与控制北京市重点实验室,北京 102206;3.北京农学院动物科学与技术学院,北京 102206)
近年来,氧化应激给动物细胞和组织带来的危害成为人们关注的热点,其机制是氧分子失去了外围电子形成的自由基会夺取其他细胞分子的外围电子,使自身保持稳定,造成一种连锁反应,使机体组织细胞分子受到损害。因此,研究天然抗氧化物,从根本上预防自由基氧化损伤迫在眉睫。
植物多酚作为新型饲料添加剂成为国内外动物营养学界的一个研究热点。植物多酚是广泛存在于植物体内的天然产物,是植物的次生代谢产物,具有独特的生理活性和药用价值[1],多酚具有较强的清除自由基、抗氧化活性、抗衰老等生物活性功能[2-6]。研究表明,板栗果仁、花、叶子和果实中提取物具有很强的抗氧化能力[7]。主要成份为植物多酚的欧洲属栗树提取物可以显著增加过瘤胃蛋白质的比例,减少奶牛瘤胃中氨气的产生,同时也减少了饲料中非蛋白氮(NPN)和干物质的损失[8]。在肉仔鸡饲粮中加入栗树提取物可以明显提高肉仔鸡的日增重和日采食量,同时粪便中氮的排放减少了 25% 以上[9]。Zoccarato 等[10]报道,用栗树提取物替代抗生素可以显著降低肉兔的死亡率。Liu等[11]报道,添加栗树提取物能够提高肉兔生长性能,增强机体抗氧化能力,但不影响兔肉品质。
我国对于板栗产业副产品的开发集中于板栗壳和板栗总苞,焦启扬等[12]和张琳等[13]发现,板栗壳和板栗总苞的主要成分是以没食子酸、鞣花酸为主的植物多酚。李金凤等[14]和鲁晓翔等[15]报道了板栗壳多酚的体外抗氧化能力;焦启扬等[12]研究表明,板栗总苞提取物对大肠杆菌、金黄色葡萄球菌及藤黄微球菌均有不同程度的抑制活性;黄宏妙等[16]研究表明,板栗总苞水提液可降低自由基代谢造成的机体损伤,表现出较强的抗氧化能力。但关于将板栗总苞或板栗壳用作饲料添加剂的报道较少[17]。本研究以最大化的板栗总苞多酚提取得率为目标,确定水浴溶剂法提取板栗总苞多酚的最优提取工艺条件;并通过检测板栗总苞多酚对二苯代苦味酰基自由基(DPPH·)和2,2’-连氮-双 -(3-乙基苯并噻唑啉 -6-磺酸)自由基(ABTS+·)清除率以及猪油过氧化值(POV)的影响,研究板栗总苞多酚的体外抗氧化能力,为板栗总苞多酚作为抗氧化饲料添加剂的应用提供理论依据。
1 材料与方法
1.1 材料与主要试剂
板栗总苞(采自北京市怀柔区板栗实验站):用粉碎机将板栗壳粉碎并过80目筛,-18℃避光保存备用。
主要试剂:福林-酚(FC)试剂、没食子酸标准品(含量 >98%)和 DPPH购于 Sigma公司;ABTS购于东京化成工业株式会社;维生素C和维生素E购于北京奥博星生物技术有限责任公司。
1.2 板栗总苞多酚提取工艺流程
干燥板栗总苞→粉碎→溶剂与物料混合→不同条件下水浴提取(每个样提取2次)→混合2次提取液→离心→浓缩→板栗总苞多酚提取液→冷冻干燥→提取物粉末。
1.3 板栗总苞多酚提取条件的研究
1.3.1 单因素试验设计
称取10 g板栗总苞,用乙醇浓度为60%,液料比为20∶1(mL∶g),提取温度为60 ℃,提取时间为120 min作为进行单因素筛选试验的基础条件。当研究某一因素时,其他条件保持不变。乙醇浓度分别选用20%、30%、40%、50%、60%和70%;液料比(mL∶g)分别选用 15∶1、20∶1、25∶1、30∶1 和35∶1;提 取 时 间 分 别 选 用 40、80、120、160 和200 min;提取温度分别选用 50、60、70、80 和90℃,按上述设计分别进行单因素不同水平的选择试验,得到的提取物按照标准曲线处理方法,测定在765 nm波长处的吸光度,并计算转换为板栗总苞多酚提取得率,以此比较提取效果。
1.3.2 正交试验设计
为了综合考虑各因素对板栗总苞多酚提取得率的影响,根据1.3.1中单因素试验结果,选取乙醇浓度、液料比、提取时间和提取温度为4个考察因素,利用 SPSS 16.0设计四因素四水平[L16(44)]正交试验,试验因素水平见表1。

表1 试验因素水平Table 1 Factors and levels of this experiment
1.3.3 板栗总苞多酚的测定
1.3.3.1 没食子酸标准曲线的制作
准确称取5 mg没食子酸标准品于50 mL容量瓶中,定容至刻度,配成0.1 mg/mL的标准液,分别吸取 0.5、1.0、1.5、2.0 和 2.5 mL 没食子酸标准液(0.1 mg/mL)并定容至10 mL,配制成质量浓度为 0.005、0.010、0.015、0.020、0.025 mg/mL的标准溶液。精确吸取上述标准溶液0.4 mL于10 mL离心管中,加入0.2 mol/L FC试剂1 mL、15%Na2CO3溶液2 mL,蒸馏水定容至 8 mL,25℃反应2 h。另精确吸取蒸馏水0.4 mL,同法操作作为空白对照。在765 nm波长处测量其吸光度。绘制吸光度与浓度的标准曲线(图1),并拟合线性回归方程。

图1 没食子酸标准曲线Fig.1 Standard curve of gallic acid
所得标准曲线的线性回归方程为:

式中:Y为吸光度;X为没食子酸标准品浓度(mg/mL)。标准曲线表明,没食子酸在浓度为0.005~0.030 mg/mL区间有良好的线性关系。1.3.3.2 板栗总苞多酚提取得率、多酚含量计算
按照以下公式计算板栗总苞多酚提取得率、多酚含量:
提取得率(%)=提取物质量/原材料质量×100;
多酚含量(%)=提取多酚质量/提取物质量×100。
1.4 板栗总苞多酚体外抗氧化试验
1.4.1 样品处理
板栗总苞多酚和维生素C母液的配制:分别精确称取0.5 g板栗总苞多酚和维生素C粉末放于烧杯中,加蒸馏水溶解,将此溶液转移到500 mL的容量瓶中,用蒸馏水定容至刻度,配成终浓度为1 mg/mL的母液;维生素E母液的配制:精确称取0.5 g维生素E粉末于烧杯中,加体积比为10%的乙醇水溶液20 mL,振荡使之溶解,转移到500 mL容量瓶中,加蒸馏水定容至刻度,配成终浓度为1 mg/mL的母液。
1.4.2 DPPH·清除率测定
参考Luo等[18]的方法,同时作适当修改。取板栗总苞多酚、维生素C和维生素E母液,分别稀释成 不 同 浓 度 (0.025、0.050、0.075、0.100、0.125、0.150、0.175 和 0.200 mg/mL) 的溶液。吸取不同浓度的板栗总苞多酚、维生素C和维生素 E 溶液 2.0 mL,加入 2.0 mL DPPH·溶液(0.2 mmol/L),摇匀,避光放置 30 min。以无水乙醇调零,测定517 nm波长处的吸光度(A样);分别测定2.0 mL不同浓度的板栗总苞多酚、维生素C和维生素E溶液与2.0 mL无水乙醇混合液的吸光度作为对照(A对照);测定2.0 mL DPPH·溶液与2.0 mL无水乙醇混合液的吸光度作为空白(A空白)。DPPH·清除率按以下公式计算:
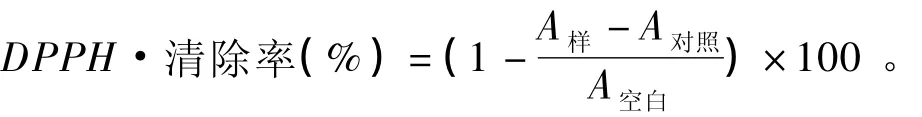
1.4.3 ABTS+·清除率测定
参考Re等[19]的方法,同时作适当修改。取板栗总苞多酚、维生素C和维生素E母液,分别稀释成不同浓度(0.050、0.100、0.150、0.250、0.300、0.400、0.450 和 0.500mg/mL) 的 溶 液。ABTS+·储备液配制:配制2.45 mmol/L过硫酸钾,用过硫酸钾溶解ABTS粉末,配成7 mmol/L ABTS+·储备液,避光、4℃冰箱中保存备用。ABTS+·测定液配制:将ABTS+·储备液以磷酸盐缓冲液(10 mmol/L,pH 7.4)稀释,使其吸光度在734 nm波长处达到(0.700±0.020)。测定方法:取4 mL ABTS+·测定液,加入40 μL不同浓度的板栗总苞多酚、维生素C和维生素E溶液,振荡30 s,反应10 min,在734 nm波长处测定吸光度(A样)。ABTS+·清除率按以下公式计算:
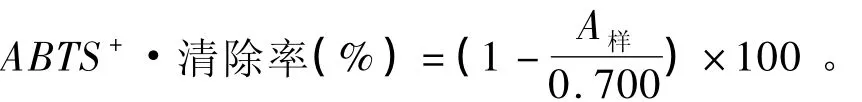
1.4.4 猪油 POV 测定
取板栗总苞多酚母液,分别稀释成浓度为0(对照组)、50、100、150 和 200 μg/mL 的板栗总苞多酚溶液,各取4 mL,分别添加到盛有4 g猪油的烧杯中,混匀,放于60℃烘箱里[20],每个浓度做3个平行试验,分别在 0、4、8、12、16 和 20d 时,参考GB/T 5538—2005方法测定猪油中POV。从结果中选取板栗总苞多酚最佳浓度,然后,以同样的方法和测定时间,测定板栗总苞多酚和维生素C、维生素E在此浓度下对猪油中POV的影响。
1.5 统计分析
正交试验L16(44)由SPSS 16.0软件生成,采用GLM程序对正交试验结果进行方差分析,并确定提取工艺条件最优化组合。采用ANOVA程序对板栗总苞多酚与维生素C、维生素E抗氧化性进行分析并用Turkey进行多重比较。
2 结果与分析
2.1 单因素试验结果与分析
由表2可知,随着乙醇浓度增大,板栗总苞多酚提取得率呈现先增加后降低趋势,当乙醇浓度达到40%时,提取得率达到最大,此后随乙醇浓度的增大,提取得率逐渐减小,由此,初步选定的乙醇浓度为30%;随着液料比增加,板栗总苞多酚提取得率呈现先增加后趋于水平,液料比在30∶1(mL∶g)以后,提取得率趋于水平,考虑材料的节省,初步选用液料比为20∶1(mL∶g);随着提取温度的上升,板栗总苞多酚提取得率呈现先上升后降低的趋势,到80℃时,提取得率达到最大,因此,初步选用的温度为80℃;随着提取时间的延长,板栗总苞多酚提取得率先增加后趋于稳定,考虑到实际生产中操作时间过长也会提高成本,浪费能源,因此,初步选用的提取时间为160 min。
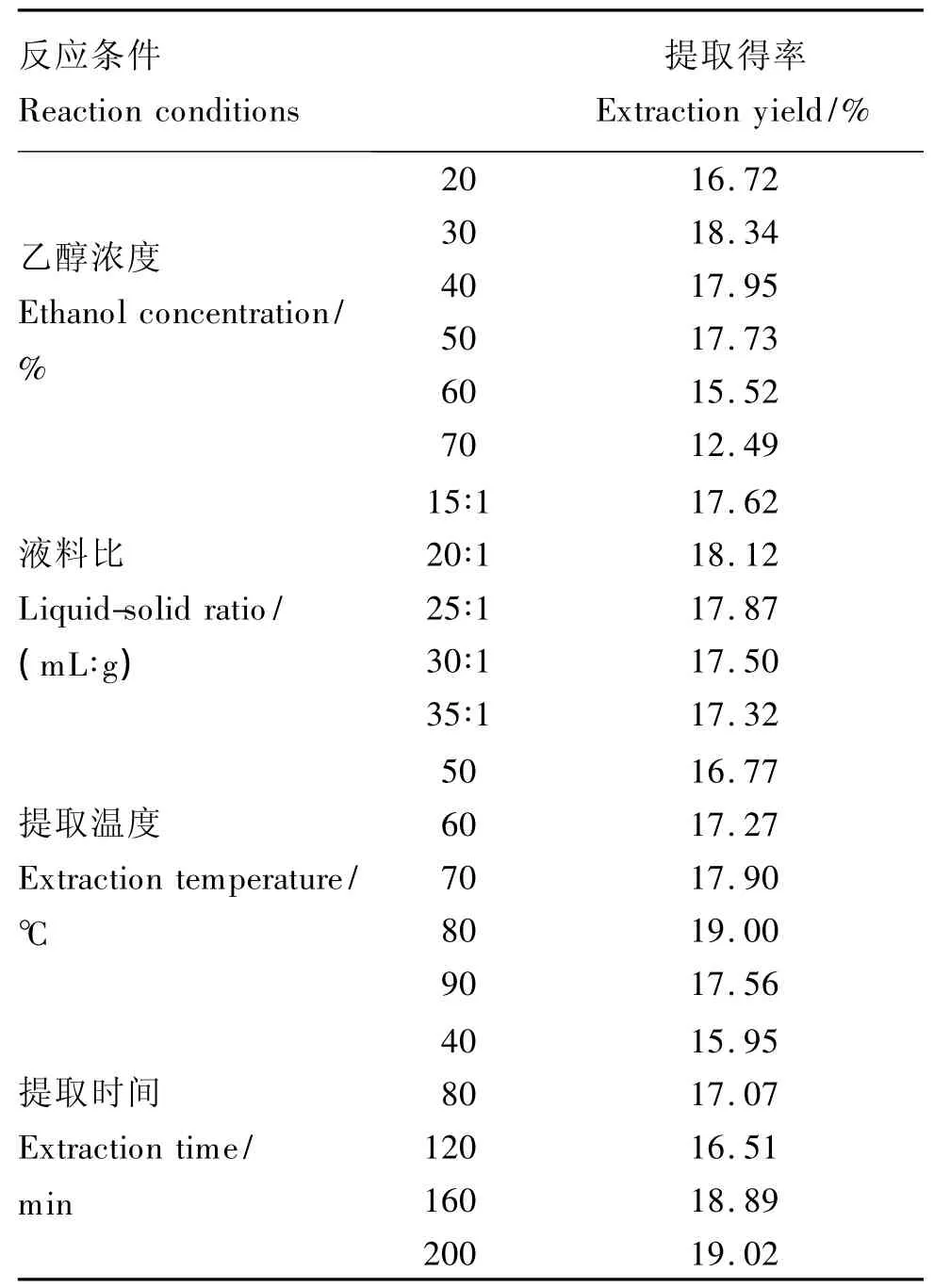
表2 单因素试验结果Table 2 The results of single factor test
2.2 正交试验结果与分析
2.2.1 正交试验结果及其方差分析和最优条件分析
表3给出正交试验的结果,并对结果进行了方差分析,由表4可知,校正模型达到极显著水平(P<0.01),说明模型拟合程度良好,误差小,模型是合适的;校正模型的相关系数R2=0.992,校正决定系数R2
adj=0.960,说明试验方法可靠,能较好地描述试验结果,对真实试验点的分析是可行的。根据四因素P值的大小可知,提取温度(D)、乙醇浓度(A)和液料比(B)对板栗总苞多酚提取得率有显著或极显著影响(P<0.05或 P<0.01),提取时间(C)无显著影响(P>0.05),因此,影响因素主次顺序为:D>A>B>C。
表5显示了各因素不同水平的板栗总苞多酚提取得率,从结果直观分析,各因素水平对板栗总苞多酚提取得率影响的强弱顺序是:A30>A40>A50> A20,B18∶1> B21∶1> B24∶1> B15∶1,C140> C110>C170>C80,D80>D60>D70>D90,因此确定板栗总苞多酚最优提取工艺为:A30B18∶1C140D80,即乙醇浓度 30%,液料比 18∶1(mL∶g),提取时间 140 min,提取温度80℃。
2.2.2 板栗总苞多酚提取得率和多酚含量
取10 g板栗总苞粉末,按上述正交试验设计得出的最佳工艺条件提取2次,浓缩、冷冻干燥得到板栗总苞多酚粉末。称取部分板栗总苞多酚粉末,用蒸馏水溶解,定容、检测吸光度,并换算得到板栗总苞多酚提取得率和多酚含量。计算出本试验条件下板栗总苞多酚提取得率为22.61%,其中多酚含量为51.23%
2.3 板栗总苞多酚体外抗氧化性
2.3.1 板栗总苞多酚对DPPH·清除能力的影响
由图 2可知,在 0.003~0.025 mg/mL 范围内,随着板栗总苞多酚和维生素C溶液浓度的增加,DPPH·清除率增加,并具有一定线性关系,线性方程分别为 Y=3 279.3X+10.5(R2=0.987 0)和 Y=3 214X+18.262(R2=0.938 8),当浓度达到0.025 mg/mL后,DPPH·清除率趋于稳定;随着维生素E溶液浓度增加,DPPH·清除率不断增加并具有一定线性关系,线性方程为Y=107.99X+8.908 3(R2=0.952 3)。DPPH·清除能力的大小常用半清除率(EC50)表示,EC50是当清除率达到50%时所需要的抗氧化剂浓度,因此,本试验中板栗总苞多酚、维生素C和维生素E的EC50分别为 0.012 0、0.009 7 和 0.381 0 mg/mL,EC50越小,清除DPPH·的能力越大,则其抗氧化能力就越强,由此得出,板栗总苞多酚的抗氧化能力与维生素C相当,且两者的抗氧化能力均优于维生素E,所以板栗总苞多酚有较强的抗氧化能力。

表3 正交试验[L16(44)]结果Table 3 The results of orthogonal test[L16(44)]
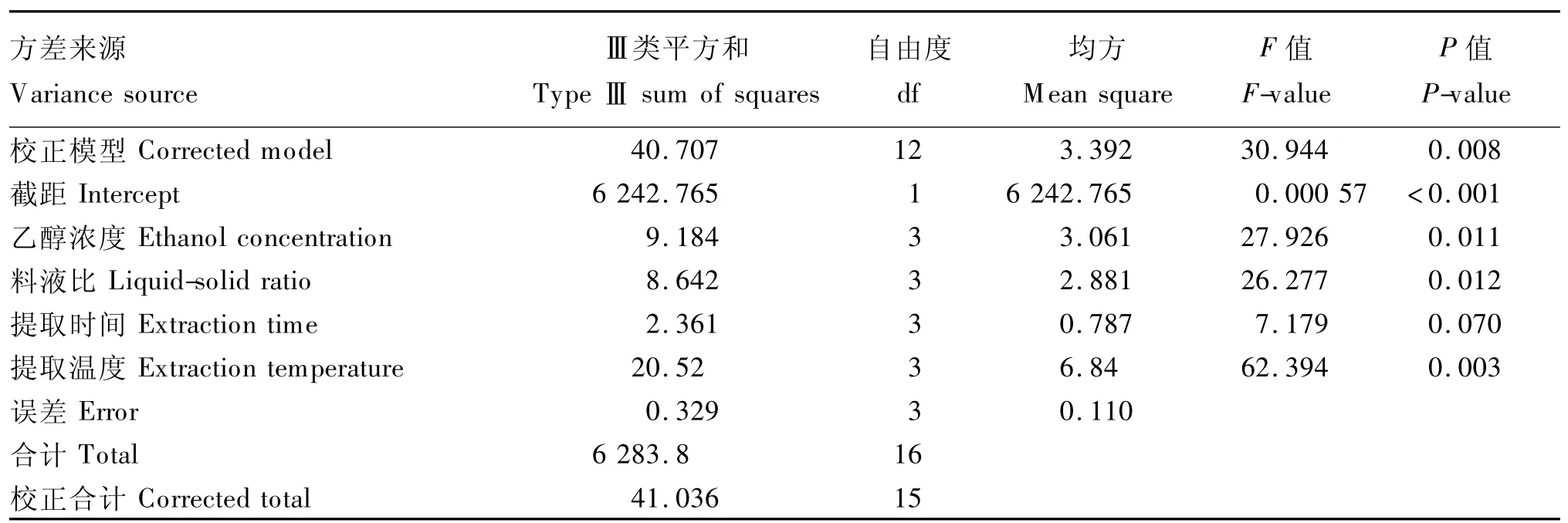
表4 正交试验结果的方差分析Table 4 Analysis of variance for results of orthogonal test
2.3.2 板栗总苞多酚对 ABTS+·清除能力的影响
ABTS经过氧化生成稳定的蓝绿色的ABTS+·,当有抗氧化物后,其与ABTS+·反应使反应体系褪色。由图3可知,板栗总苞多酚、维生素C和维生素E对ABTS+·的清除能力随板栗总苞多酚、维生素C和维生素E溶液浓度的增大而增大,维生素 E很快达到平衡,在0~0.200 mg/mL之间它们的清除自由基的能力都具有一定的线性关系,线性方程分别为Y=349.41X+9.520 4(R2=0.995 2),Y=336.39X+3.837 9(R2=0.977 5) 和 Y=61.048X+8.688 8(R2=0.983 8),它们的 EC50分别为 0.116 0、0.137 0和0.676 7 mg/mL,所以,板栗总苞多酚对ABTS+·的清除能力优于维生素C和维生素E。由此可知,板栗总苞多酚对ABTS+·有很好的清除能力。
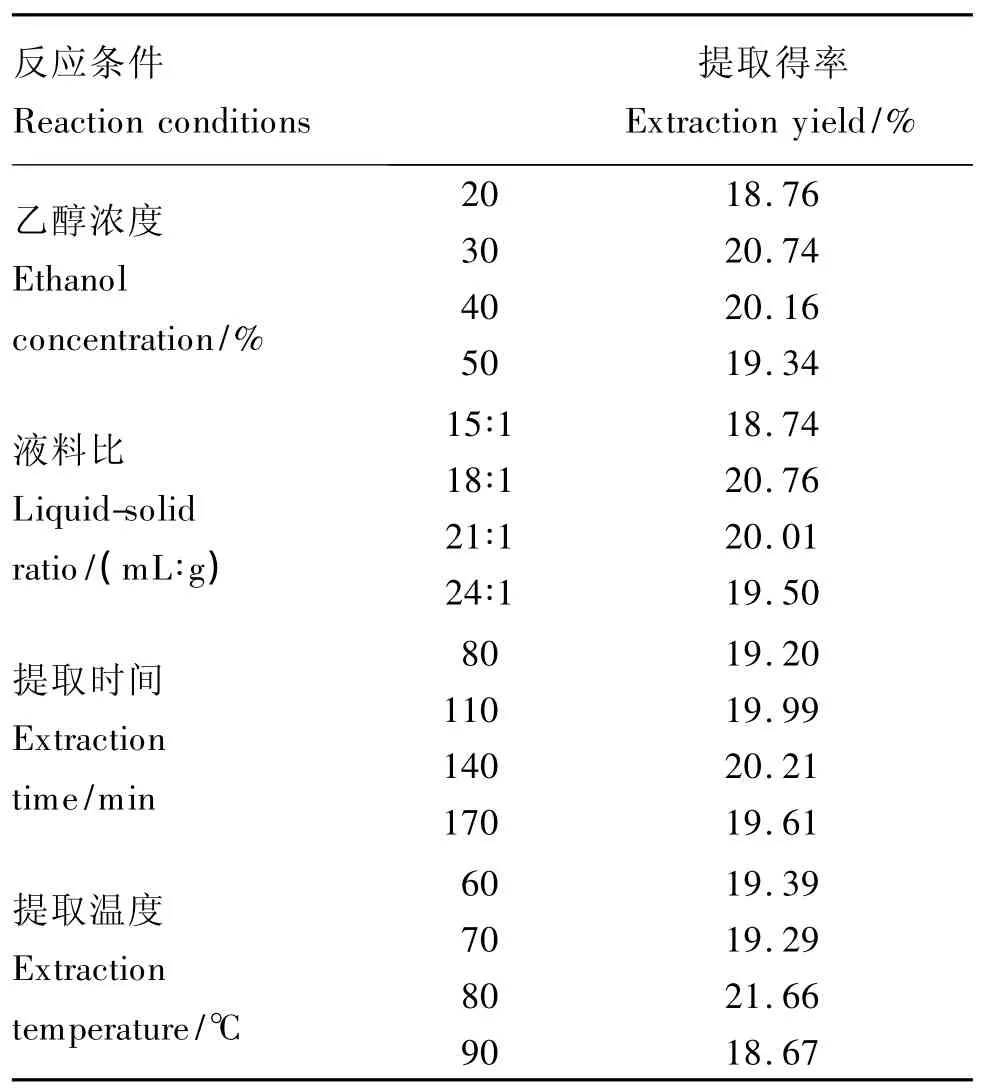
表5 最优条件分析Table 5 Analysis of optimal conditions

图2 清除DPPH·效果Fig.2 Scavenging effects on DPPH·
2.3.3 板栗总苞多酚对猪油POV的影响
由图4可知,经过20d的60℃加热强化氧化作用,对照组(0 μg/mg)猪油的POV迅速增大,而添加板栗总苞多酚组的POV显著小于对照组(P<0.05),由此说明板栗总苞多酚对猪油有良好的抗氧化效果,且抗氧化作用与板栗总苞多酚溶液浓度有关,随着浓度的增加,板栗总苞多酚的抗氧化性能逐渐升高,浓度在0~100 μg/mg之间板栗总苞多酚的抗氧化性能变化显著(P<0.05),而浓度在100~200 μg/mg之间,抗氧化性能变化不显著(P >0.05),所以,选 100 μg/mg 作为板栗总苞多酚对猪油抗氧化的最佳浓度,此浓度下板栗总苞多酚的抗氧化效果与同浓度的维生素C相当,且二者均优于同浓度的维生素E(图5)。因此,板栗总苞多酚能很好地抑制动物油POV的升高。
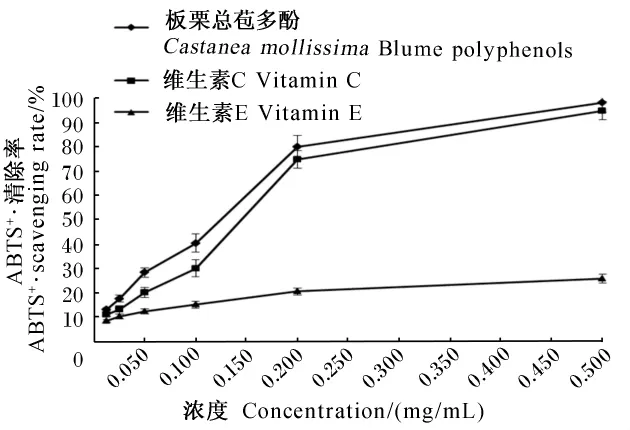
图3 清除ABTS+·的效果Fig.3 Scavenging effects on ABTS+·
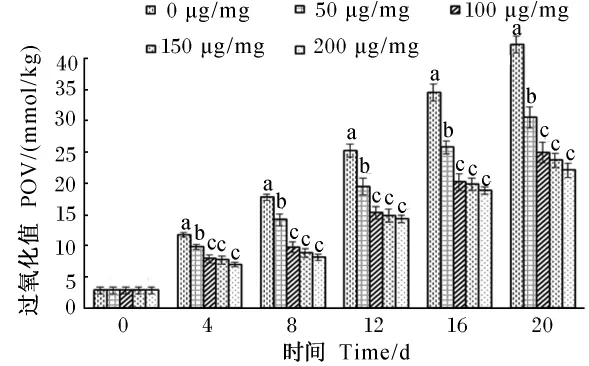
图4 不同板栗总苞多酚浓度对猪油POV的影响Fig.4 Effects ofdifferent cocentrations of polyphenols in Castanea mollissima Blume on POV
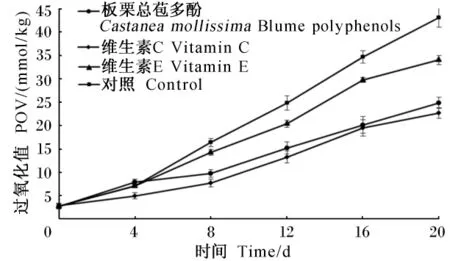
图5 不同抗氧化剂对猪油POV的影响Fig.5 Effects ofdifferent antioxidants on POV
3 讨论
3.1 板栗总苞多酚提取工艺的优化
李金凤等[14]采用水浴法浸提板栗壳多酚,得到的最佳提取条件为:乙醇浓度59.7%,液料比18∶1(mL∶g),浸提温度 52.6 ℃,浸提次数 3 次。在此最优工艺条件下板栗壳多酚提取得率7.59%。鲁晓翔等[15]采用水浴振荡法优化板栗壳多酚的提取工艺,最终确定最优提取条件为:乙醇浓度30%,液料比23∶1(mL∶g),并在 70℃水浴条件下振荡提取170 min。在此条件下,板栗壳多酚提取得率7.9%。以上板栗壳多酚提取得率都低于本研究板栗总苞多酚提取得率,出现这样结果的原因可能是板栗总苞中多酚含量高于板栗壳中的多酚含量。焦启扬等[12]和张琳等[13]分离并鉴定板栗总苞乙醇提取物的化学成分,并鉴定化合物结构,发现板栗总苞提取物有没食子酸、鞣花酸、莽草酸、槲皮素、原儿茶素、齐墩果酸、乌索酸等多种多酚成分,并具有抗糖尿病作用。杜运平等[21]采用醇水溶液为提取剂提取板栗苞多酚,优化工艺为:40%的乙醇浓度,液料比为 20∶1(mL∶g),在80℃提取条件下提取120 min,在此条件下,多酚含量为49.83%,与本研究提取方法[乙醇浓度为30%,液料比为18∶1(mL∶g),提取时间为140 min,提取温度为80℃]相似,但其提取物中的多酚含量低于本研究所获得的多酚含量(51.23%)。试验结果表明,本试验提取工艺可行,同时节省了原材料,降低了提取物中乙醇的残留量,提高了多酚提取得率。
3.2 板栗总苞多酚体外抗氧化性研究
板栗总苞多酚研究的最多是其抗氧化性,本研究发现其有很强的抗氧化能力,目前还没有发现关于板栗总苞多酚抗氧化性研究的文献报道。但是前人已经发现板栗壳、花、叶和果仁等的多酚具有抗氧化能力。鲁晓翔等[15]研究板栗壳与维生素C对DPPH·溶液清除率的大小,并确定板栗壳多酚抗氧化性的大小,试验结果为5 mg/mL的多酚提取液对DPPH·的清除率为91.49%,低于维生素C的清除率(96.18%)。通过同样的方法李金凤等[14]研究发现,板栗壳提取物的浓度为200 mg/L时,DPPH·抑制率达89.7%,均高于同质量浓度的2,6-二叔丁基 -4-甲基苯酚(BHT),但低于同质量浓度维生素C。但本研究表明,板栗总苞多酚与维生素C抗氧化能力相当,与以上研究板栗壳多酚和维生素C抗氧化能力的比较结果不同,可能是由于板栗总苞中多酚的含量高于板栗壳所致。Dinis等[22]研究不同生态环境下板栗的抗氧化性试验中发现,DPPH·的EC50在 7.3 ~33.5 mg/mL 之间,ABTS+·的 EC50在5.2~14.1 mg/mL之间,此结果与本研究板栗总苞多酚的 DPPH·的 EC50为 0.0120 mg/mL,ABTS+·的EC50为0.116 0 mg/mL的结果不同,出现这种结果的原因可能是研究试验中板栗的品种不一样,提取得率不一致,导致多酚抗氧化性有差别。Barreira等[7]研究发现,板栗树的花、叶子、树皮和果实提取物 DPPH·的 EC50在0.032 7~0.170 0 mg/mL范围内,此结果与本研究DPPH·的EC50(0.012 0 mg/mL)试验结果一致。但是,通过板栗总苞多酚对动物油POV的影响来研究板栗总苞多酚抗氧化性能,还没有发现相关的国内外文献报道。
4 结论
①由板栗总苞多酚提取条件的研究可知,各因素对板栗总苞多酚提取得率的影响次序是:提取温度>乙醇浓度>液料比>提取时间。最佳提取工艺为:乙醇浓度30%,提取温度80℃,提取时间 140 min,液料比 18∶1(mL∶g),在以上最优条件下板栗总苞多酚提取得率为22.61%,提取物中多酚含量为51.23%。
②由板栗总苞多酚抗氧化性试验结果可知,板栗总苞多酚对DPPH·和ABTS+·的清除能力很强;板栗总苞多酚对猪油有良好的抗氧化效果,与板栗总苞多酚的浓度有关,100 μg/mg为板栗总苞多酚对猪油抗氧化的最佳浓度。
致谢:
感谢北京农学院动物科学与技术学院郭凯军副教授和食品科学与工程学院贾昌喜教授对文稿所提的宝贵意见。
[1] 石碧,狄莹.植物多酚[M].北京:科学出版社,2000:1-2.
[2] OKUDA T,KIMURA Y,YOSHIDA T,et al.Studies on activities of tannins and related compounds from medicinal plants anddrugs.Ⅰ.Inhibitory effects on lipid peroxidation in mitochondria and microsomes of liver[J].Chemical& Pharmaceutical Bulletin,1983,31(5):1625-1631.
[3] KIMURA Y,OKUDA H,MORI K,et al.Studies on the activities of tannins and related compounds from medicinal plants anddrugs.Ⅳ.Effects of various extracts of Geranii herba and geraniin on liver injury and lipid metabolism in rats fed peroxidatal oil[J].Chemical& Pharmaceutical Bulletin,1984,32(5):1866 -1871.
[4] TAKECHI M,TANKA Y,TAKEHARA M,et al.Structure and antiherpetic activity among the tannins[J].Phytochemistry,1985,24(10):2245 -2250.
[5] GALI U,PERCHELLET E,KLISK D,et al.Antitumor-promoting activities of hydrolyzable tannins in mouse skin[J].Carcinogensis,1992,13(14):715 -718.
[6] YOSHIDA T,TONG C,MATSUDA M,et al.Woodfordin D and oenothein A,trimeric hydrolyzable tannins of marco-ring structure with antitumor activity[J].Chemical& Pharmaceutical Bulletin,1991,39(5):1157-1162.
[7] BARREIRA J C M,FERREIRA I C F R,OLIVEIRA M B P P,et al.Antioxidant activities of the extracts from chestnut flower,leaf,skins and fruit[J].Food Chemistry,107(3):1106 -1113.
[8] TABACCO E,BORREANI G,CROVETTO G M,et al.Effect of chestnut tannin on fermentation quality,proteolysis and protein rumendegradability of alfalfa silage[J].Journal of Dairy Science,2006,89:4736 -4746.
[9] SCHIAVONE A,GUO K,TASSONE S,et al.Effects of a natural extract of chestnut wood ondigestibility,performance traits,and nitrogen balance of broiler chicks[J].Poultry Science,2008,87:521 - 527.
[10] ZOCCARATO I,GASCO L,SCHIAVONE A,et al.Effect of extract of chestnut wood inclusion(ENC)in normal and low protein amino acid supplementeddiets on heavy broiler rabbits[C]//Proceedings of the 9th world rabbit congress.Verona:[s.n.],2008:873-877.
[11] LIU H W,XIAO F D,JIAN M T,et al.A comparative study of growth performance and antioxidant status of rabbits when fed with or without chestnut tannins under high ambient temperature[J].Animal Feed Science and Technology,2011,164:89 -95.
[12] 焦启扬,吴立军,黄建,等.板栗总苞化学成分的分离与鉴定[J].沈阳医科大学学报,2009,26(1):23-26.
[13] 张琳,高慧媛,马场正树,等.板栗总苞中的抗糖尿病活性成分[J].沈阳药科大学学报,2010(7):530 -532,538.
[14] 李金凤,段玉清,马海乐,等.板栗壳中多酚的提取及体外抗氧化性研究[J].林产化学与工业,2010(2):53-58.
[15] 鲁晓翔,赵晨光,连喜军.板栗壳多酚提取条件及其抗氧化性研究[J].食品研究与开发,2008(3):32-36.
[16] 黄宏妙,李灵,郭占京,等.板栗毛壳水提液对大鼠脑缺血再灌注损伤后羟自由基、NO和GSH-Px的影响[J].时珍国医国药,2010(11):2917-2918.
[17] DIAO Q,QI G.Tannins in livestock feed in China[C]//Tannins in Livestock and Human Nutrition.Proceedings of an international workshop on tannins in livestock and human nutrition.Adelaide:[s.n.],2003:76-80.
[18] LUO W,ZHAO M M,YANG B,et al.Identification of bioactive compounds in Phyllanthus emblica L.fruit and their free radical scavenging activities[J].Food Chemistry,2009,114:499 -504.
[19] RE R,PELLEGRIEGRINI N,PROTEGGENTE A,et al.Antioxidant activity applying an improved ABTS radical cationdecolorization assay[J].Free Radical Biology & Medicine,1999,26:1231 -1237.
[20] SILVA A C D,JORGE N.Oxidative stability of soybean oil added to Lentinus edodes and Agaricus blazei mushrooms extracts in an accelerated storage test[J].Nutrition & Food Science,2012,42(1):34 -40.
[21] 杜运平,徐浩,张宗和,等.板栗苞多酚提取条件研究[J].安徽农业科学,2011,39(2):828 -829,839.
[22] DINIS L T,OLIVEIRA M M,ALMEIDA J,et al.An-tioxidant activities of chestnut nut of Castanea sativa mill.(cultivar‘Judia’)as function of origin ecosystem[J].Food Chemistry,2012,132:1-8.

