金欣口服液对RSV感染BALB/c小鼠TLR7 mRNA和蛋白表达的影响
戴启刚, 汪受传, 徐建亚, 李佳曦, 梁晓鑫, 李 涛, 孙寒丹
(南京中医药大学中医儿科研究所,江苏南京 210029)
呼吸道合胞病毒 (respiratory syncytial virus,RSV)感染呼吸道后通过诱导上皮细胞分泌细胞因子、趋化因子等炎性介质,引起支气管痉挛产生气道高反应[1],是世界范围内婴幼儿病毒性下呼吸道感染最主要的病毒病原,中医药治疗RSV感染有良好的临床疗效。前期临床和实验研究显示金欣口服液 (原名清肺口服液)是治疗小儿病毒性肺炎的有效中药制剂[2],有拮抗RSV作用[3-5]。现代相关研究已证实Toll样受体 (Toll-like receptor,TLRs)与RSV感染密切相关[6],TLRs介导的信号通路既可激活天然免疫又可调节获得性免疫,参与天然免疫系统对病毒的识别,在抗病毒感染中发挥了重要的作用[7-9]。目前已经发现13个TLRs成员,TLR7是与RSV关系最为密切的TLRs之一[10]。TLR7通过识别病毒单链RNA(single-stranded RNA,ssRNA)以依赖髓样分化因子-88(MyD88)的信号通路活化免疫细胞,介导抗病毒免疫。
本实验以RSV感染BALB/c小鼠引发肺炎,观察小鼠肺组织中TLR7 mRNA、蛋白表达及金欣口服液对它们的作用,探讨金欣口服液可能的抗病毒作用机制。
1 材料
1.1 动物 清洁级 BALB/c小鼠,8~10周龄,雌性,18~22 g,扬州大学比较医学中心,许可证号:SCXK(苏)2007-0001,饲养于南京中医药大学实验动物中心;呼吸道合胞病毒A亚型 (Long株),武汉国家典型培养物保藏中心。
1.2 药品 金欣口服液 (浸膏):全国名老中医、南京中医药大学中医儿科研究所所长汪受传教授经验方,由炙麻黄3 g、苦杏仁10 g、生石膏20 g、黄芩6 g、葶苈子10 g、桑白皮10 g、前胡10 g、虎杖12 g组成,按比例取药,用10倍量水浸泡药物30 min,先煎生石膏30 min后,再将其他药放入大火煮沸后小火煎煮30 min,取出药汁,药材中再加入8倍量水依上法煎煮,合并两次药汁用旋转蒸发仪低压浓缩为质量浓度为1.351 g/L的金欣口服液;利巴韦林颗粒 (新博林),50 mg/包,四川百利药业有限责任公司,国药准字H51023508,批号110647。
1.3 主要仪器 电泳槽、Trans-Blot_SD半干转印槽,美国Bio-rad;超低温冰箱,美国Theromo公司;BioPhotometer蛋白核酸分析仪、MJ mini梯度PCR仪、高速台式冷冻离心机、面包式离心机、移液枪,德国Eppendorf公司;漩涡振荡器、水平摇床,江苏海门麒麟医用仪器厂;电子天平,上海天平仪器厂;制冰机,美国Scotsman公司;Lightrcycler实时荧光定量PCR仪,德国Roche公司。
1.4 主要试剂 RNA提取试剂盒RNAiso plus、实时荧光定量PCR试剂盒,日本TAKARA公司;TLR7引物,上海生工生物技术有限公司;β-Actin抗体、羊抗兔HRP标志二抗,美国CST公司;TLR7多克隆抗体,美国abcam公司;蛋白裂解液RIPA(增强型)、PMSF,碧云天生物技术有限公司;TRIS base、甘氨酸,北京索莱宝公司;光明牌脱脂奶粉,光明乳业有限公司;5倍上样缓冲液、预染蛋白分子质量标准Marker(10~170 kDa),南京生兴生物技术有限公司;29∶1丙烯酰胺-甲叉双丙烯酰胺混合物 (Acr-Bis)、10%十二烷基磺酸钠 (SDS)、过硫酸铵 (AP),美国伯乐;PVDF膜 (0.45 μm孔径),Millipore;封口膜,Parafilm;胶片,柯达公司;余为国产分析纯。
2 实验方法
2.1 动物分组 选用清洁级健康BALB/c小鼠,8~10周龄,雌性,18~22 g。动物分两大组:72 h组 (RSV首次滴鼻72 h后采集标本)、144 h组 (RSV首次滴鼻144 h后采集标本);每大组又分为5小组,正常组、RSV感染模型组、利巴韦林组、金欣高剂量组、金欣等效剂量组。每组15只小鼠。利巴韦林组给予临床等效剂量46 mg/(kg·d),金欣等效剂量组给予临床等效剂量27.6 g/(kg·d),金欣高剂量组给药138 g/(kg·d)(相当于临床等效剂量的5倍)。药物实验组每日剂量分2次灌胃,正常组与RSV组灌胃同等剂量的生理盐水。
2.2 造模及给药方式 健康BALB/c小鼠于无病原体环境中常规饲养3 d后开始正式实验。行乙醚浅麻后滴鼻TCID50RSV 50 μL/只 (正常组滴鼻同体积无血清DMEM培养基),每天滴鼻2 h后给相应药物灌胃,72 h组RSV滴鼻3 d、灌胃3 d,144 h组RSV滴鼻3 d、灌胃5 d,具体方案如图1。观察小鼠反应,若有首次滴鼻RSV造模48 h后,出现发热、寒战、蜷卧、竖毛、厌食、流涕、呼吸频率加快等为阳性反应,示造模成功。
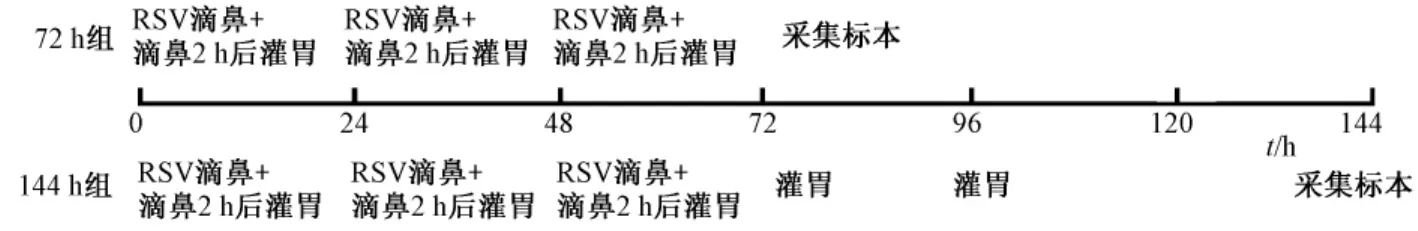
图1 实验造模及给药方案流程图
2.3 肺组织的采集 用乙醚将小鼠麻醉后开胸取肺组织,置于-70℃保存,分别取5只肺组织用于realtime PCR检测TLR7 mRNA水平,5只肺组织用于 Western Blot检测TLR7蛋白表达水平。
2.4 Realtime PCR检测肺组织中TLR7 mRNA水平 液氮中加RNAiso plus 1 mL研磨肺组织,按说明书提取组织总RNA,琼脂糖凝胶电泳及生物分光光度计对RNA定性及定量分析,按照RT-PCR试剂盒说明书将RNA反转录成cDNA,SYBR Green realtime PCR法检测TLR7 mRNA转录水平,TLR7引物设计参照文献 [11],TLR7:正义链5'-CTGGAGTTCAGAGGCAACCATT-3',反义链 5'-GTTATCACCGGCTCTCCATAGAA-3';内参β-actin:正义链5'-GCCTTCCTTCTTGGGTAT-3',反义链 5'-GTCTTTACGGATGTCAACG-3'。Real time PCR反应条件:95℃预变性10 s,95℃变性5 s,55℃退火10 s,72℃延伸15 s,共45个循环,同时做熔解曲线。重复3次。Real-Time PCR结果采用相对定量法计算,2-ΔΔCt方法是Real-Time PCR实验中分析基因表达相对变化的一种简便方法[12],ΔΔCt=(Ct样本 -Ct内参)受试组- (Ct样本-Ct内参)对照组。
2.5 Western Blot法检测肺组织TLR7蛋白表达 液氮中研磨肺组织,每100 mg肺组织中加入500 μL增强型RIPA与PMSF混合液 (两者比例100∶1)裂解,4℃下13 000 r/min离心30 min,取上清,即为所提取之小鼠肺组织总蛋白。BCA法蛋白定量并根据结果调整使各样品总蛋白含量一致,5倍上样缓冲液蛋白变性,5%浓缩胶及10%分离胶SDSPAGE凝胶电泳,PVDF膜转印,5%TBST脱脂奶粉封闭2 h,1∶500兔源性TLR7一抗4℃孵育过夜、1∶500羊抗兔二抗孵育2 h,ECL法显色,胶片压片。ImageJ软件分析蛋白条带灰度值,以β-actin作为内参照蛋白进行校准,采用目标蛋白条带灰度值/β-actin条带灰度值来表示TLR7蛋白相对表达水平。
2.6 统计学方法 应用SPSS 17.0统计软件,单因素方差分析 (One-Way ANOVA)对结果进行统计分析,数据以±s表示,P<0.05为差异有统计学意义。
3 结果
3.1 RSV感染BALB/c小鼠模型复制 依2.2项造模方法予RSV滴鼻48 h后,BALB/c小鼠出现精神萎糜、体温升高 (测肛温)、寒战、活动减少、蜷卧、竖毛、流涕、呼吸频率加快、厌食等阳性反应,每一组BALB/c小鼠呈现扎堆现象,示造模成功。
3.2 金欣口服液对肺组织中TLR7 mRNA的表达水平的影响 Realtime PCR检测肺组织中TLR7 mRNA水平,结果如表1所示。72 h组RSV模型组TLR7 mRNA水平为正常组的2.17倍,>2倍示结果有意义。金欣高剂量组、等效剂量组TLR7 mRNA水平与RSV模型组比较有显著差别 (P<0.01、P<0.05)。144 h组RSV模型组TLR7 mRNA水平为正常组的1.13倍,无意义。各组间TLR7 mRNA表达比较无显著差别。表明感染早期 (72 h)TLR7 mRNA的表达增加;当不再感染RSV,并随着治疗的深入,144 h组TLR7 mRNA的表达渐恢复至正常水平。
3.3 金欣口服液对肺组织中TLR7蛋白表达水平的影响Western Blot法检测肺组织TLR7蛋白表达水平,显影结果如图2所示。用Image J软件分析TLR7蛋白、内参β-actin条带灰度值。用 (TLR7/β-actin灰度值比) /(TLR7/β-actin灰度值比)正常组表示TLR7蛋白的相对表达水平,并进行组间比较,结果如表2所示。72 h组中RSV模型组的TLR7蛋白表达高于正常组 (P<0.01);与RSV模型组相比,金欣高剂量组、等效剂量组明显降低TLR7蛋白表达(P<0.01、P<0.05),两者之间同样存在着量-效关系。144 h组中实验各组TLR7蛋白表达均低于正常组 (P<0.01),金欣组TLR7蛋白表达高于RSV模型组,但相比无差异性。表明感染早期 (72 h),TLR7蛋白表达增加,到了144 h TLR7蛋白表达下降,金欣口服液使之趋向正常水平。
表1 RSV感染BALB/c小鼠肺组织中TLR7 mRNA表达水平(±s,n=5)
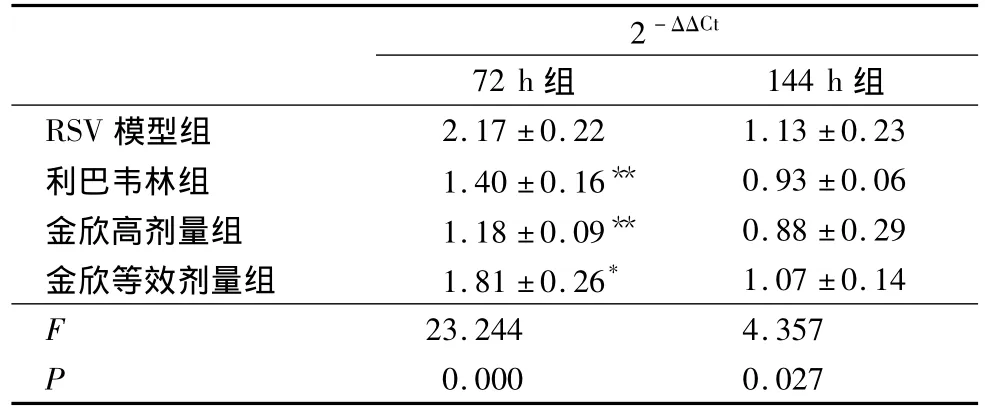
表1 RSV感染BALB/c小鼠肺组织中TLR7 mRNA表达水平(±s,n=5)
注:与 RSV模型组比较,*P <0.05,**P <0.01。
2 - ΔΔCt 72 h组 144 h组RSV模型组2.17 ±0.22 1.13 ±0.23利巴韦林组 1.40 ±0.16** 0.93 ±0.06金欣高剂量组 1.18±0.09** 0.88±0.29金欣等效剂量组 1.81 ±0.26* 1.07 ±0.14 F 23.244 4.357 P 0.000 0.027

图2 RSV感染BALB/c小鼠肺组织TLR7蛋白表达显影图

表2 RSV感染BALB/c小鼠肺组织中TLR7蛋白相对表达水平 (¯x ± s,n=5)
4 讨论
TLR7是Toll-like受体家族中与RSV关系最为密切的成员之一[10],参与对细菌、病毒、寄生虫和真菌感染的免疫应答。当RSV入侵机体时,TLR7可识别RSV ssRNA,从而激活髓样分化因子MyD88依赖的信号通路,通过调节通路下游因子—干扰素调节因子7(IRF7)引起IFN-α的表达[13]。IFN-α在病毒感染早期可抑制病毒的复制,是自然免疫重要的组成部分。Lund等用泡状口腔炎病毒 (VSV)全身感染野生型和TLR7-/-小鼠,结果野生型小鼠血清中IFN-α水平明显升高,而TLR7-/-小鼠血清中只有低水平的IFN-α[14];Xu等发现慢性乙肝患者浆细胞样树突状细胞(pDCs)受损后引起 TLR7下调,从而导致 IFN-α水平下降[15]。
金欣口服液是汪受传教授治疗小儿病毒性肺炎的临床验方,具有拮抗RSV作用。本实验通过设计72 h、144 h两个实验大组,每个实验大组又设计正常组、RSV感染模型组、利巴韦林组、金欣高剂量组、金欣等效剂量组5个实验小组,来观察金欣口服液对TLR7 mRNA及TLR7蛋白表达的影响及其随药物作用时间延长的变化趋势。结果表明,金欣口服液能下调RSV感染早期TLR7 mRNA及TLR7蛋白的表达,从而在病程早期即提高机体的抗病毒效应。而随着RSV感染的停止和治疗的持续,TLR7 mRNA及TLR7蛋白的表达下调,金欣口服液使之逐渐趋向正常水平,表明机体趋向恢复。
[1]Ghildyal R,Ho A,Jans D A.Central role of the respiratory syncytial virus matrix protein in infection[J].FEMS Microbiol Rev,2006,30(5):692-705.
[2]汪受传.中医药治疗小儿病毒性肺炎的研究[J].南京中医药大学学报,2009,25(5):338-341.
[3]廖 辉,汪受传,徐建亚,等.金欣口服液含药血清对呼吸道合胞病毒黏附膜融合影响的实验研究[J].实用中西医结合临床,2008,8(1):3-4.
[4]汪受传,王 霖,陈 超,等.清肺口服液含药血清对呼吸道合胞病毒抑制作用的实验研究[J].南京中医药大学学报,2008,24(1):25-27.
[5]白凌军,白凌鹰,汪受传,等.金欣口服液含药血清抗呼吸道合胞病毒作用研究[J].上海中医药大学学报,2009,23(6):48-50.
[6]Delgado M F,Coviello S,Monsalvo A C,et al.Lack of antibody affinity maturation due to poor Toll-like receptor stimulation leads to enhanced respiratory syncytial virus disease[J].Nat Med,2009,15(1):34-41.
[7]Akira S,Takeda K,Kaisho T.Toll-like receptors:critical proteins linking innate and acquired immunity[J].Nat Inmunol,2001,2(8):675-680.
[8]Akira S.Toll-like receptors and innate immunity[J].Adv Immunol,2001,78:1-56.
[9]于高水,杨玉荣,梁宏德.Toll样受体研究进展[J].细胞生物学杂志,2009,31(3):339-343.
[10]Janssen R,Pennings J,Hodemaekers H,et al.Host transcription profiles upon primary respiratory syncytial virus infection[J].J Virol,2007,81(11):5958-5967.
[11]Matsushima H,Yamada N,Matsue H,et al.TLR3-,TLR7-,and TLR9-mediated production of proinflammatory cytokines and chemokines from murine connective tissue type skin-derived mast cells but not from bone marrow-derived mast cells[J].J Immunol,2004,173(1):531-541.
[12]Schmittgen T D,Zakrajsek B A,Mills A G,et al.Quantitative reverse transcription polymerase chain reaction to study mRNA decay:comparison of endpoint and real time methods[J].Anal Biochem,2000,285(2):194.
[13]Tamura T,Yanai H,Savitsky D,et al.The IRF family transcription factors in immunity and oncogenesis[J].Annu Rev Immunol,2008,26:535-584.
[14]Lund J M,Alexopoulou L,Sato A,et al.Recognition of singlestranded RNA viruses by Toll-like receptor 7[J].Proc Natl Acad Sci USA,2004,101(15):5598-5603.
[15]Xu N,Yao H P,Lv G C,et al.Downregulation of TLR7/9 leads to deficient production of IFN-α from plasmacytoid dendritic cells in chronic hepatitis B[J].Inflamm Res,2012,61(9):997-1004.

