红细胞叶酸检测仪性能评价*
杨桂花,胡 梅,韩 静,张 曼
(首都医科大学附属北京世纪坛医院临床检验中心,北京 100038)
血液中的叶酸缺乏与巨幼细胞贫血[1]、高同型半胱氨酸血症[2]、脑血管疾病[3]以及胎儿神经管缺陷[4]密切相关。了解体内叶酸水平对于合理补充叶酸、减少以上疾病发生至关重要,叶酸的检测对营养状态判断、疾病诊断和治疗监测非常重要。叶酸检测项目主要在大型医院开展,依靠国外大型仪器,成本昂贵,难以满足广大农村患者的需求。本文对国产的小型红细胞叶酸分析仪进行性能分析。通常一个检测系统应用到临床之前实验室必须对其进行性能验证[5-7],最主要的性能指标包括精密度、正确度、检测线性范围以及参考范围是否符合当地人群[8]。美国临床实验室标准化委员会(national committee for clinical laboratory,NCCLS)发布的EP5文件用于检验方法的精密度评价[9],EP9文件用于检验方法的比较和偏差估计[10],EP6文件用于线性范围评估[11]。本文按照以上文件设计实验,对仪器的精密度、正确度、线性范围和参考区间进行验证。
1 材料与方法
1.1 材料 YS-YS-5300型智能红细胞叶酸检测仪及配套的红细胞叶酸定量检测试剂(2个批号分别为20110512、20110820),BIO-RAD Immunoassay质控品(美国伯乐公司免疫质控品,中值批号:40232,高值批号:40233),Beckman Couter UniCel DxI800全自动免疫分析仪及配套的叶酸检测试剂(批号:117875),配套校准品(批号:110435),样品为以 EDTA-K2为抗凝剂的健康人抗凝血。严格按照试剂盒说明书及仪器实验参数设定操作程序进行操作。
1.2 方法
1.2.1 精密度性能评价 依据NCCLS EP5-A2文件规定,使用2个水平BIO-RAD叶酸质控品,每天分2批,每批实验同一浓度的质控物质做双份测定,2批的间隔时间大于2h,连续检测20d。每个浓度获得80个可接受数据。计算批内不精密度(CV批内、s批内)、批间不精密 度和实验室内总不精 密度 (s总,CV总);用χ2检验判断获得的重复性和室内精密度数据与生物学变异允许误差比较。
1.2.2 正确度实验 依据NCCLS颁布的EP9-A2文件取新鲜患者标本40例,浓度从低于参考范围到远高于参考范围,尽可能在分析测量范围内均匀分布。使用2种方法每天测8个样本,每个样本重复检测2次,共测定5d。样本测定时指定第1次的顺序,按照相反方向测定第2次,排列顺序时浓度尽可能随机排列。然后进行数据收集、统计学分析、方法内和方法间离群值检验,以2种方法数据均值和差值作图,通过散点图观察YS-YS-5300型智能红细胞叶酸检测仪和BeckmanDxI 800测定结果是否呈直线关系,并进行比较方法结果(X)的合适范围检验,用相关系数r估计,如果r≥0.975可以认为X取值范围合适,如果小于则需要更多的数据浓度分布范围,重新分析数据,如果无法扩大,则需采用分部残差法评价。计算给定的医学决定水平(Xc)处的预期偏倚(Bc)及Bc的95%可信区间。以允许总误差的1/2作为评价标准(红细胞叶酸的允许总误差为26.7%),当预期偏倚小于可接受的偏倚则认为可以接受。
1.2.3 线性范围评价试验 依据NCCLS EP 6-A方案选择浓度覆盖分析测量范围上、下限的高值样本(H)和低值样本(L),分别为1.65ng/mL和26.3ng/mL。将 H 和 L样本按照1.0L、0.8L+0.2H、0.6L+0.4H、0.4L+0.6H、0.2L+0.8H、1.0H各自配制混合,形成6个系列评价样本。在保证仪器校准和质控状态良好情况下随机测量,每个样本重复测定4次。利用多项式回归分析方法判断非线性(二阶和三阶方程式)回归系数与0比较,比较差异是否有统计学意义。如果差异无统计学意义,则认为检测系统呈线性(一阶方程式)。
1.2.4 参考区间的验证 参照NCCLS颁布的C28-A2文件中提供的方法[12],选择20例能够合理代表实验室所在区域健康总体的参考个体。检测以上个体红细胞叶酸水平,有不超过10%的观察值在原始报告的参考区间外则认为参考区间可以接受;如有3例以上超出界限,则重新选择20个参考个体,结果不超过2例(或10%)的观察值在原始报告的参考区间外,则也可以接受;再次有3例及以上超过给定的参考范围,需重新检查操作系统,如果操作没有问题,则认为该参考区间不适合于当地人群,需要重新建立参考区间。
2 结 果
2.1 精密度评价结果 见表1,批内变异系数(CV)小于基于生物学变异允许误差的1/4,批间CV小于允许误差的1/3,实验室变异小于允许误差的1/2;本实验进行了重复性和室内精密度χ2检验,计算的χ2值分别为21.64和27.42,小于55.8(自由度为40的95%上限临界值,通过查卡方界值表获得),结果也符合要求。
2.2 正确度评价结果
2.2.1 离群值检验 首先进行了 YS-YS-5300和 DxI800各自方法内离群值检验。计算每个方法重复测定平均差值绝对值,以该均值的4倍作为重复性测定的可接受限,结果方法内无离群值。计算YS-YS-5300和DxI800测定结果平均相对差值绝对值,以4倍平均绝对差值作为可接受限,2种方法测定结果差值没有超过可接受限的,则认为方法间无间离群值。

表1 YS-YS-5300型智能红细胞叶酸检测仪精密度结果(%)
2.2.2 数据作图 以2种方法检测的80对数据作图(图1)。图1中A的横坐标是DxI800仪器2次测定结果的均值,纵坐标是YS-YS-5300测定2次结果的均值;B的横坐标是DxI800仪器2次测定结果的均值,纵坐标是所有YS-YS-5300测定值(共80次);C的横坐标是DxI800测定值和 YS-YS-5300和测定值的总均值,纵坐标是DxI800仪器2次测定结果的均值与YS-YS-5300测定2次结果的均值之间的差值;D的横坐标是DxI800测定值和YS-YS-5300和测定值的总均值,纵坐标是DxI800与YS-YS-5300单次测定结果之间的差值。

图1 YS-YS-5300与DxI800结果比对分析图
2.2.3 X值合适范围检验结果 通过对2种方法测定的80对数据进行相关分析,计算相关系数r为0.8718,小于0.975,故不能用线性回归法计算预期偏倚,采用分步残差法分析。将数据按照X值(DxI800测定结果)递增的顺序分为3组,第1组和第2组均为26个数据,第3组为27个数据,用分步残差法计算每组数据的预期偏倚。
2.2.4 预期偏倚及可信区间计算 判断新生儿神经管畸形红细胞叶酸的医学决定水平是400ng/mL[6],生物学变异规定的允许误差是26.7%,以1/2允许总误差作为的偏倚的可接受水平,则在400ng/mL时允许的测定范围是346.6~453.4 ng/mL。用分步残差法计算医学决定水平处Bc的估计值为402.37ng/mL,Bc的95%可信区间为355.58~449.15ng/mL,小于生物学变异允许的范围,所以认为YS-YS-5300与DxI800测定结果相当。
2.3 线性范围评价结果 对6个系列评价样本分别检测4次后进行多项式回归分析,结果拟合的二次多项式系数b2和三次多项式模型系数b2和b3与0比较差异均无统计学意义,故判断检测系统呈线性(一阶方程式),见表2和图2。
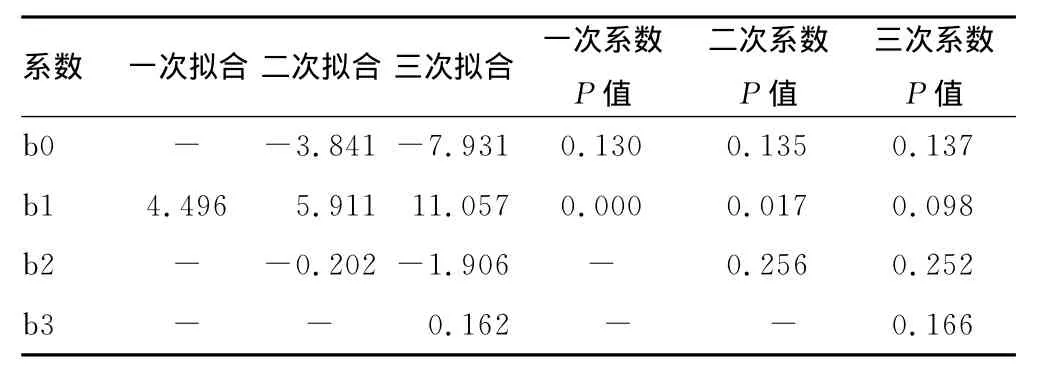
表2 拟合系数及拟合系数P值

图2 线性拟合线
2.4 参考区间验证结果 通过测量20例实验室选择的健康参考个体,其中有7例超过了仪器给定的参考区间(参考范围280~791ng/mL),重新选择20例能够代表健康整体的个体检测,仍然有9例超过参考区间,所以认为使用280~791ng/mL作为实验室参考范围是不合理的。
3 讨 论
检验医学是疾病诊断和病情评估的一个基础组成部分。随着医疗水平的不断提高,检验结果越来越多地被用于疾病的筛查、诊断、治疗监测及预后的判断,故检验结果的准确性直接影响到对疾病的判断。体内叶酸水平直接影响DNA合成,叶酸缺乏可导致巨幼细胞贫血、高同型半胱氨酸血症以及胎儿神经管畸形[13],故越来越多的检验科开展叶酸检测。红细胞叶酸不受短时间叶酸摄入情况的影响,故更能准确地反映体内叶酸的实际情况。
目前,国内外对于医学实验室质量管理要求主要是以美国临床实验室改进法案修正案(CLIA′88)、美国病理学家协会(CAP)的实验室认可计划以及国际标准化组织制定的标准ISO15189医学实验室认可为主。检测系统性能参数进行验证主要依照美国NCCLS颁布的EP文件。本研究参照NCCLS EP5-A2文件的精密度评价方案、EP9-A2文件的正确度验证方案和EP6-A文件的线性评价方案对国产的小型红细胞叶酸检测仪评价。精密度性能验证结果显示,测定中值、高值质控物批内CV均小于1/4生物学变异允许总误差(26.7%),批间CV小于1/3生物学变异允许总误差,实验室内CV小于1/2生物学变异允许总误差。说明该仪器精密度能够满足要求。
在正确度性能验证分析中,X合适范围检验结果r小于0.975,故未通过数据合适范围和均匀离散度检验,可能与本次实验选择高值样本较少有关。根据EP9-A2文件将数据分为3个部分,用分步残差法计算预期偏倚,结果在医学决定水平处预期偏倚的可信区间小于生物学变异允许的误差范围。故认为该仪器检测结果与Beckman DxI800封闭系统可比,正确度性能符合要求。利用EP6-A进行线性验证是利用多项式回归评价方法,首先假设数据点是非线性的,通过非线性多项式拟合数据,如果数据的最适合模型符合一次、二次和三次多项式,可得到回归方程,对非线性系数进行统计学分析。如果有统计学意义的非线性系数,则该组数据呈非线性,否则为线性。通过实验得出拟合的二次多项式系数b2和三次多项式模型系数b2和b3与0比较差异均无统计学意义,故判断该检测系统呈线性。
参考范围对于判断检测结果、生理状态、疾病预后等具有至关重要的作用,但往往受到多种因素的影响。本实验先后2次分别选用20例能够合理代表健康总体的参考个体对仪器给定的参考范围进行验证,结果2次均有大于3例的结果超出给定参考范围,故认为该范围不适合实验室当地的人群,需要重新建立参考范围。国内学者对婚检妇女营养的调查发现叶酸水平存在地区差异、城乡差异和季节差异[14]。美国在第3次全国健康与营养调查研究时,进行了叶酸水平与种族、文化程度等相关性的研究,结果发现叶酸水平存在明显的种族差异,膳食叶酸摄入量、生活习惯等可以影响体内叶酸水平[15]。可见叶酸水平受不同人群、饮食、生活习惯、地理位置和不同的实验方法等许多因素的影响;目前,中国大多数实验室叶酸参考范围均来源于国外试剂厂家说明书,其研究对象来源于国外人群,遗传背景、饮食及生活习惯明显不同于中国人群,用此参考范围往往难以做出正确的判断。所以,各地实验室应建立本地区的叶酸正常参考值范围。
[1] 陈志云,马绍钧.巨幼细胞贫血病:中文医学期刊临床报告资料综述及提示[J].临床血液学杂志,2012,25(7):421-424.
[2] 李海华,张丽伟,李小凤.高同型半胱氨酸血症与缺血性脑卒中相关性的研究进展[J].重庆医学,2012,41(5):500-502.
[3] 胡晓芳,安殿梅,袁笑,等.脑血管病患者高Hcy血症与叶酸和维生素B12的相关性研究[J].中国实验诊断学,2012,16(5):807-809.
[4] 高宝英,吴丽华,刘清.孕妇血清叶酸、同型半胱氨酸水平与胎儿神经管畸形危险性研究[J].中国生育健康杂志,2009,20(4):200-203.
[5] 冯仁丰.临床检验质量控制技术基础[M].上海:上海科学技术文献出版社,2007:129-130.
[6] 丛玉隆.临床实验室管理[M].北京:中国医药科技出版社,2004:48-50.
[7] 魏昊,丛玉隆.医学实验室质量管理与认可指南[M].北京:中国计量出版社,2004:72-75.
[8] 毕波,吕元.定量检测方法学性能验证的系统设计[J].中华检验医学杂志,2007,30(2):143-145.
[9] NCCLS.EP5-A2:Evaluation of precision performance of quantative measurement methods:approved guideline-second edition[S].Wayne,PA,NCCLS:2004.
[10]NCCLS.EP9-A2:Method comparison and bias estimation using patient samples:approved guideline-second edition[S].Wayne,PA,NCCLS:2002.
[11]NCCLS.EP6-A2:Evaluation of the linearity of quantitative measurement procedures:a statistical approach:approved guideline[S].Wayne,PA,NCCLS:2003.
[12]NCCLS.C28-A2:LHow to define and determine reference intervals in the clinical laboratory:approved guidelinesecond edition[S].Wayne,PA,NCCLS:2000.
[13]Bailey LB.Folate in health and disease[M].2Ed.Boca Raton,FL:CRC Press,2010,6:90-94.
[14]王华,李敏,吕莉,等.天津市新婚人群血清叶酸水平现况调查及正常参考值[J].中国妇幼保健,2011,26(30):4698-4702.
[15]Ford ES,Bowman BA.Serum and red blood cell folate concentrations,race,and education:findings from the third National Health and Nutrition Examination Survey[J].Am J Clin Nutr,1999,69(3):476-482.

