vp2基因特异miRNA对鸡传染性法氏囊病毒复制的抑制
王永娟, 左伟勇, 王安平, 吴 双, 朱善元
(江苏畜牧兽医职业技术学院/江苏省兽用生物制药高技术研究重点实验室,江苏 泰州 225300)
鸡传染性法氏囊病(Infectious bursal disease, IBD)是一种引起世界养禽业巨大经济损失的传染病,能导致鸡不同程度的病理变化、死亡和免疫抑制[1]。目前IBD的免疫主要通过疫苗进行,但由于活疫苗免疫能导致鸡法氏囊的凋亡和毒力增强而影响免疫效果[1-2],所以有必要开发防治IBD的新方法。作为一种新型抗病毒感染策略,RNA干扰(RNA interference,RNAi)具有许多独特的优点,已被众多学者用于病毒病研究,能抑制几乎所有属病毒的复制[3],因此具有十分诱人的应用前景。
VP2是鸡传染性法氏囊病毒(Infectious bursal disease virus,IBDV)的主要结构蛋白质,在病毒包装、细胞吸附、免疫应答过程中都起重要作用[4-6],所以目前疫苗相关的研究主要针对VP2蛋白质。miRNA作为一种小RNA已被证实能抑制病毒基因的表达[7-8]。本研究在前期研究[7]基础上,研究 vp2基因特异miRNA在抗性筛选之后对于病毒基因转录子及病毒滴度的影响,为RNAi技术在IBD防治中的应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂与仪器 各种酶、DNA Marker购自大连宝生物公司;Wizard DNA Clean-up System购自Promega公司;常规生化试剂均为国产分析纯;DMEM培养基购自GIBCO公司;Trizol为北京鼎国公司产品;PEI、G418购自Sigma公司;MMLV反转录试剂盒购自BBI公司。倒置显微镜为德国Leica公司产品。
1.1.2 主要生物材料 pTarget载体购自大连宝生物公司;pRFPRNAiC购自英国Das R M教授;大肠杆菌感受态细胞DH5α由本室保存;DF-1细胞系(ATCC CRL-12203)、pCR-AAAV 载体、pRFPRNA-iVP2A、pRFPRNAiVP2E、pRFPRNA iVP2con 由本实验室保存;IBDV Lurkert株由孙怀昌教授提供。
1.2 miRNA双表达载体的构建
根据pRFPRNAiC[1]中第二发夹设计要求合成通用引物及miVP2E表达引物(表1)。在通用引物两端分别引入Mlu I和 Sph I位点,在已有pRFPRNAiVP2A 的基础上[7]参考文献[9]的方法获得双表达载体pRFPRNAiVP2AE。

表1 本研究所用引物Table 1 Primers used in this study
1.3 miRNA抗性选择载体构建
以PCR法扩增pTarget质粒载体的多克隆位点,经两端引入的PmlⅠ和BsmBⅠ双酶切后,与 pCRAAAV载体相连获得pAITR-MCS2;pTarget质粒经BglⅡ和Not I双酶切后自连获得新载体pT;EcoRⅠ酶切pAITR-MCS2与pT,分别回收含ITR和MCS2的片段与pT片段,最终获得抗性选择载体pTITR。
用Sal I和 BamH I双酶切 pRFPRNAiVP2A、pRFPRNAiVP2E及 pRFPRNAiVP2AE,将 miRNA表达盒连同RFP表达盒从pRFPRNAiC载体切出,分别插入同样酶切的pTITR载体,获得pTITR-miVP2A和 pTITR-miVP2E、pTITR-miVP2AE,同时设 pTITR-miVP2con对照。
1.4 DF-1细胞抗G418最小致死量确定
按每孔104个DF-1细胞接种96孔板,培养24 h后,分 别 用 终 浓 度 为 0 μg/ml、100 μg/ml、200 μg/ml、300 μg/ml、400 μg/ml、500 μg/ml、600 μg/ml、700 μg/ml、800 μg/ml、900 μg/ml、1 000 μg/ml的G418培养液培养,每3 d换液1次,以细胞最先全部死亡孔的G418浓度为最低致死剂量。
1.5 抗性细胞筛选
将DF-1细胞以每瓶2×106个的密度接种25 cm2培养瓶,培养至细胞密度为70%时吸弃培养液。分别取 4 μg pTITR-miVP2A、pTITR-miVP2E、pTITR-miVP2AE及pTITR-miVP2con按照文献[10]方法进行细胞转染,每个样做4个重复。转染后24 h,以含最低致死剂量G418的DMEM完全培养液培养,每3 d换液1次,1周后进行病毒感染。
1.6 有效miRNA的表达检测
在转染后48 h,Trizol法提取细胞总 RNA,用RT-PCR检测转染细胞中miRNA的表达。
1.7 病毒感染
在抗性标记miRNA表达载体转染和G418筛选后约1周,至在荧光显微镜中观察到细胞基本均为RFP阳性细胞为止,按照常规胰酶消化法分散细胞,以每孔105个的密度分别接种24孔板,用IBDV Lukert株的DF-1细胞适应病毒感染(n=3),分别用0.001、0.010、0.100 个 TCID50的病毒量,吸附 2 h 后弃病毒液,换为含1% 新生牛血清的DMEM维持液。
1.8 miRNA抑制效率检测
1.8.1 病毒滴度测定 参考文献报道的有限稀释法[11],在病毒感染后 48 h 时吸取 100 μl细胞上清液进行IBDV TCID50测定,以空载体转染、IBDV单独感染细胞为对照,计算有效miVP2对IBDV复制的抑制作用。
1.8.2 vp2基因RT-PCR检测 按照文献报道的方法[12]在病毒感染48 h后提取病毒基因组,然后以Oligo(dT)18为引物进行RT反应。以β-actin基因为内参进行vp2基因转录子的半定量RT-PCR检测。vp2扩增条件参照文献[7]进行,内参引物序列见表1,21个循环扩增程序为94℃ 45 s(第1个循环为4 min),52℃ 40 s,72℃ 40 s(最后 1个循环10 min)。PCR结束后,各取5 μl产物进行1.0%琼脂糖凝胶电泳,EB染色后用ND-1000分光光度计对各条带进行灰度扫描,并计算vp2与内参扩增产物的比例。
2 结果
2.1 miRNA双表达载体的构建与鉴定
利用DNA重组技术,根据pRFPRNAiC的表达要求,获得vp2基因特异的miRNA表达载体pRFPRNAmiVP2AE,其双酶切(BamH I、Kpn I)鉴定结果见图1,pRFPRNAiVP2AE可以切出约370 bp的条带,而pRFPRNAiVP2A对照只切出270 bp的条带。

图1 pRFPRNAiVP2AE的酶切鉴定Fig.1 Identification of pRFPRNAiVP2AE by restriction enzyme
2.2 miRNA抗性选择载体构建与鉴定
利用DNA重组技术,将构建好的miRNA单表达或双表达载体与经过改造的含neo基因的miRNA表达载体pTITR(图2)重组,获得可用于G418筛选的 miRNA 表达载体 pTITR-miVP2A、E、con、AE,以pTITR-miVP2A为例的酶切鉴定结果见图3。

图2 pTITR的酶切鉴定Fig.2 Identification of pTITR by restriction enzyme
2.3 有效miRNA的表达检测
为确定基因或病毒的抑制作用确实由表达的miRNA所产生,在miRNA表达载体转染后48 h,提取各孔细胞总RNA,DNase I消化后,以构建miRNA的通用正、反向引物进行RT-PCR检测,可见预期的150 bp左右特异条带,而未转染组则无此条带(图4)。
2.4 稳定表达miRNA对IBDV复制的抑制效果
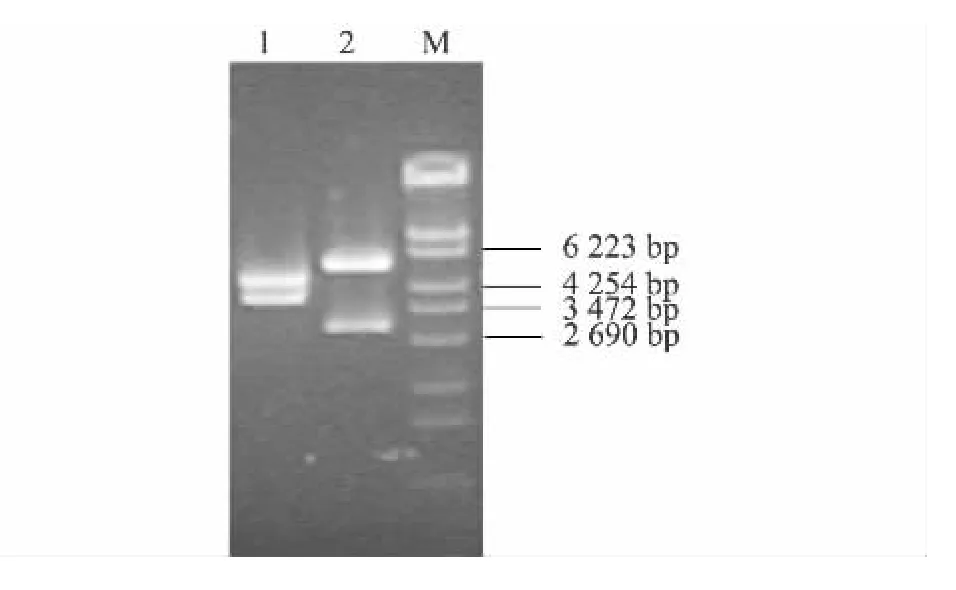
图3 pTITR-miVP2A的酶切鉴定Fig.3 Identification of pTITR-miVP2A by restriction enzyme

图4 DF-1中有效miRNA的表达检测Fig.4 Detection of miRNA expression in vector-transfected DF-1cells
将miRNA抗性选择载体转染DF-1细胞,后经最小致死剂量G418(400 μg/ml)筛选1周、感染不同剂量IBDV后48 h,测得miRNA表达阳性组的病毒TCID50在空白对照组pRFPRNAmivp2con之间无明显差异,而与pTITR-miVP2A、pTITR-miVP2E和pTITR-miVP2AE转染组有明显差异,分别下降6lg2、5lg2和6lg2。不同感染剂量的病毒复制抑制效果无明显差异,0.1个TCID50的病毒抑制效果见图5。
2.5 稳定表达miRNA对vp2转录子的抑制效果
提取病毒感染48 h后的细胞总RNA,在同等条件下以β-actin为内参进行vp2的半定量RT-PCR检测。RT-PCR产物经1.0%琼脂糖凝胶电泳分离和EB染色后,对目的条带进行灰度扫描,3次独立试验的平均值见图6。从图6中也可以看到,与空白对照组和pRFPRNAmivp2con转染组相比,pTITR-miVP2A、pTITR-miVP2E和pTITR-miVP2AE转染细胞的vp2基因表达抑制率分别为80.7%、77.5%和75.0%。
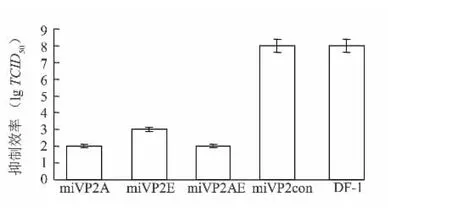
图5 TCID50法测定miRNA对病毒复制的抑制效果Fig.5 The inhibitory effect of miRNA on viral replication revealed by TCID50
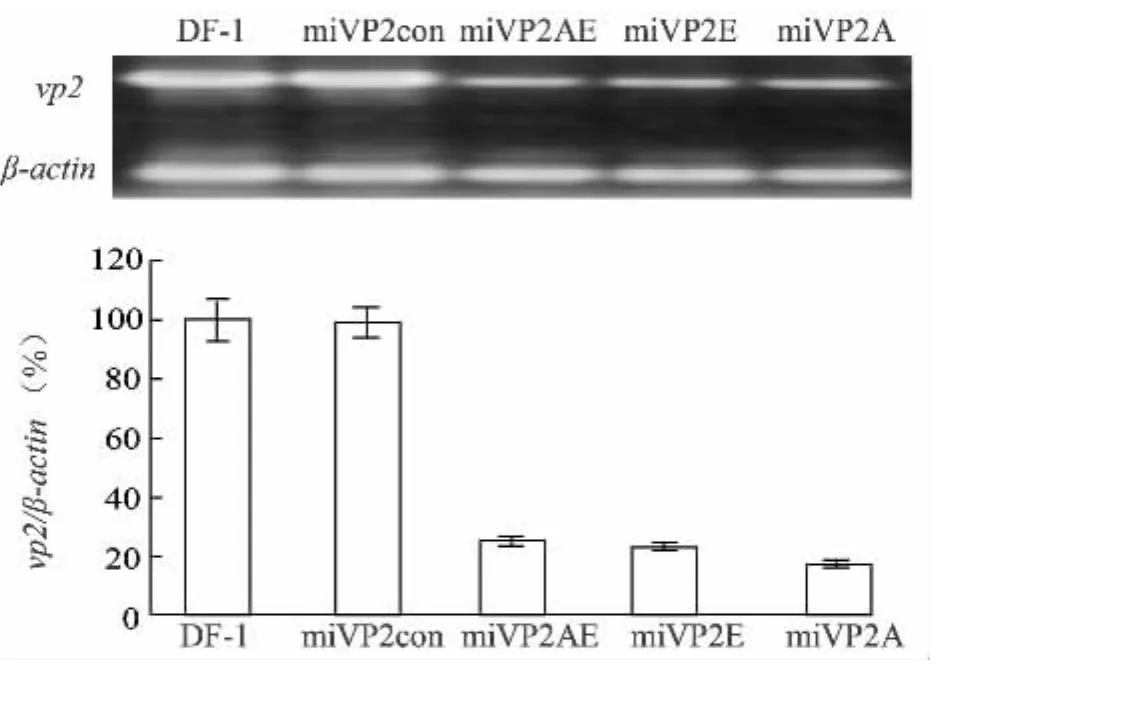
图6 半定量RT-PCR测定miRNA对vp2基因表达的抑制效果Fig.6 The inhibitory effect on vp2 gene expression delivered by miRNA detected by semi-quantitative RT-PCR
3 讨论
本试验在前期研究的基础上构建了抗性标记miRNA表达载体pTITR载体,可供vp2基因特异miRNA的表达筛选以获得稳定整合细胞克隆。试验结果表明,效果最明显的miVP2A的vp2基因表达沉默效果为80.7%,可使病毒TCID50下降5~6lg2,而含4个碱基错配的对照miVP2con无明显的抑制作用,这一试验结果不仅说明前期筛选到的2个vp2基因特异miRNA在筛选过的细胞系中均能有效抑制病毒复制,为RNAi技术在IBD防治中的进一步用应用奠定了基础,而且证实了miRNA基因沉默作用的序列特异性,排除由双链RNA诱导的干扰素作用的可能性。
从对病毒基因的抑制效率看,抑制效率在75%以上,即使在最优化条件下,细胞的基因转染效率也难以达到如此高的水平,这提示转染细胞表达的miRNA存在跨细胞传递的可能性[13]。然而,不管是之前非抗性标记miRNA表达载体与报告载体的共转染[7],还是本试验所用抗性筛选获得的稳定转染细胞进行研究,vp2基因表达和病毒复制抑制率均未达到完全抑制,其原因可能有:(1)就目前的RNAi技术而言,很难实现100%的抑制,这方面的报道很多,例如,用本研究所用的RNAi载体系统、以GFP或LacZ为报告基因的研究结果显示,基因表达抑制效率为90%左右[9];(2)通过筛选更多的靶序列,有可能获得抑制效果更佳的siRNA或miRNA,值得今后进一步研究;(3)VP2为主要结构蛋白质,约占病毒结构蛋白质的50%,提示vp2基因的转录水平高,即使细胞内有足够量siRNA的存在,也可能难以完全阻止部分VP2转录产物的翻译。因此,选择转录水平较低的基因(如vp1)为干扰靶序列,有可能进一步提高基因沉默效果,但已有报道显示,以vp1作为干扰IBDV复制的靶序列,抑制效率也仅为90%左右[8]。
本研究所用的载体主要是pTITR和pRFPRNAiC,pTITR这一载体带有禽腺联病毒(AAAV)末端反向重组序列(ITR),可用于后续重组AAAV的构建。pRFPRNAiC能同时表达针对相同或不同基因的2个miRNA,在理论上,不仅可增强基因沉默效果,而且能在一定程度上避免因病毒变异而引起的干扰作用逃脱。为了证明这一观点,本研究将2个有效的miRNA同时克隆入表达载体,并在IBDV感染之前对其转染细胞用G418筛选。半定量和病毒滴度测定结果显示,miRNA双表达载体转染组的抑制率略低于单表达组,其可能原因是过量表达的miRNA使RISC处于饱和状态,miVP2A与miVP2E竞争与RISC结合,这一观点与其他学者所提出的提高siRNA的剂量反而导致抑制效率下降[14-16]理论相吻合。另有研究资料表明,高剂量siRNA有可能诱导一系列未知酶的表达,从而限制或完全降解siRNA[15]。这些研究资料提示,在进行RNAi研究时,同样需要对siRNA表达水平等试验条件进行优化,以获得最佳的抑制效果。
[1]SHARMA J M,KIM I J,RAUTENSCHLEIN S,et al.Infectious bursal disease virus of chickens:pathogenesis and immunosuppression[J].Dev Comp Immunol,2000,24:223-235.
[2]SNYDER D B.Changes in the field status of infectious bursal disease virus[J].Avian Pathol,1990,19:419-423.
[3]MARTINEAU H M.Invited review:review of the application of RNA interference technology in the pharmaceutical industry[J].Toxicologic Pathology,2007,3:327-336.
[4]BÖTTCHER B,KISELEV N A,MASHCHUK V Y.Three-dimensional structure of infectious bursal disease virus determined by electron cryomicroscopy[J].J Virol,1997,71:325-330.
[5]CASTON J R,MARTINEZ J L,LOMBARDO E.C-terminus of infectious bursal disease virus major capsid protein VP2 is involved in definition of the T number for capsid assembly[J].J Virol,2001,75:10815-10828.
[6]BECHT H,MÜLLER H,MÜLLER H K.Antigenic structure of the two serotypes of infectious bursal disease virus[J].J Gen Virol,1998,69:631-640.
[7]王永娟,崔平福,孙怀昌.靶向IBDV VP2有效miRNA的筛选[J]. 江苏农业学报,2010,26(6):1270-1276.
[8]GAO Y,LIU W,GAO H,et al.Effective inhibition of infectious bursal disease virus replication in vitro by DNA vector-based RNA interference[J].Antiviral Res,2008,79(2):87-94.
[9]DAS R M,VAN HATEREN N J,HOWELL G R,et a.l A robust system for RNA interference in the chicken using a modified microRNA operon[J].Developm ental B iology,2006,294:554-563.
[10]DUROCHER Y,PERRET S,KAMEN A.High-level and highthroughout recombinant protein production by transient transfection of suspension-growing human 293-EBNA1 cells[J].Nucleic Acids Research,2002,30(9):113-119.
[11]殷 震,刘景华.动物病毒学[M].北京:科学出版社,1985.
[12]CHEN P Y,LU C H.Purification of dsRNA from infectious bursal disease virus[J].Journal of Nanjing Agricultural University,1996,19:73-76.
[13]RAUSCH O.High content cellular screening[J].Curr Opin Chem Biol,2006,10(4):316-320.
[14]GILADI H,KETZINEL-GILAD M,RIVKIN L.Small interfering RNA inhibits hepatitis B virus replication in mice[J].Mol Ther,2003,8:769-876.
[15]HONG J,QIAN Z,SHEN S.High doses of siRNAs induce eri-1 and adar-1 gene expression and reduce the efficiency of RNA interference in the mouse[J].Biochem,2005,390:675-679.
[16]PENG J,ZHAO Y,MAI J.Inhibition of hepatitis B virus replication by various RNAi constructs and their pharmacodynamic properties[J].Virol,2005,86:3227-3234.

