白腐菌对水葫芦木质纤维素的降解及对厌氧发酵的影响
范晓娟, 朱红梅, 韩士群, 周 庆, 杨天元, 王世梅
(1.南京农业大学资源与环境科学学院,江苏 南京 210095;2.苏州市吴江区松陵镇农业服务中心,江苏 苏州 215200;3.江苏省农业科学院农业资源与环境研究所,江苏 南京 210014)
随着水体富营养化问题越来越严重,采用水葫芦等水生植物消减水体氮、磷等富营养化物质成为改善水质的重要措施,但大量水葫芦若堆积又会产生二次污染,亟需进行资源化利用。现有水葫芦资源化利用方式中,较为普遍的是将其与其他物料如污水塘底泥、动物粪便等混合进行好氧或厌氧堆制,产生沼气及制得有机肥[1-5]或制成动物饲料[6-7]。近年来,由于能源危机日益加剧,水葫芦等水生植物作为生物质能利用的研究逐渐引起科技工作者们的兴趣。
水葫芦有较高的可发酵物质,具有较强的产沼气潜力[8-9],但其木质纤维素的结构和含量是生产沼气的瓶颈[9-10]。木质纤维素主要由纤维素、半纤维素和木质素组成,而降解木质纤维素的关键是去除木质素[11-12]。为了提高沼气产率,需要对水葫芦进行一定的预处理。目前国内外学者也已对水葫芦发酵的预处理做了大量研究,如Moorhead等[8]认为适当的水葫芦粒径可以提高沼气总产量以及甲烷产量;Patel等[13]发现利用热化学方法将水葫芦预处理后厌氧发酵可以提高沼气产量;陈晓晔等[14]的研究表明一定浓度的硫酸预处理可以提高水葫芦的甲烷产量且缩短系统启动期。上述预处理大多采用物理、化学方法,而关于微生物预处理水葫芦的研究不多。
白腐真菌是对木质素具有最强降解能力的一类真菌,经其转化后的稻草基质用于沼气生产时,其纤维素酶的释放能力比原稻草要高4.3倍[15]。从理论上讲,利用白腐菌生物预先降解木质纤维素含量较高的秸秆,以提高随后的厌氧消化产气率是可行的。Ghost[16]等研究发现白腐菌黄孢原毛平革菌菌丝体4 d后表现出巨大的木质素降解能力,3周后其菌丝体对秸秆木质素的降解率为47.51%,稻秸的生物气和甲烷产量分别提高了34.73%和46.19%。本研究将采用白腐真菌的黄孢原毛平革菌和糙皮侧耳,分别对水葫芦木质纤维素进行降解预处理,并研究其对厌氧发酵产沼气的影响,探求水葫芦高效产沼气的方法。
1 材料与方法
1.1 材料
水葫芦:江苏省农业科学院2号塘,洗净,风干,总固体含量(TS)为91.45%。
菌种:黄孢原毛平革菌(Phanerochaete chrysosporium),购于中国工业微生物菌种保藏中心;糙皮侧耳(Pleurotus ostreatus),由本实验室留存。
基础培养液:KH2PO40.20 g/L,MgSO4·7H2O 0.05 g/L,CaCl20.01 g/L和1 ml/L无机盐溶液,维生素B1100 mg/L,吐温-80 0.05%[17]。无机盐溶液为0.50 g/L MnSO4·H2O,0.01 g/L AlK(SO4)2·12H2O,0.01 g/L H3BO3,0.01 g/L Na2MoO4· 2H2O,0.10 g/L FeSO4·7H2O,0.10g/L CoCl2· 6H2O,0.10 g/L ZnSO4·7H2O,0.01 g/L CuSO4· 5H2O,3.00 g/L MgSO4·7H2O[18]。
厌氧消化试验所用沼液总固体(TS)含量为2.16%,挥发性固体(VS)为56.55%,pH为8.34。
1.2 方法
1.2.1 水葫芦木质纤维素的降解试验 将黄孢原毛平革菌和糙皮侧耳分别在30℃和28℃温度下活化,150 r/min转速摇床培养7 d后,用灭菌滤纸过滤,灭菌水冲洗3次,至滤纸不再滴水。
称取自然风干、粉碎过20目筛的水葫芦40 g于1 000 ml锥形瓶中,按固液比1∶2加入基础培养液,自然pH,加水调节含水率至75%,封口后于120℃下灭菌30 min。冷却至室温后以20%的接种量(以湿重计)接种上述过滤得到的菌体,接种后放入恒温恒湿培养箱,调节湿度75%,分别在30℃和28 ℃温度下培养,分别于5 d、10 d、15 d、20 d、25 d、30 d取样,测定纤维素、半纤维素、木质素等指标。每个处理设3个重复。
1.2.2 降解产物的厌氧发酵试验 试验所用发酵装置为自制简易装置,见图1。发酵瓶为1 L的广口瓶,瓶口改用胶塞,胶塞上有两孔,插入玻璃管后用橡胶管连接,分别为取样口和导气口,发酵罐与集气瓶之间的导气管连接一个取气装置。气体收集瓶为1 L,采用排水法收集气体,通过测量排出水的体积获得沼气产量。
采用湿发酵方法:取TS为39.36 g预处理10 d、15 d、25 d后发酵原料(湿料),加入接种沼液400 g(TS为2.16%),加水将发酵物总质量调整至600 g,此时发酵罐里的TS负荷均为8%。密封后,于35±1℃下进行厌氧发酵。对照处理为不加菌体的原料,同时设置只添加厌氧消化沼液不添加发酵材料的沼液对照,以扣除接种沼液本身产气量。每个处理做2个重复,具体试验设计如表1。

图1 厌氧发酵装置结构示意图Fig.1 Schematic map of anaerobic digestion equipment
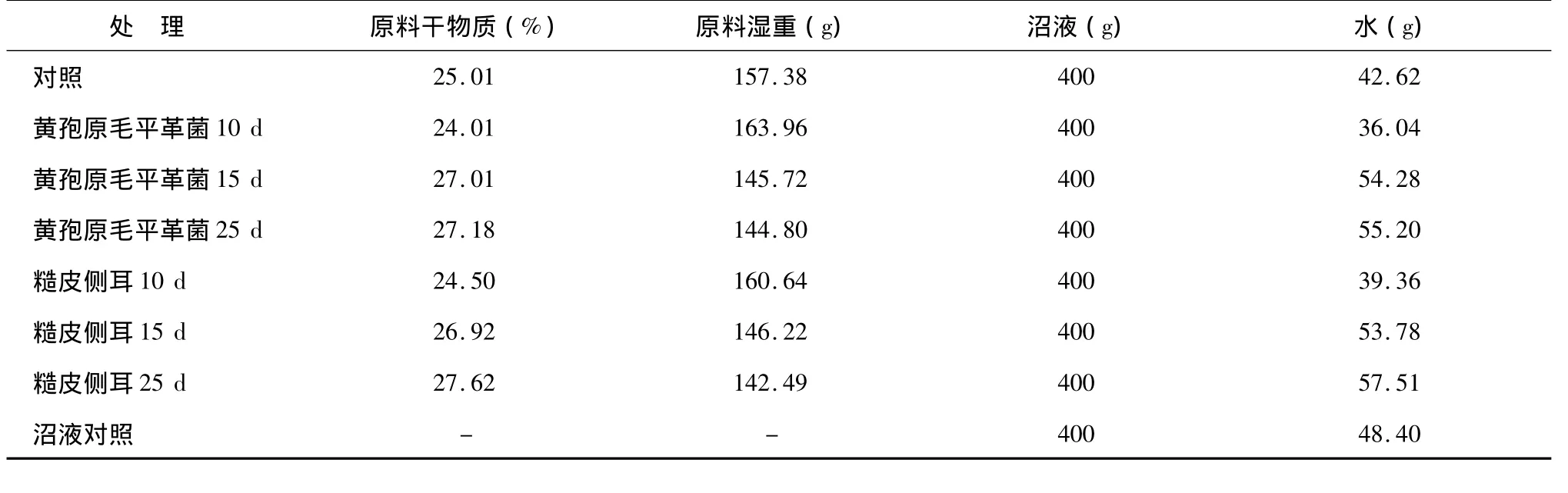
表1 厌氧发酵试验设计Table 1 Design of the anaerobic digestion experiment
1.2.3 测定项目及方法 采用范氏法(Van Soest)[19]测定纤维素、半纤维素和木质素;以排水集气法收集气体,每日测定产气量;采用GC-9890A气相色谱仪分析沼气中甲烷含量(TCD检测器);干物质的测定采用105℃烘24 h差重法;pH值采用雷磁pHS-2F型酸度计测定;挥发性脂肪酸(VFA)的测定采用比色法。
1.2.4 数据整理与统计 所有数据均扣除空白对照样后进行后续处理与分析。数据均用Sigma-Plot10、SPSS13.0软件进行处理和统计分析。
2 结果
2.1 降解过程中水葫芦木质纤维素含量的变化
由图2可见,黄孢原毛平革菌和糙皮侧耳两种白腐菌对木质素、纤维素、半纤维素均有不同程度的降解,对木质素的降解较为明显,接种30 d后,木质素含量分别降到6.93%、8.36%,降解率分别为39.42%和26.92%。两种白腐菌均在接种第10 d就对木质素有较强的降解效果。木质素、纤维素、半纤维素的降解率均随处理时间延长而增加,30 d后两菌对纤维素的降解率分别为15.39%、13.44%;对半纤维素的降解率分别为16.77%、14.42%。
2.2 水葫芦厌氧发酵的产酸特征
各处理在反应过程中pH值和挥发性脂肪酸的浓度有着相反的变化趋势(图3),挥发性脂肪酸浓度升高时pH值下降。水葫芦厌氧发酵酸化速度很快,各处理的pH值均在第2 d就达到最低值,黄孢原毛平革菌预处理10 d、15 d、25 d各组的最低值分别为7.40、7.56、7.31,糙皮侧耳预处理10 d、15 d、25 d 各组的最低值分别为 7.14、7.15、7.39,对照组的最低值为7.22。各处理组的pH在达到最低值后随即开始回升,第5 d至第30 d稳定在一定范围内,随后显著下降。相应的,各处理的挥发性脂肪酸浓度在发酵第2 d达到最高,其中黄孢原毛平革菌预处理10 d、15 d、25 d各组的挥发性脂肪酸最高浓度分别为1 010.15 mg/L、1 446.70 mg/L、936.55 mg/L,由糙皮侧耳预处理10 d、15 d、25 d的挥发性脂肪酸最高浓度分别为1 524.11 mg/L、1 366.75 mg/L、1 120.56 mg/L,对照组的挥发性脂肪酸最高浓度为2 395.94 mg/L。各处理组的挥发性脂肪酸浓度达到最高值后开始下降,在第7 d达到一个较低的稳定值,而对照组在第11d才达到较低稳定值,并持续到发酵结束。以对照为例,统计分析得,挥发性脂肪酸浓度与pH值呈极显著负相关(r=-0.840**,P<0.01),表明水葫芦水解产生的有机酸是造成发酵液中pH值下降的最重要原因。

图2 降解过程中木质纤维素含量的变化Fig.2 The variation of lignocellulose content in the process of degradation

图3 厌氧发酵中发酵液pH值和挥发性脂肪酸浓度的变化Fig.3 Changes of pH values and valotile fatty acid contents during anaerobic digestion of water hyacinth
2.3 水葫芦厌氧发酵的产气特征
2.3.1 日产气量 从图4a、4b可见,各处理厌氧反应期间的日产气量变化趋势大致相同,均在3~5 d达到第1个产气最高峰,然后下降并且持续一段时间后在25~27 d达到第2个产气高峰,此后一直维持在一个较低的产气量水平,直至发酵结束;水葫芦发酵的启动时间较快,发酵第1 d就达到一个较高的产气量。由糙皮侧耳处理了10 d、15 d的两组和对照组在发酵第2 d日产气量骤降,1~2 d后就迅速回升,达到一个产气高峰(图4b),而由黄孢原毛平革菌处理的各组日产气量在第2 d并没有出现下降现象而是持续增加至第1个产气高峰(图4a)。

图4 水葫芦厌氧发酵过程中日产气量的变化Fig.4 Daily biogas production during anaerobic digestion of water hyacinth
2.3.2 累积产气量 对各处理在厌氧反应期间的产气进行累积计算,结果见图5。图5显示,对照组在28 d就停止了产气,而两菌10 d和15 d的处理组则继续产气直至发酵结束。由黄孢原毛平革菌预处理10 d、15 d,累积产气量分别较对照提高了48.72%、59.11%(图5a);经糙皮侧耳处理10 d、15 d的累积产气量分别较对照提高了70.96%、75.05%(图5b)。而由黄孢原毛平革菌预处理25 d和由糙皮侧耳预处理25 d的两组累积产气量分别下降了13.31%和76.54%。

图5 水葫芦厌氧发酵中累积产气量的变化Fig.5 Accumulative biogas production during anaerobic digestion of water hyacinth
2.3.3 甲烷含量 从图6可见,各处理甲烷含量的变化趋势大体一致:在发酵前4 d,甲烷含量呈直线趋势迅速上升,第5 d、第6 d继续缓慢上升达到各自的一个较稳定的值,此后甲烷含量变化不大并维持较长一段时间,发酵进行到25 d后,各处理组及对照组的甲烷含量稍有下降。第6 d时,由黄孢原毛平革菌分别预处理10 d、15 d、25 d的3组甲烷含量分别为50.63%、55.16%、51.47%(图6a);由糙皮侧耳分别预处理10 d、15 d、25 d的3组甲烷含量分别为56.85%、55.47%、54.57%(图6b),而对照组的甲烷含量为59.87%。统计分析结果显示,黄孢原毛平革菌各处理组和糙皮侧耳多处理组的甲烷含量与对照组的甲烷含量无显著性差异(P>0.05)。

图6 水葫芦厌氧发酵所产沼气中甲烷含量的变化Fig.6 Dynamics of methane content during anaerobic digestion of water hyacinth
2.3.4 单位TS产气量和单位TS甲烷产量 从表2可见,由黄孢原毛平革菌预处理10 d、15 d,水葫芦单位TS产气量分别较对照提高48.73%、59.11%;由糙皮侧耳处理10 d、15 d,水葫芦单位TS产气量分别较对照提高70.96%、75.05%。处理25 d时黄孢原毛平革菌和糙皮侧耳两组的单位TS产气量反而分别下降了13.31%、76.55%。对于单位TS甲烷产量,由黄孢原毛平革菌预处理10 d、15 d,TS甲烷产量较对照分别提高了30.53%、35.44%;由糙皮侧耳处理10 d、15 d,TS甲烷产量较对照分别提高了54.28%、55.81%。处理25 d时,黄孢原毛平革菌和糙皮侧耳两组单位TS甲烷产量分别下降了21.80%和77.33%(表2)。

表2 水葫芦的产气情况Table 2 Gas production during anaerobic digestion of water hyacinth
3 讨论
3.1 白腐菌对木质纤维素的降解效果
由于纤维素易与半纤维素、木质素等难分解的物质相复合,利用纤维素之前,必须把它从木质素和半纤维素包裹中释放出来,而半纤维素比木质素易降解,因此,纤维素的分解关键就在于木质素的降解[12]。杭怡琼等[20]用稻草秸秆作基质接种不同白腐菌株,白腐菌对木质素的降解率平均可达37.76%。本试验中,接种30 d,黄孢原毛平革菌和糙皮侧耳对木质素的降解率分别为39.42%和26.92%,与稻草木质素降解效果相近。同时纤维素和半纤维素也有不同程度的降解,接种30 d,黄孢原毛平革菌对水葫芦纤维素、半纤维素的降解率分别为15.39%、16.77%,糙皮侧耳对其纤维素、半纤维素的降解率分别为13.44%,14.42%,而赵华等[21]用白腐菌在固态培养条件培养25 d后对稻草秸秆中纤维素、半纤维素的降解率分别为25.10%和29.80%,水葫芦的纤维素、半纤维素降解率低于稻草。
3.2 水葫芦厌氧发酵过程的产酸特性
挥发性脂肪酸是厌氧消化过程中极为重要的一个中间产物,也是最重要的产甲烷前体物质,在发酵过程中,对挥发性脂肪酸和pH值的监控对于系统的正常运行及较高的沼气质量都是非常重要的。统计分析得,各处理组与对照组的挥发性脂肪酸含量无显著性差异(F=0.549,P=0.769)。对挥发性脂肪酸含量与产气量进一步分析,挥发性脂肪酸的高峰值出现在产气量增加的前期,这是由于有机酸的大量积累造成pH值降低,从而影响了产甲烷菌的活性,但与此同时,挥发性脂肪酸的积累也为甲烷菌生长繁殖提供了大量的物质来源,随着产甲烷菌活性逐步增加,有机酸底物随后被甲烷菌充分利用后形成了产气高峰[22]。统计分析可知,由糙皮侧耳处理10 d、15 d的两组挥发性脂肪酸含量与日产气量均呈显著正相关(r=0.703*,P<0.05;r=0.679*,P<0.05);其他处理的挥发性脂肪酸含量与日产气量相关性不显著(P>0.05)。
3.3 白腐菌对水葫芦的降解预处理对产气特性的影响
经白腐菌处理10 d、15 d后,水葫芦中难降解的木质素、纤维素等均有所降解,从而提高了发酵材料的利用率。采用相关分析,单位TS产气量与木质素含量呈显著负相关(r=-0.957*,P<0.05),与纤维素含量呈显著负相关(r=-0.906*,P<0.05),与半纤维素含量相关性不显著(r=-0.724,P>0.05)。而经白腐菌预处理25 d,木质素、纤维素虽然进一步降解,但单位TS产气量反而降低,可能是白腐菌预处理的时间过长,微生物本身生理活动消耗了一定的产沼气底物。因此,生产上要控制合适的预处理时间。
对整个发酵过程中各处理组和对照组的甲烷含量做统计分析,由黄孢原毛平革菌和糙皮侧耳预处理10 d、15 d、25 d的甲烷含量与对照组的甲烷含量无显著性差异;将木质素、纤维素、半纤维素含量分别与平均甲烷含量做相关分析可知,平均甲烷含量与木质素、纤维素、半纤维素含量相关性均不显著。推测,白腐菌的降解处理对甲烷含量没有明显的促进作用。
对于单位TS甲烷产量,两菌分别处理10 d、15 d单位TS甲烷产量较对照组均有显著提高,而处理25 d后,黄孢原毛平革菌和糙皮侧耳两组单位TS甲烷产量较对照显著降低。说明用黄孢原毛平革菌或糙皮侧耳对水葫芦进行降解处理后,用于厌氧发酵产沼气是可行的,但预处理时间不宜过长,生产上要控制合适的预处理时间。
[1]PARVEEN S,FEROZA B,HOSSAIN M,et al.Production of biogas from cow dung by adding water hyacinth and mud[J].Bangladesh J Sci Ind Res,1998,33(3):369-372.
[2]KUMAR S.Studies on efficiencies of biogas production in anaerobic digestion using water hyacinth and night-soil alone as well as in combination[J].Asian Journal of Chemistry,2005.
[3]EL-SHINNAWI M M,ALAAEL-DIN M N,EL-SHIMI S A.Biogas production from crop residues and aquatic weeds[J].Resources Conservation and Recycling,1989,3(1):33-45.
[4]周岳溪,孔 欣,郝丽芳,等.水葫芦加动物排泄物两相厌氧生物处置工艺[J].环境科学研究,1996,9(6):6-10.
[5]黄东风,李清华,陈 超.水葫芦有机肥料的研制与应用效果[J].中国土壤与肥料,2007(5):48-51.
[6]国家海洋局第三海洋研究所.利用新技术将水葫芦变成新的饲料来源[J].福建农业科技,2005(2):60.
[7]白云峰,周卫星,严少华,等.水葫芦青贮饲喂羊的育肥效果[J].江苏农业学报,2010,26(5):1108—1110.
[8]MOORHEAD K K,N0RDSTEDT R A.Batch an aerobic digestion of water hyacinth:effects of particle size,plant nitrogen content and inoculum volume[J].Bioresource Technology,1993,44(1):71-76.
[9]CHANAKYA H N,BORGAONKAR S,MEENA G,et a1.Solid phase biogas production with garbage or water hyacinth[J].Biore—source Technology,1993,46(3):227-231.
[10]陈广银,郑 正,邹星星.水葫芦能源化利用研究进展[J].江苏农业科学,2008(3):5-9.
[11]王宏勋,杜甫佑,张晓昱.白腐菌选择性降解秸秆木质纤维素研究[J].华中科技大学学报:自然科学版,2006,34(3):97-100.
[12]林云琴,周少奇.白腐菌降解纤维素和木质素的研究进展[J].环境技术,2003(4):29-33.
[13]PATEL V,DESAI M,MADAMWAR D.Thermochemical pretreatment of water hyacinth for improved biomethanation[J].Applied Biochemistry and Biotechnology,1993,42:67-74.
[14]陈晓哗,邱哗平,朱建良.水葫芦和餐厨垃圾半连续厌氧发酵产甲烷研究[C]//袁竹林,金保升.可再生能源规模化发展国际研讨会暨第三届泛长三角能源科技论坛论文集.南京:江苏科学技术学会,2006:336-339.
[15]METHA V,GUPTA J K,KAUSHAL S C.Cultivation of Pleurotus florida mushroom on rice straw and biogas production from the spend straw[J].World Journal of Microbiology and Biotechnology,1990(6):366-370.
[16]GHOST A,BHATTACHARYYA S C.Biomethanation of white rotted and brown rotted rice straw[J].Bioprocess Engineering,1999(20):297-302.
[17]BUMPUS J A,TIEN M,WRIGHT D,et al.Oxidation of persistent environmental pollutant by a white rot fungus[ J].Science,1985,228(4706):1434-1436.
[18]李慧蓉.白腐真菌生物学和生物技术[M].北京:化学工业出版社,2005:166.
[19]张丽英.饲料分析及饲料质量监测技术[M].3版.北京:中国农业大学出版社,2007:70-74.
[20]杭怡琼,薛惠琴,郁怀丹,等.白腐真菌对稻草秸秆的降解及其有关酶活性的变化[J].菌物系统,2001,20(3):403-407.
[21]赵 华,齐 刚,代 彦,等.白腐真菌对稻草秸秆生物降解的研究[J].饲料工业,2003,24(11):37-40.
[22]钱玉婷,叶小梅,常志州,等.不同水域凤眼莲厌氧发酵产甲烷研究[J].中国环境科学,2011,31(9):1513.

