原发性肝癌术后肝功能储备的影响因素
叶晶珠 ,詹丽英 ,李志晋 ,徐红燕 ,郑马亮
(中国人民解放军第一八四医院a.消化内科;b.检验科,江西 鹰潭 335000)
目前对于肝癌的治疗仍是早期诊断、早期治疗,根据不同病情进行综合治疗,是提高疗效的关键,而早期施行手术切除仍是肝癌首选和最有效的方法。然而大量研究证明,术后肝衰竭是肝癌手术乃至术后死亡率主要原因[1-2],因此术前合理的评价肝储备功能是非常重要的。一般认为Child-Pugh A级的患者肝切除较为安全,目前临床也出现以血中吲哚氰绿(indocyanine green,ICG)15 min清除率作为肝切除的指标,一般手术安全界限在0%~15%左右[3]。但是即使在此范围内,术后仍有部分患者可能出现肝功能代偿不全甚至死亡。本文通过回顾性分析272例肝癌患者术前常规肝功能检查与术后肝功能状态的关系,筛选出影响术后肝功能恢复的危险因素,探讨常规生化肝功能检查在肝储备评价中的临床价值。
1 材料与方法
1.1 ICG 15 min清除率的测定
以0.5 mg·kg-1ICG(沈阳济世制药有限公司)经肘正中静脉在10 s内完成注射,应用DDG-3300 k肝储备功能分析仪(日本光电株式工业会社),将光学感应器夹于受试者鼻翼一侧鼻孔内外,在体外对体内的ICG浓度进行连续检测,并自动计算出ICG 15 min清除率。
1.2 研究对象
为2004年1月至2012年12月在中国人民解放军第一八四医院行手术切除的病例,除数据不全者,共272例术前肝功能ICG 15 min清除率在0%~15%范围内的肝细胞肝癌患者。其中男238例(88.9%),女 34 例(11.1%),年龄 37~77(53.5±9.1)岁。 糖尿病患者占 12.5%(32/272),HBsAg阳性患者占 63.9%(171/272)。 肿瘤直径 1.5~15(5.26±2.95)cm,肿瘤为单发结节者占83.3%(225/272)。手术切除范围在半肝以下占86.1%(233/272)。所有患者均排除慢性肾病及肥胖。
1.3 肝功能代偿不全、肝功能衰竭的定义
根据术后总胆红素的变化,以48 h为1个周期,连续2次检测总胆红素≥60 μmol·L-1者为肝功能代偿不全[4];术后 30 d(包括 30 d)内因“非溶血或梗阻原因导致持续性总胆红素增高、凝血酶原时间延长、肝性脑病”为术后肝功能衰竭[5]。本研究对象共有22例术后肝功能代偿不全,其中有1例临床已确诊为肝功能衰竭;其余250例肝功能代偿良好。
1.4 观察指标
研究观察指标包括:年龄、性别、糖尿病、HBsAg、肿瘤大小、单发/多发、手术切除范围、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、前白蛋白(PALB)、白蛋白(ALB)、总蛋白(TP)、总胆红素(TB)、直接胆红素(DB)、γ-谷氨酰转肽酶(γ-GT)、胆碱酯酶(CHE)、乳酸脱氢酶(LDH)、总胆汁酸(TBA)、凝血酶原时间(PT)和血小板计数。
1.5 实验仪器
日立7600全自动生化分析仪(购自日本日立公司)。
1.6 统计学方法
2 结果
2.1 术后肝功能代偿良好与代偿不全患者各观察指标比较
术后肝功能代偿良好与代偿不全患者术前ALT、AST、ALP、γ-GT 差异有统计学意义(P<0.05),而年龄、性别、糖尿病、HBsAg阳性率、肿瘤大小、单发或多发、手术切除范围、PALB、ALB、TP、TB、DB、CHE、LDH、TBA、PT和血小板计数比较差异均无统计学意义(P>0.05),见表1-2。
2.2 术后肝功能代偿不全危险因素分析
Logistic单因素逐步回归分析提示ALT、AST、ALP、γ-GT是影响术后肝功能恢复的危险因素,Logistic多因素逐步回归分析显示只有术前高γ-GT是术后肝功能代偿不全的独立危险因素,见表3。
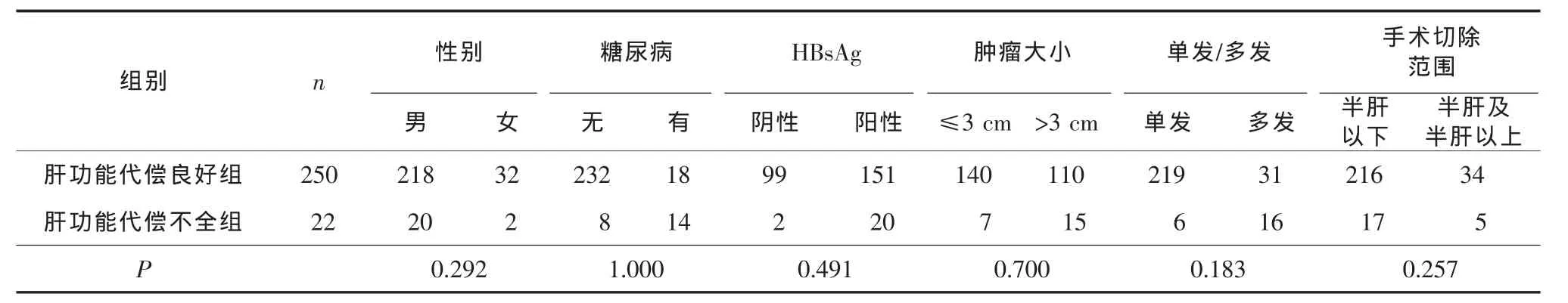
表1 术后肝功能代偿良好与代偿不全患者各观察指标比较(一) 例
表2 术后肝功能代偿良好与代偿不全各观察指标比较(二) ±s
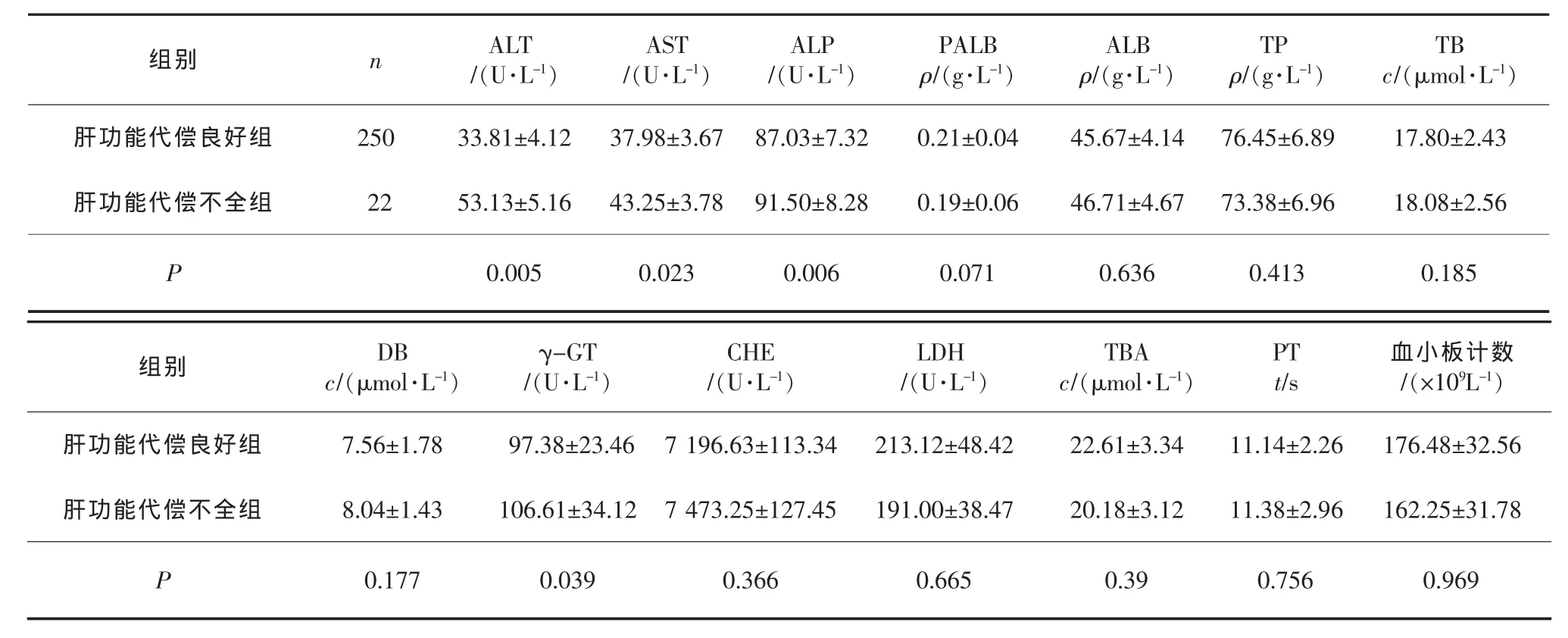
表2 术后肝功能代偿良好与代偿不全各观察指标比较(二) ±s
组别n ALT/(U·L-1)AST/(U·L-1)ALP/(U·L-1)PALB ρ/(g·L-1)ALB ρ/(g·L-1)TP ρ/(g·L-1)TB c/(μmol·L-1)肝功能代偿良好组肝功能代偿不全组250 22 33.81±4.12 53.13±5.16 37.98±3.67 87.03±7.32 0.21±0.04 45.67±4.14 76.45±6.89 17.80±2.43 43.25±3.78 91.50±8.28 0.19±0.06 46.71±4.67 73.38±6.96 18.08±2.56 P 0.0050.023 0.006 0.071 0.636 0.413 0.185组别DB c/(μmol·L-1)γ-GT/(U·L-1)CHE/(U·L-1)LDH/(U·L-1)TBA c/(μmol·L-1)PT t/s血小板计数/(×109L-1)肝功能代偿良好组肝功能代偿不全组7.56±1.78 8.04±1.43 97.38±23.46 7 196.63±113.34 213.12±48.42 22.61±3.34 11.14±2.26 176.48±32.56 106.61±34.12 7 473.25±127.45 191.00±38.47 20.18±3.12 11.38±2.96 162.25±31.78 P 0.1770.039 0.366 0.665 0.39 0.756 0.969
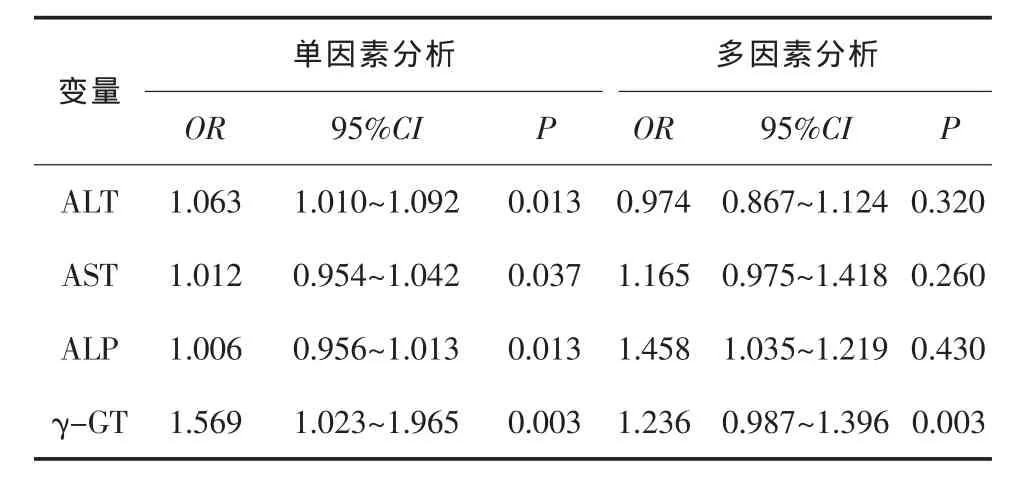
表3 术后肝功能代偿不全危险因素的单因素及多因素逐步回归分析
2.3 术前γ-GT对术后肝功能代偿不全的评估
γ-GT<168 U·L-1时肝功能代偿不全的发生率为 36.4%(8/22),γ-GT≥168 U·L-1时肝功能代偿不全的发生率为 63.6%(14/22)。 γ-GT 以 168 U·L-1为分界点时,预测术后肝功能代偿不全具有相对较高的灵敏度(72.7%,16/22)及特异度(90.0%,225/250)(图 1)。
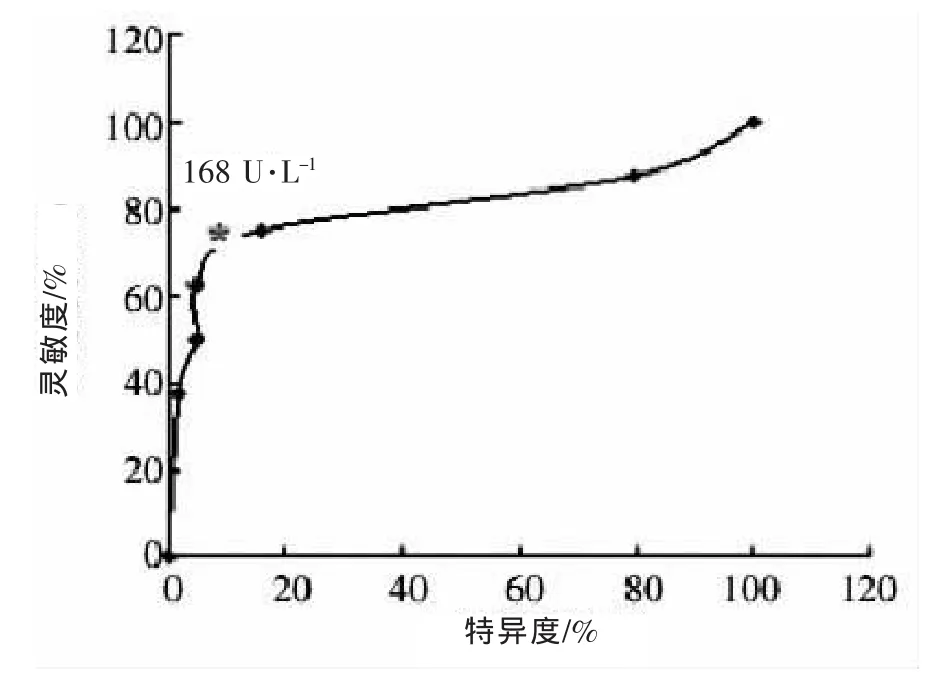
图1 术前γ-GT评估术后肝功能代偿不全的ROC曲线
3 讨论
原发性肝癌是我国的高发肿瘤,且超过90%的患者具有乙肝和肝硬化背景,常合并肝功能障碍,使肝脏储备能力受损,易发生术后肝功能衰竭及死亡。术后余肝储备功能不足导致肝功能衰竭是患者死亡的重要原因。然而,如何依据术前肝储备功能评估安全的肝切除范围及肝切除手术风险,国内外尚无统一的标准[6]。目前,本院临床诊断术前肝脏储备功能及制定手术方案主要是依据患者肝功能的ICG潴留率、常规肝功能检查以及影像学表现等。γ-GT是评估肝脏储备功能的常用指标,人类γ-GT在胚胎期活性较高,出生后迅速下降至低水平,主要存在于肝细胞和肝内胆管上皮细胞中。在癌变的肝组织中,GT重新大量表达,表现出胎肝的特点,GT在肝内的异常表达与肝细胞性肝癌(HCC)的发生和进展有着密切联系,已成为HCC早期诊断指标之一[7]。γ-GT是肝细胞癌术后复发及长期生存的重要影响因素,有研究[8]显示高γ-GT组患者5年生存率明显低于γ-GT正常组 (62.67%比35.70%)。其机制可能分为2个方面:首先,高GT组患者肝硬化比例高(91.5%比83.4%),程度也相对较重,大肿瘤多见,手术切除范围大,术后残肝体积少,如再合并肝炎活动,易出现肝功能失代偿而影响生存。在HCC患者体内会出现比肝硬化、转移性肝癌更高浓度的γ-GT,在肝癌的鉴别诊断上具有较高特异性。本研究通过单因素及多因素分析发现术前高γ-GT是肝功能代偿不全的独立危险因素,ROC曲线显示168 U·L-1是术前 γ-GT判断肝功能储备的最佳分界值,对预测术后肝功能代偿不全有较高的灵敏度(72.7%)及特异度(90.0%)。ALT和AST是目前临床应用最广最有价值的实验室检测肝功能的指标之一,但由于在外周血中的半衰期长(分别约为47 h和17 h),加之临床大量保肝、降转氨酶药物的应用,其升高水平与肝炎活动、细胞受损的严重程度并不完全相关[9],ALP由肝细胞合成分泌,自胆道排泄,因此胆管内压增高可使肝脏合成增多,胆道排泄障碍,故血中ALP显著增加,其同工酶ALP1对原发性肝癌诊断有较好的特异性,但敏感性差[10]。本研究结果显示,ICG 15 min清除率在0%~15%范围内的肝癌患者中, 术前 γ-GT<168 U·L-1时,术后肝功能代偿不全的发生风险较小。因此,术前应重视γ-GT的检测,并与Child-Pugh评分、ICG清除率相结合,综合评估患者术后残肝代偿能力,预防术后肝功能失代偿。
[1] Ito F,Cho C S,Rikkers L F,et al.Hilar cholangiocarcinoma:current management[J].Ann Surg 2009,250(2):210-218.
[2] Rocha F G,Matsuo K,Blumgart L H,et al.Hilar cholangiocarcinoma:the memorial sloan-kettering cancer center experience[J].J Hepatobiliary Pancreat Sci,2010,17(4):490-496.
[3] Fan S T.Liver functional reserve estimation:state of the art and relevance for local treatments:the Eastern perspective[J].J Hepatobiliary Pancreat Sci,2010,17(4):380-384.
[4] Schindl M J,Redhead D N,Fearon K C,et al.The value of residual liver volume as a predictor of hepatic dysfuntion and infection after major liver resection[J].Gut,2005,54(2):289-296.
[5] Shirabe K,Shimada M,Gion T,et al.Postoperative liver failure after major hepatic resection for hepatocellular carcinoma in the modern era with special reference to remnant liver volume[J].J Am Coll Surg,1999,188(3):304-309.
[6] Torzilli G,Makuuchi M,Inoue K,et al.No-mortality liver resection for hepatocellular carcinoma in cirrhotic and noncirrhotic patients;is there a way A prospective analysis of our approach[J].Arch Surg,1999,134(9):984-992.
[7] 沈卫东,黄介飞.肝癌特异性 GGT诊断肝癌的研究进展[J].世界华人消化杂志,2005,13(9):1119-1122.
[8] Mann C D,Neal C P,Garcea G,et al.Prognostic molecular markers in hepatocellular carcinoma:A systematic review[J].Eur J Cancer,2007,43(6):979-992.
[9] Hann H W,Wan S,Myers R E,et al.Comprehensive analysis of common serum liver enzymes as prospective predictors of hepatocellular carcinoma in HBV patients[J].PLoS One,2012,7(10):e47687.
[10] Yu M C,Chan K M,Lee C F,et al.Alkaline phosphatase:does it have a role in predicting hepatocellular carcinoma recurrence[J].J Gastrointest Surg,2011,15(8):1440-1449.

