水温和饲料蛋白质水平对松浦镜鲤幼鱼肠道消化酶活性的影响
黄金凤 赵志刚 罗 亮 徐奇友*
(1.中国水产科学研究院黑龙江水产研究所,哈尔滨150070;2.上海海洋大学水产与生命学院,上海201306)
消化酶是消化系统(消化腺和消化管)分泌的具有催化食物分解的一类酶,它的催化作用易受外界环境因素的影响。影响鱼类消化酶活性的环境因素有很多,在自然水体中,由于一年四季的变换,水体温度也在发生着很大的变化;鱼类属变温动物,水温的变化将直接影响鱼体内的代谢及生理生化过程[1]。因此,相对于其他的因素,水温的变化对鱼类消化酶活性的影响是最大和最主要的。黎军胜等[2]、田宏杰等[3]研究表明饲养水温的变化对消化酶活性具有显著的影响。消化酶活性的强弱直接影响到鱼类对于营养物质的消化吸收,进而影响鱼体生长发育[4]。同样,消化酶活性大小变化程度与食物组成的变化程度是相关的,这是鱼类本身对所处生态环境的一种适应,是长期自然选择的结果。黎军胜等[2]、Peres[5]、杨代勤等[6]研究均发现不同原料对肠道消化酶活性均具有显著的影响。Abolfathi等[7]研究也发现营养物质的摄入量对斜齿鳊(Rutilus rutilus caspicus)消化管消化酶活性具有显著影响。在水产养殖中,蛋白质是最重要的营养物质,对鱼类生长具有不可替代的作用,但是蛋白质水平过高时鱼体往往无法全部消化吸收而造成浪费并污染环境[8]。黄峰等[9]、邵庆均等[10]研究均发现增加饲料中蛋白质水平能有效地促进蛋白酶的活性。因此,根据消化酶活性随环境温度和饲料蛋白质水平的变化情况可以调整不同水温下的饲料蛋白质水平,以便使饲料中的蛋白质更好地被鱼体消化吸收,提高饲料的利用率,同时还可减少鱼类粪便中的氮排泄量,减轻水体污染,节约成本。
松浦镜鲤(Cyprinus specularis Songpu)是我国鲤科鱼类新品种,具有生长速度快、抗病以及抗寒能力强、繁殖力高、体型好等优点。了解松浦镜鲤在不同水温和饲料蛋白质水平条件下的消化生理对提高镜鲤养殖业的产量和质量、节约成本、降低污染具有重要意义。但关于水温和饲料蛋白质水平对松浦镜鲤肠道消化酶活性影响的文章少有报道。鉴于此,本文从消化生理的角度,研究水温和饲料蛋白质水平对松浦镜鲤幼鱼肠道消化酶活性的影响,旨在为松浦镜鲤消化生理学、营养和饲料学的研究提供理论依据。
1 材料与方法
1.1 试验设计与饲料配方
本试验采用3×5双因素试验设计,以水温和饲料蛋白质水平为影响因素,共设15个处理。其中,水温分别为18、23和28℃,饲料蛋白质水平分别为30.0%、32.0%、34.0%、36.0%和38.0%
试验饲料以鱼粉(进口)为动物性蛋白质源,大豆粕为植物性蛋白质源,通过改变次粉添加量调节饲料蛋白质水平。原料经粉碎过40目筛,再按表1所示配方制成5种粒径为2.0mm颗粒饲料,制成的饲料经晾干后,保存于-20℃冰箱中。

表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
1.2 试验用鱼与饲养管理
试验用松浦镜鲤幼鱼由中国水产科学研究院黑龙江水产研究所自繁培育,试验在室内循环养殖系统中进行,采用自动控温仪维持所需要的水温。试验前将幼鱼经5%的盐水消毒后在暂养池中驯养2周,挑选体格健壮、规格整齐、平均体重为(10.11±1.07)g的幼鱼1 350尾,随机分成15组,每组3个重复,每个重复30尾鱼。试验鱼以重复为单位放入室内循环养殖系统的水族箱中后,调节自动控温仪升或降1~2℃/d至试验设计的各温度梯度,温度的变动范围控制在±0.3℃,记录试验开始时间。
试验期间,每日投喂3次(08:00、12:00和17:00),每次投喂以饱食无残饵(少量多次投喂,以鱼不再摄食判断为饱食)为准,每3周测1次体重并计算饲料消耗量;定期测定水质,并消毒;每3d换水1次,每次换水1/3~1/2;全天24h充气并维持18℃溶氧>7.50mg/L,23℃溶氧>7.00mg/L,28℃溶氧>6.50mg/L;3个温度间水体氨氮和pH差异不大,其中氨氮<1mg/L,pH为7.52~7.91。试验期为60d。
1.3 样品采集与处理
饲养试验结束后,停饲24h,从每个水族箱中随机取5尾鱼,每组15尾,用麻醉剂(MS 222)麻醉后,在冰盘上快速解剖,取出肠道,剔除其上附属物,将肠道分为前肠、中肠和后肠(前肠为第1个回折拐弯点以前,中肠为第2个回折拐弯处至最后1个拐弯处,后肠为最后1个回折拐弯点至肛门之间),保存于-40℃冰箱备用。样品分析前于4℃冰箱中解冻,用预冷(0~4℃)的0.86%的生理盐水洗2次,再用滤纸吸去表面水分,称重,切碎后与预冷的0.86%的生理盐水按1∶9质量体积比稀释,于冰水浴中用高速组织匀浆机匀浆,匀浆液于高速冷冻离心(0℃,4 000r/min)20min后,取上清液作为粗酶液,置于-20℃冰箱中保存备用。
1.4 消化酶活性测定
蛋白酶活性测定采用福林-酚(Folin-phenol)法[11],具体操作如下:取匀浆 粗酶液1mL,37 ℃水浴预热5min,加0.5%酪蛋白溶液2mL作为反应底物。37℃水浴准确反应15min后加入10%三氯乙酸3mL,4 000r/min离心10min除去沉淀,取 上 清 液 1mL,加 入 0.55mol/L 碳 酸 钠5mL,再加入福林-酚试剂1mL,于37℃水浴中显色15min,689nm波长下比色测定。同时以1mL去离子水作空白对照。脂肪酶和淀粉酶活性均采用南京建成生物工程研究所生产的试剂盒测定,具体方法参见试剂盒所附说明书。蛋白酶活性单位定义:在37℃条件下,每分钟水解酪蛋白产生相当于1μg酪氨酸所需的酶量为1个酶活性单位。脂肪酶活性单位定义:在37℃条件下,每克组织蛋白质在本反应体系中与底物反应1min,每消耗1μmol底物为1个酶活性单位。淀粉酶活性单位定义:在37℃条件下,每毫克组织蛋白质与底物作用30min,水解10mg淀粉为1个酶活性单位。
1.5 数据统计与分析
试验数据采用SPSS 17.0软件分析,以水温和饲料蛋白质水平为影响因素,先进行双因素方差分析 (two-way ANOVA),之后采用 Duncan氏法进行多重比较,显著水平设定为P<0.05。试验结果以平均值±标准差表示。根据肠道蛋白酶活性,采用二阶多项式拟合分析确定松浦镜鲤幼鱼最佳蛋白质需要量,饲料蛋白质水平和肠道蛋白酶活性关系式为Y=a+bX+c X2,其中X代表蛋白质水平,Y代表肠道蛋白酶活性[12]。
2 结 果
2.1 水温和饲料蛋白质水平对松浦镜鲤幼鱼肠道蛋白酶活性的影响
水温和饲料蛋白质水平对松浦镜鲤幼鱼肠道蛋白酶活性的影响见表2。18℃下,饲料蛋白质水平对前肠蛋白酶活性无显著影响(P>0.05);饲料蛋白质水平为30.0%组中肠蛋白酶活性显著低于其他蛋白质水平组(P<0.05);饲料蛋白质水平为30.0%和32.0%的组后肠蛋白酶活性显著低于其他蛋白质水平组(P<0.05)。23℃下,饲料蛋白质水平为30.0%和32.0%的组前肠、后肠蛋白酶活性显著低于其他蛋白质水平组(P<0.05);饲料蛋白质水平为30.0%的组中肠蛋白酶活性显著低于饲料蛋白质水平为36.0%和38.0%的组(P<0.05)。28℃下,饲料蛋白质水平为30.0%和32.0%的组前肠蛋白酶活性显著低于其他蛋白质水平组(P<0.05);饲料蛋白质水平为30.0%的组中肠蛋白酶活性显著低于饲料蛋白质水平为34.0%、36.0%和38.0%的组(P<0.05);随饲料蛋白质水平的升高,后肠蛋白酶活性显著升高(P<0.05),当饲料蛋白质水平达到34.0%后,后肠蛋白酶活性变化不再显著(P>0.05)。除36.0%蛋白质水平下28℃时前肠蛋白酶活性显著高于18和23℃时(P<0.05)外,其他蛋白质水平下水温对前肠蛋白酶活性未产生显著影响(P>0.05);除32.0%蛋白质水平下28℃时中肠蛋白酶活性与18℃时差异不显著(P>0.05)外,其他蛋白质水平下23℃时中肠蛋白酶活性均显著高于18和23℃时(P<0.05);各个蛋白质水平下28℃时后肠蛋白酶活性均显著高于18℃时(P<0.05)。
由表3可知,水温和饲料蛋白质水平均显著或极显著影响前肠、中肠和后肠蛋白酶活性(P<0.05或P<0.01)。此外,水温与饲料蛋白质水平的交互作用对前肠蛋白酶活性具有极显著的影响(P<0.01),对中肠和后肠蛋白酶活性无显著影响(P>0.05)。
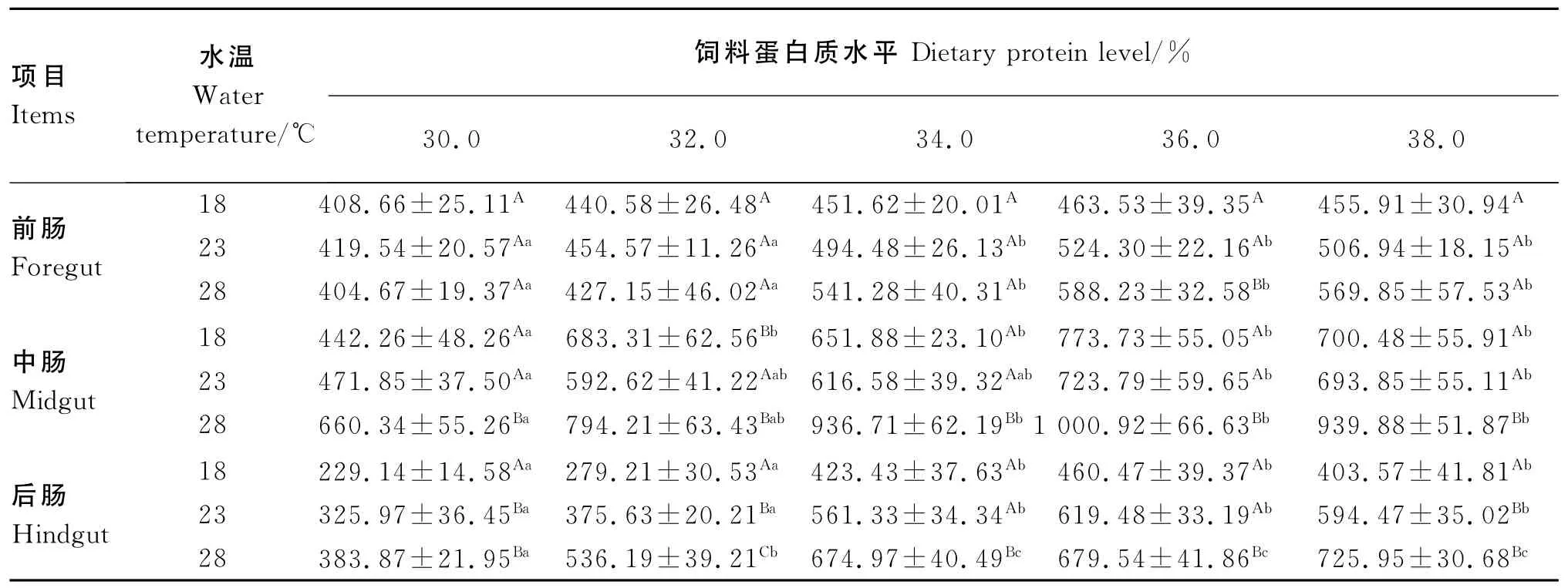
表2 水温和饲料蛋白质水平对松浦镜鲤幼鱼肠道蛋白酶活性的影响Table 2 Effects of water temperature and dietary protein level on intestinal protease activity of juvenile Songpu mirror carp(Cyprinus specularis Songpu) U/g prot

表3 松浦镜鲤幼鱼肠道蛋白酶活性的双因素方差分析Table 3 Two-way ANOVA of intestinal protease activity of juvenile Songpu mirror carp(Cyprinus specularis Songpu)
2.2 水温和饲料蛋白质水平对松浦镜鲤幼鱼肠道淀粉酶活性的影响
水温和饲料蛋白质水平对松浦镜鲤幼鱼肠道淀粉酶活性的影响见表4。除了23℃下饲料蛋白质水平为30.0%的组前肠淀粉酶活性显著低于饲料蛋白质水平为34.0%和36.0%的组(P<0.05)外,18、23和28℃下前肠、中肠和后肠淀粉酶活性均未受饲料蛋白质水平的显著影响(P>0.05),但有随饲料蛋白质水平的升高先升高后降低的趋势。同一蛋白质水平条件下,前肠淀粉酶活性随温度的升高先上升后下降,在23℃时最高,18℃时最低,二者之间差异显著(P<0.05);中肠和后肠淀粉酶活性随水温的升高而显著升高(P<0.05),即28℃时最高,而18℃时最低。
由表5可知,水温极显著影响前肠、中肠和后肠淀粉酶活性(P<0.01),饲料蛋白质水平仅对前肠淀粉酶活性有极显著影响(P<0.05),而水温与饲料蛋白质水平的交互作用对前肠、中肠和后肠淀粉酶活性均无显著影响(P>0.05)。

表4 水温和饲料蛋白质对松浦镜鲤幼鱼肠道淀粉酶活性的影响Table 4 Effects of water temperature and dietary protein level on intestinal amylase activity of juvenile Songpu mirror carp(Cyprinus specularis Songpu) U/g prot

表5 松浦镜鲤幼鱼肠道淀粉酶活性的双因素方差分析Table 5 Two-way ANOVA of intestinal amylase activity of juvenile Songpu mirror carp(Cyprinus specularis Songpu)
2.3 水温和饲料蛋白质水平对松浦镜鲤幼鱼肠道脂肪酶活性的影响
水温和饲料蛋白质水平对松浦镜鲤幼鱼肠道脂肪酶活性的影响见表6。18、23和28℃下,饲料蛋白质水平对前肠、中肠和后肠脂肪酶活性均无显著影响(P>0.05)。同一蛋白质水平下,前肠、中肠和后肠脂肪酶活性随水温的升高而降低,即28℃时最低,而18℃最高。其中,除34.0%蛋白质水平下23℃时后肠脂肪酶活性显著低于18℃时(P<0.05)外,各个蛋白质水平下18和23℃前肠和后肠脂肪酶活性均差异不显著(P>0.05),并 均 显 著 高 于 28 ℃ 时 P<0.05);除30.0%和34.0%蛋白质水平下23℃时中肠脂肪酶活性与18℃时无显著差异(P<0.05)外,其他蛋白质水平下23和28℃时中肠脂肪酶活性均显著低于18℃时(P<0.05)。
由表7可知,水温极显著影响前肠、中肠和后肠脂肪酶活性(P<0.01),但饲料蛋白质水平以及水温与饲料蛋白质水平的交互作用对前肠、中肠和后肠脂肪酶活性均未产生显著影响(P>0.05)。
2.4 根据肠道蛋白酶活性确定不同水温下松浦镜鲤幼鱼最佳蛋白质需要量
由于各个水温下,除前肠淀粉酶活性外,肠道其他部位淀粉酶和脂肪酶活性受饲料蛋白质水平变化影响不显著,即饲料蛋白质水平主要影响肠道蛋白酶活性,因此根据肠道(前肠、中肠和后肠)蛋白酶活性确定松浦镜鲤幼鱼的最佳蛋白质需要量。二阶多项式拟合分析表明:根据前肠蛋白酶活性,18℃下最佳饲料蛋白质水平为36.22%(Y=-1 254.91+94.716 15 X-1.307 64 X2,P<0.05,R=0.968 43);23℃下最佳饲料蛋白质水平为37.41%(Y=-2 055.44+137.311 7 X-1.838 53 X2,P<0.05,R=090 93);28 ℃下最佳饲料蛋白质水平为39.99%(Y=-2 356.39+147.060 7 X-1.838 53 X2,P < 0.05,R =0.883 63)(图1)。根据中肠蛋白酶活性,18℃下最佳饲料蛋白质水平为35.83%(Y=-11 101.592 7+662.253 7 X-9.241 47 X2,P<0.05,R=0.834 07);23℃下最佳饲料蛋白质水平为37.40%(Y=-5 367.95+325.060 4 X-4.346 31 X2,P<0.05,R=0.898 58);28℃下最佳饲料蛋白质水平为36.79%(Y=-8 889.54+536.968 2 X -7.298 13 X2,P <0.05,R =0.975 65)(图2)。根据后肠蛋白酶活性,18℃下最佳饲料蛋白质水平为36.96%(Y=-5 333.63+311.795 X-4.217 9 X2,P<0.05,R=0.852 25);23℃下最佳饲料蛋白质水平为39.58%(Y=-5 346.63+302.390 3 X-3.820 1 X2,P<0.05,R=0.784 27);28℃下最佳饲料蛋白质水平为37.45% (Y = -7 822.79+456.382 6 X -6.093 78 X2,P<0.05,R=0.982 66)(图3)。综上,根据肠道蛋白酶活性,松浦镜鲤幼鱼最佳饲料蛋白质水平水温18℃下为35.83%~36.96%,23℃ 下 为 37.40% ~39.58%,28 ℃ 下 为36.79%~39.99%。

表6 水温和饲料蛋白质水平对松浦镜鲤幼鱼肠道脂肪酶活性的影响Table 6 Effects of water temperature and dietary protein level on intestinal lipase activity of juvenile Songpu mirror carp(Cyprinus specularis Songpu) U/g prot

表7 松浦镜鲤幼鱼肠道脂肪酶活性的双因素方差分析Table 7 Two-way ANOVA of intestinal lipase activity of juvenile Songpu mirror carp(Cyprinus specularis Songpu)
3 讨 论
国内外有关鱼类消化酶的研究报道很多,近些年来鱼类饲料与消化酶之间的关系引起了鱼类生物学家的注意,特别是饲料蛋白质水平对消化酶的影响越来越受到关注。蛋白质是配合饲料的最重要组成部分,饲料蛋白质水平对鱼类正常生长和繁殖具有至关重要的作用,适宜的饲料蛋白质水平可促使鱼类快速生长,同时饲料蛋白质水平还会影响鱼类消化酶的活性。已有研究表明,饲料蛋白质水平对鱼类蛋白酶活性有一定的影响,在一定饲料蛋白质水平范围内,蛋白酶活性随饲料蛋白质水平的升高而升高[10,13]。本研究得到相同的结果,即在一定饲料蛋白质水平范围内肠道蛋白酶活性随饲料蛋白质水平的升高而升高,但当蛋白质水平达到一定程度后蛋白酶活性变化不显著,说明饲料中的蛋白质可以诱导鱼体内肠道蛋白酶的分泌,但鱼类对饲料中蛋白质的消化吸收是有限度的,且有一个最适值,超过最适值后蛋白酶的活性不再发生显著变化。Debnath等[14]研究发现,饲料蛋白质水平超过25%时能促进南亚野鲮(Labeo rohita)肠道蛋白酶的分泌。Le Moullac等[15]研究发现,随饲料蛋白质水平的升高,凡纳滨对虾(Penaeus vannamei)肠道蛋白酶活性升高。随着饲料蛋白质水平在适当范围内的增加,鱼体肠道蛋白酶的活性增加,提高了对营养物质的消化吸收,从而改善生长性能;而过高的饲料蛋白质水平增加了肠道的消化负担,并且体内代谢产生较多的有毒的含氮物质,可能会对消化酶的分泌产生负反馈调节[16]。饲料蛋白质水平的变化不仅对肠道蛋白酶活性产生影响,还可能改变肠道淀粉酶和脂肪酶的活性。淀粉酶主要是由散布于肝脏内的胰组织产生的,并且在肠道中被进一步激活,但不同鱼类淀粉酶的分泌器官存在差异。本试验中,随饲料蛋白质水平的升高,肠道淀粉酶活性有所升高,但是差异不显著,这与Debnath等[14]和 Lopez-Lopez等[17]的研究结果一致。这可能是因为鱼类肠道淀粉酶活性的变化主要是由食物淀粉含量引起的,在淀粉含量相同情况下,不同饲料蛋白质水平的变化未能引起肠道淀粉酶活性呈现规律性变化[18]。肠道是消化、吸收蛋白质和脂肪的主要器官[19]。本试验中,随饲料蛋白质水平的升高,肠道脂肪酶活性有所升高,但是差异不显著,这与 Debnath等[14]和 Lundstedt等[20]的研究结果一致。这可能是因为鱼类肠道脂肪酶活性与其所摄食的饲料种类有关,特别是与饲料中脂肪含量有关,而本试验不同蛋白质水平饲料中脂肪含量是相同的。
水温对于鱼类生理活动的影响是复杂的。水温能直接影响鱼类消化酶活性和摄食量,从而影响营养物质的消化利用[21-22]。在一定温度范围内,随水温升高,鱼体内各细胞中酶活性随之增强,各种生理、生化反应加快,新陈代谢作用增强[23]。Hardewig等[24]研究发现,随水温升高,斜齿鳊(Rutilus rutilus)消化酶活性升高且摄食量增大。Couto等[25]研究发现,饲养水温对酸性蛋白酶和碱性蛋白酶活性均具有显著的影响,但对总蛋白酶活性没有显著影响,说明蛋白酶活性的差异是鱼适应不同饲养水温的一种生理适应现象。本研究表明,松浦镜鲤幼鱼消化酶的活性与环境温度关系密切,随水温的升高,肠道蛋白酶和淀粉酶活性显著升高,与Kuzmina等[26]研究结果相似。这可能是因为随水温升高鱼体生理代谢强度增强,消化系统的代谢强度也增强[23],进而增加消化酶的分泌,并且水温升高会增加鱼的摄食量,而摄食量变化与鱼类消化酶的分泌活性有关[27]。本研究发现,脂肪酶活性随水温的升高而下降,与Gao等[28]的研究结果一致,Kofuji等[22]研究结果也表明在低水温条件下肠道脂肪酶活性更高,这可能是因为低水温条件下肠道营养物质的转运速度变慢。
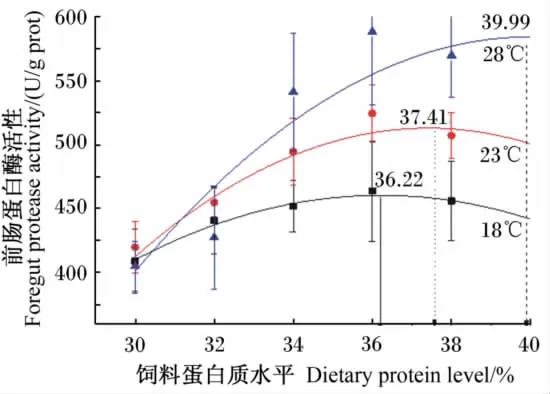
图1 不同水温下前肠蛋白酶活性与饲料蛋白质水平的二阶多项式拟合Fig.1 Second-order polynomial fitting between foregut protease activity and dietary protein level at different water temperatures
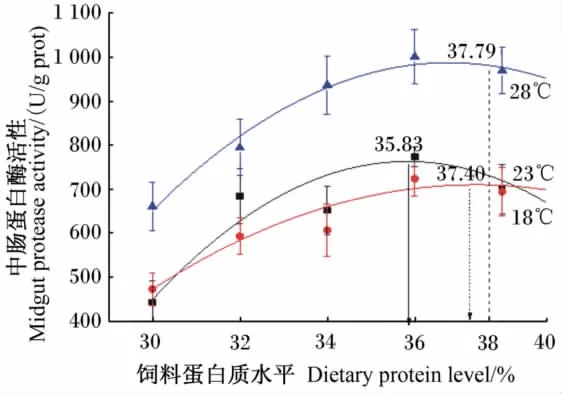
图2 不同水温下中肠蛋白酶活性与饲料蛋白质水平的二阶多项式拟合Fig.2 Second-order polynomial fitting between midgut protease activity and dietary protein level at different water temperatures
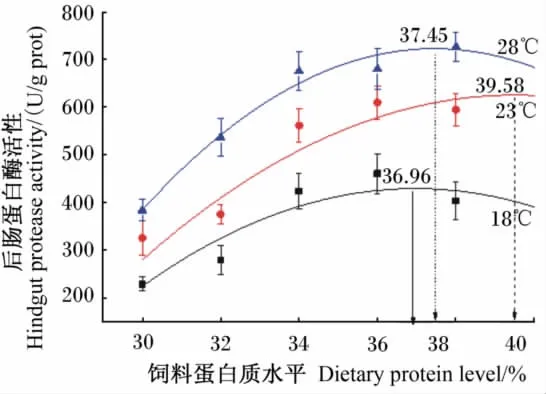
图3 不同水温下后肠蛋白酶活性与饲料蛋白质水平的二阶多项式拟合Fig.3 Second-order polynomial fitting between hindgut protease activity and dietary protein concentration at different water temperatures
鱼类的消化机能是与其结构相适应的,并且直接影响消化酶活性。肠道在营养物质消化中起着重要的作用,是主要的消化器官。肠致活酶由肠道分泌,它能激活蛋白酶原,共同促进肠道对饲料蛋白质的消化吸收。鱼类肠道不同部位蛋白酶活性的变化因鱼而异,与鱼类的食性及消化酶的分泌有密切的关系。草鱼和鲫鱼的前肠、后肠之间蛋白酶活性差异不显著[29],这与本研究对松浦镜鲤幼鱼肠道不同部位蛋白酶活性研究结果一致,并且低温条件下后肠蛋白酶活性显著高于高温条件下。倪寿文等[30]研究发现,鲢、鳙、鲫淀粉酶活性以中肠较高,与本研究结果一致。脂肪酶在鱼的消化生理中占有重要地位。吴婷婷等[29]研究发现,无胃鱼类的肠道各部位脂肪酶和淀粉酶活性变化有互补现象,即淀粉酶活性高的部位脂肪酶活性低;相反,脂肪酶活性高的部位淀粉酶活性低,这与本研究结果一致。此外,吴婷婷等[29]研究结果还表明,鳜鱼、青鱼后肠的脂肪酶活性显著高于前肠和中肠,与本研究结果相似。而黎军胜等[31]研究发现,奥尼罗非鱼肠道脂肪酶活性从大到小依次为前肠、中肠、后肠,表明鱼类消化酶的分布存在差异。综上,肠道不同部位消化酶活性对水温和饲料蛋白质水平的变化反应不一致,表明不同器官的消化酶活性对水温和饲料蛋白质水平的适应性变化并不同步,进一步说明消化酶产生的控制机制比较复杂,肠道不同部位消化酶活性受水温和饲料蛋白质水平的变化作用的反馈影响机理可能存在差异。
4 结 论
水温和饲料蛋白质水平与松浦镜鲤幼鱼肠道消化酶活性关系密切,根据肠道蛋白酶活性,松浦镜鲤幼鱼最佳饲料蛋白质水平在水温18℃下为35.83%~36.96%,23 ℃ 下 为 37.40% ~39.58%,28℃下为36.79%~39.99%。
[1] HIRAYAMA M,KOBIYAMA A,KINOSHITA S,et al.The occurrence of two types of hemopexin-like protein in medaka and differences in their affinity to heme[J].Journal of Experimental Biology,2004,207:1387-1398.
[2] 黎军胜,李建林,吴婷婷.饲料成分与环境温度对奥尼罗非鱼消化酶活性的影响[J].中国水产科学,2004,11(6):585-588.
[3] 田宏杰,庄平一,章龙珍,等.水温对施氏鲟幼鱼消化酶活力的影响[J].中国水产科学,2007,14(1):126-131.
[4] 朱爱意,谢佳彦,江丽华.pH和温度对黄姑鱼主要消化酶活力的影响[J].浙江海洋学院学报:自然科学版,2010,29(6):531-536.
[5] PERES A.Dietary regulation of activities and mRNA levels of trypsin and amylase in sea bass(Dicentrarchus labrax)larvase[J].Fish Physiology Biochemistry,1998,19(2):145-152.
[6] 杨代勤,严安生,陈芳,等.不同饲料对黄鳝消化酶活性的影响[J].水产学报,2003,27(6):558-563.
[7] ABOLFATHI M,HAJIMORADLOO A,GHORBANI R,et al.Effect of starvation and refeeding on digestive enzyme activities in juvenile roach,Rutilus rutilus caspicus[J].Comparative Biochemistry and Physiology:Part A,2012,161:166-173.
[8] SINGH P K,DESAI P K,CHAVAN P A,et al.Effect of water temperature on dietary protein requirement,growth and body composition of Asian catfish,Clarias batrachus fry[J].Journal of Thermal Biology,2009,34:8-13.
[9] 黄峰,严安生,张桂蓉,等.不同蛋白含量饲料对南方鲇胃蛋白酶和淀粉酶活性的影响[J].水生生物学报,2003,27(5):451-456.
[10] 石英,冷向军,李小勤,等.饲料蛋白水平对血鹦鹉幼鱼生长、体组成和肠道蛋白消化酶活性的影响[J].水生生物学报,2009,33(5):874-880.
[11] 中山大学生物学系生化微生物学教研室.生化技术导论[M].北京:人民教育出版社,1979:53-54.
[12] SANCHETI D C,KAPOOR V K.Statistics-theory,methods and applications[M].New Delhi:Sultan Chand and Sons Publishing Co.,1981:917.
[13] 孙翰昌,徐敬明,庞敏.饲料蛋白水平对瓦氏黄颡鱼消化酶活性的影响[J].水生态学杂志,2010,3(2):84-87.
[14] DEBNATH D,PAL A K,SHHU N P,et al.Digestive enzymes and metabolic profile of Labeo rohita fingerlings fed diets with different crude protein levels[J].Comparative Biochemistry and Physiology:Part B,2007,146:107-114.
[15] LE MOULLAC G,VAN WORMHOUDT A,AQUACOP.Adaptation of digestive enzymes to dietary protein,carbohydrate and fibre levels and influence of protein and carbohydrate quality in Penaeus vannamei larvae(Crustacea,Decapoda)[J].Aquatic Living Resources,1994,7:203-210.
[16] DAS K M,TRIPATHI S D.Studies on the digestive enzymes of grass carp,Ctenopharyngodonidella(Val)[J].Aquaculture,1991,92:21-32.
[17] LOPEZ-LOPEZ S,NOLASCO H,VILLARREALCOLMENARES H,et al.Digestive enzyme response to supplemental ingredients in practical diets for juvenile freshwater crayfish Cherax quadricarinatus[J].Aquaculture Nutrition,2005,11:79-85.
[18] 林建斌,李金秋,王剑锋,等.不同能量蛋白质比饲料对点带石斑鱼幼鱼体内消化酶活性的影响[J].中国饲料,2008(14):33-35.
[19] 王宏田,张培军.牙鲆体内消化酶活性的研究[J].海洋与湖沼,2002,33(5):472-475.
[20] LUNDSTEDT L M,BIBIANO-MELO J F,MORAES G.Digestive enzymes and metabolic profile of Pseudoplatystoma corruscans (Teleostei:Siluriformes)in response to diet composition[J].Comparative Biochemistry Physiology,2004,137B:331-339.
[21] TEMMING A,HERRMANN J P.Gastric evacuation in horse mackerel.Ⅰ.The effects of meal size,temperature and predator weight[J].Journal of Fish Biology,2001,58:1230-1245.
[22] KOFUJI P Y M,AKIMOTO A,HOSOKAWA H,et al.Seasonal changes in proteolytic enzymes of yellowtail Seriola quinqueradiata (Temminck & Schlegel;Carangidae)fed extruded diets containing different protein and energy levels[J].Aquaculture,2005,36:696-703.
[23] 尾崎久雄.鱼类消化生理[M].上海:上海科学技术出版社,1985.
[24] HARDEWIG I,VAN DIJK P L M.Is digestive capacity limiting growth at low temperatures in roach?[J]Journal of Fish Biology,2003,62:358-374.
[25] COUTO A,ENES P,PERES H,et al.Temperature and dietary starch level affected protein but not starch digestibility in gilthead sea bream juveniles[J].Fish Physiology Biochemistry,2012,38:595-601.
[27] INFANTE J L I,CAHU C L.Sea bass(Dicentrarchus labrax)larvae fed different Artemia rations:growth,pancreas enzymatic response and development of digestive function[J].Aquaculture,1996,139(1/2):129-138.
[28] 高菲,杨红生,许强,等.温度对海参(Apostichopus japonicus)(Selenka)消化酶活性和肠道质量的影响[J].海洋与湖沼,2009,27(4):714-722.
[29] 吴婷婷,朱小明.鳜鱼、草鱼、鲤、鲫、鲢消化酶活性研究[J].中国水产科学,1994,1(2):10-17.
[30] 倪寿文,桂远明.草鱼、鲤、鲢、鳙和尼罗罗非鱼肝胰脏和肠道蛋白酶活性的初步探讨[J].动物学报,1993,39(2):160-168.
[31] 黎军胜,李建林,吴婷婷.奥尼罗非鱼消化道蛋白酶分布与特性[J].南京农业大学学报,2004,27(1):81-84.

