小檗碱对肉兔消化代谢的影响
汪水平 王文娟 赵桥芳 龚秋瑜 徐基钊 张朝娟
(1.西南大学荣昌校区,重庆402460;2.西南大学重庆市牧草与草食家畜重点实验室,重庆 400716)
随着现代集约化和规模化养殖业的发展,动物感染疾病的风险大大增加。为预防疾病、促进生长及提高饲料利用率,大量抗生素作为饲料添加剂被普遍使用。长期、大量地使用抗生素类添加剂会导致细菌产生抗药性,抑制机体免疫功能,引起动物内外源双重感染及在动物产品和环境中残留等负面效应,故寻找抗生素替代品已经迫在眉睫。植物提取物以其天然性、多功能性和环保性,引起从业者的广泛关注。小檗碱,又称黄连素,属于异喹啉类生物碱,主要存在于毛茛科植物黄连、芸香科植物黄柏及小檗科植物小檗中[1-2],常用其盐酸盐形式。小檗碱的生理功能具有多种生理功能,在治疗肿瘤、糖尿病、心血管疾病、高血脂、炎症、细菌和病毒感染、脑缺血性损伤、精神疾病、阿尔茨海默病及骨质疏松等方面均具有药理作用[3-4]。可见,小檗碱药性独特、来源丰富,是抗生素的潜在替代品。目前,对小檗碱的作用效果及作用机理的研究多集中在动物的病理模型和人的临床治疗上,而以畜禽为对象作为饲料添加剂的研究少见报道。基于此,本试验给肉兔饲喂小檗碱添加量不同的饲粮,通过对饲粮干物质(dry matter,DM)、有机物(organic matter,OM)、粗纤维(crude fiber,CF)和粗脂肪(ether extract,EE)等营养物质表观消化率、能氮平衡及肉兔盲肠内环境参数的考察,评估小檗碱对肉兔消化代谢的影响,探讨小檗碱的作用机理,为其在生产实践中应用提供科学依据。
1 材料与方法
1.1 试验材料
本试验用小檗碱为其盐酸盐形式(盐酸小檗碱),购自四川省什邡市某药物原料厂,提取自黄柏的根和皮,为黄色结晶性粉末,无臭,味极苦,纯度≥97.0%。
1.2 基础饲粮
基础饲粮参考 NRC(1977)[5]和 de Blas等[6]推荐的生长兔饲养标准配制,其组成及营养水平见表1。所有饲料原料过1.5mm筛粉碎,按不同组别分别混匀,再采用冷制粒工艺制成直径为4mm的颗粒料。
1.3 试验设计
选用128只50日龄、体重相近的健康新西兰兔作为试验动物,公母各占1/2。采用单因子随机区组试验设计,将128只新西兰兔随机分为4组,1个对照组和3个试验组,每组32个重复,每个重复1只。对照组饲喂基础饲粮,3个试验组分别饲喂在基础饲粮中添加10、20及30mg/kg盐酸小檗碱的试验饲粮。预试期为7d,正试期为27d。试验组肉兔在预试期内由基础饲粮逐渐过渡到试验饲粮。
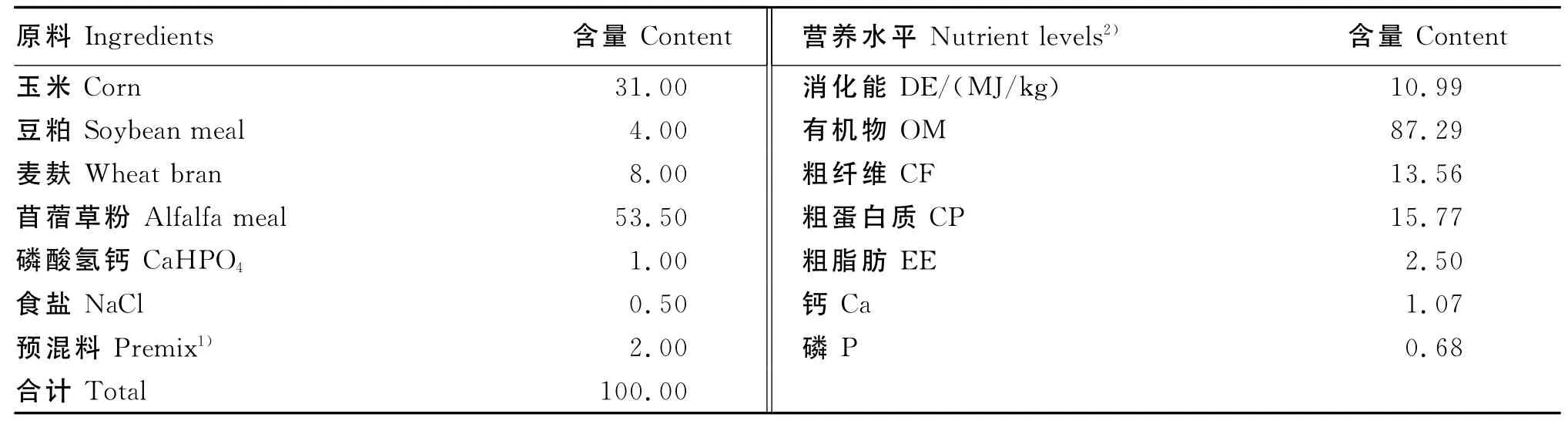
表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet(DM basis) %
1.4 饲养管理
试验于2011年12月4日到2012年1月6日在重庆市荣昌县西南大学荣昌校区“7+5”肉兔养殖创业组进行。兔舍为2层双列式,每笼饲养1只。试验兔采用颗粒料饲喂,自由采食与饮水,日喂2次(07:00和18:00),每次投料少量多添,投料时间不少于2h。兔舍自然采光,自然通风,日打扫卫生1次,保持兔舍清洁卫生。经测定,试验期兔舍内温度平均为8.34℃,相对湿度平均为92.73%,温湿指数平均为47.46。试验期间,按兔场规定进行防疫、驱虫和消毒,并密切观察试验兔行为,发现异常立即处理。
1.5 样品采集及预处理
1.5.1 饲料、粪、尿样采集及预处理
随机采集饲料样品1 000g,65℃烘干,过1mm筛粉碎,常温保存待测DM、OM、总能(gross energy,GE)、氮、CF及EE含量。正试期第10~15天利用漏尿集粪板收集试验兔排出的全部粪便,随排随收,所收集到的粪便装袋,立即于4℃保存。每日早晚饲喂试验兔时将收集的鲜粪准确称重,混匀,取50%作为样品,并按重量的10%加入25%(质量浓度)酒石酸溶液,混匀,-20℃保存。连续收集6d后,将全部粪样解冻后混匀,65℃烘干测定初水分,再过1mm筛粉碎,常温保存待测DM、OM、GE、氮、CF及EE含量。在全收粪的同时,利用集尿漏斗收集试验兔排出的全部尿液,随排随收。由于试验兔排尿量较少,故不需取样。随时用10%(体积分数)硫酸将收集到的尿液pH调整至低于2,记录加酸量,立即于4℃保存。连续收集6d后,将全部尿液混匀,用4层纱布过滤,得滤液,测定体积,加入5mL浓硫酸和10mL甲苯,混匀,装瓶,-20℃保存待测氮和GE含量。样品中DM、OM、氮、CF及EE含量的测定分别按照GB/T 6435—2006、GB/T 6438—2007、GB/T 6432—1994、GB/T 6434—1994及 GB/T 6433—2006的方法进行,GE含量的测定采用氧弹燃烧法。
1.5.2 盲肠内容物样采集及预处理
在正试期结束的第2天,从每组中挑选16只接近各组平均体重的试验兔,采用耳缘静脉注射空气法致死后,取出盲肠,收集全部盲肠内容物,迅速混匀,立即测定pH与微生物总脱氢酶(microbial total dehydrogenase,MTD)活性。取5g左右样品放入50mL离心管中,加入5倍生理盐水,混匀,4℃下4 000r/min离心10min,得上清液。取5mL上清液,加入1mL 1%(体积分数)硫酸溶液,混匀,-20℃保存待测氨氮(ammonia nitrogen,NH3-N)浓度。剩余内容物装袋,-20℃保存待测微生物蛋白质(microbia crude protein,MCP)浓度。MTD活性[7]与 NH3-N 浓 度[8]均 采 用 比 色法测定,MCP浓度采用三氯乙酸沉淀法[9]测定。
1.6 计算方法
1.6.1 饲粮营养物质表观消化率
饲粮某营养物质表观消化率=100×(饲粮进食量×饲粮中某营养物质含量-日排粪量×粪便中某营养物质含量)/(饲粮进食量×饲粮中某营养物质含量)[10]。
1.6.2 能量平衡
消化能(digestible energy,DE)=食入GE-粪GE;
代谢能(metabolizable energy,ME)=DE-尿GE;
GE表观消化率=100×DE/食入GE;
GE利用率=100×ME/食入GE;
DE利用率=100×DE/ME[11]。
1.6.3 氮平衡
沉积氮=食入氮-(粪氮+尿氮);
氮表观消化率=100×(食入氮-粪氮)/食入氮;
氮利用率=100×沉积氮/食入氮;
消化氮利用率=100×沉积氮/(食入氮-粪氮)[10]。
1.7 统计分析
采用Excel 2003软件对数据进行基本处理,然后采用SPSS 11.5软件中的GLM模块进行方差分析和显著性检验,多重比较用Duncan氏法进行,结果以平均值±标准差表示。
2 结果与分析
2.1 试验兔饲粮 DM、OM、CF和 EE表观消化率
由表2可知,对于DM表观消化率,对照组显著低于10mg/kg组和30mg/kg组(P<0.05),极显著低于20mg/kg组(P<0.01);对于 OM 和CF表观消化率,对照组显著低于10mg/kg组(P<0.05),极显著低于20mg/kg组(P<0.01);对于EE表观消化率,对照组显著低于20mg/kg组(P<0.05),极显著低于30mg/kg组(P<0.01)。
2.2 试验兔能量平衡
由表3可知,对于食入GE,10mg/kg组显著低于30mg/kg组(P<0.05),极显著低于对照组和20mg/kg组(P<0.01);对于粪 GE,10mg/kg组极显著低于其余3组(P<0.01);对于尿GE,对照组和30mg/kg组均极显著高于10mg/kg组和20mg/kg组(P<0.01),而10mg/kg组极显著高于20mg/kg组 (P<0.01);对 于 DE 和 ME,20mg/kg组极显著高于其余3组(P<0.01),对照组和30mg/kg组极显著高于10mg/kg组(P<0.01);对于GE表观消化率,对照组显著低于10mg/kg组和30mg/kg组(P<0.05),极显著低于20mg/kg组 (P<0.01);对 于 GE 利 用 率,20mg/kg组极显著高于其余3组(P<0.01);对于DE利用率,20mg/kg组显著高于对照组和30mg/kg组(P<0.05)。
2.3 试验兔氮平衡
由表4可知,对于食入氮,10mg/kg组极显著低于其余3组(P<0.01);对于粪氮,10mg/kg组和20mg/kg组均极显著低于对照组和30mg/kg组(P<0.01),而30mg/kg组显著低于对照组(P<0.05);对于尿氮,10mg/kg组显著低于对照组和 20mg/kg组 (P<0.05);对 于 沉 积 氮,20mg/kg组显著高于对照组和10mg/kg组(P<0.05);对于氮表观消化率,对照组极显著低于10mg/kg组 和 20mg/kg 组 (P <0.01),而30mg/kg组分别显著(P<0.05)和极显著(P<0.01)低于10mg/kg组和20mg/kg组;对于氮利用率,10mg/kg组和20mg/kg组均极显著高于对照组和30mg/kg组(P<0.01),而30mg/kg组显著高于对照组(P<0.05);对于消化氮利用率,对照组显著低于20mg/kg组和30mg/kg组(P<0.05),极显著低于10mg/kg组(P<0.01)。
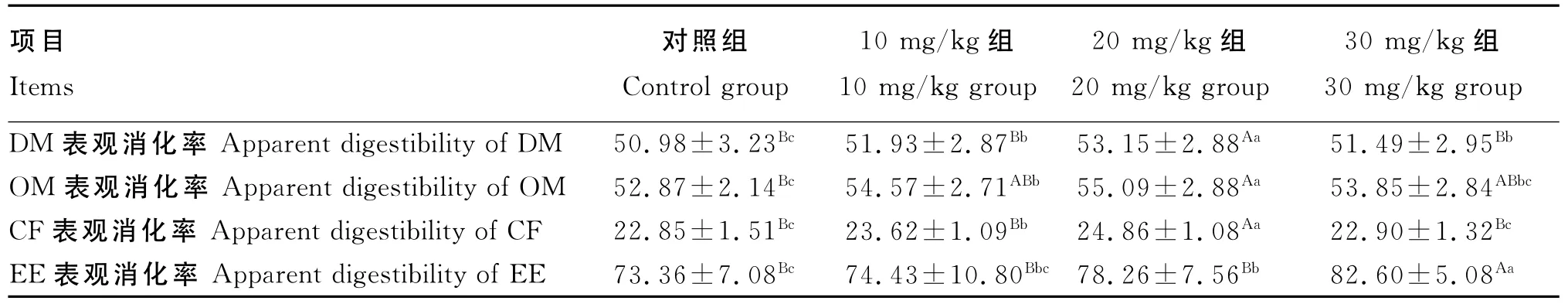
表2 试验兔饲粮DM、OM、CF和EE的表观消化率Table 2 Apparent digestibility of DM,OM,CF and EE in diets for experimental rabbits %
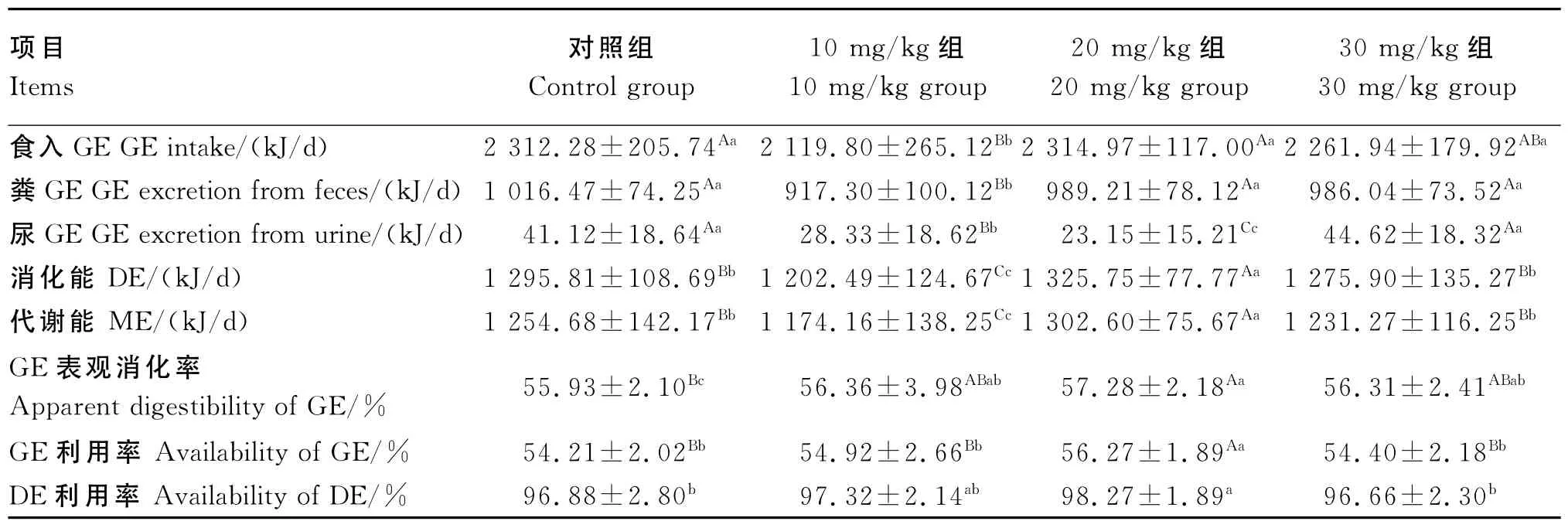
表3 试验兔能量平衡Table 3 Energy balance of experimental rabbits

表4 试验兔氮平衡Table 4 Nitrogen balance of experimental rabbits
2.4 试验兔盲肠内环境参数
由表5可知,对于pH,4组间差异不显著(P>0.05);对于 MTD活性,对照组和30mg/kg组均极显著低于10mg/kg组和20mg/kg组(P<0.01);对于 NH3-N 浓度,对照组和30mg/kg组均极显著高于10mg/kg组和20mg/kg组(P<0.01);对于 MCP浓度,对照组显著低于10mg/kg组 和 20mg/kg 组 (P<0.05),极 显 著 低 于20mg/kg组(P<0.01),而20mg/kg组显著高于10mg/kg组和30mg/kg组(P<0.05)。

表5 试验兔盲肠内环境参数Table 5 Internal environment parameters of cecum of experimental rabbits
3 讨 论
3.1 小檗碱对肉兔营养物质利用效率的影响
DM和OM表观消化率是动物对饲料消化特性的综合反映,在一定程度上可表明消化道对饲料营养物质的消化程度与利用效率。本试验中,饲粮添加小檗碱可提高试验兔DM和OM表观消化率,表明小檗碱会影响肉兔消化生理、消化道结构及机能,改善肉兔的消化力。CF是植物细胞壁的主要组成成分,包括纤维素、半纤维素、木质素及角质等成分[10]。肉兔借助盲肠和大肠微生物的发酵作用,可利用部分纤维素和半纤维素产生挥发性脂肪酸,给机体提供能量[10]。本试验结果表明,小檗碱可改善肉兔对饲粮纤维物质的利用效率。由于植物源饲料原料所含脂肪很难提取,造成草食动物饲粮脂肪进食量被低估,特别是当饲粮脂肪含量较低时,进入十二指肠的脂肪量比进食量要高,故采用进食量和粪中排泄量的差值来评定脂肪消化率通常会低估饲粮脂肪的消化率[11]。本试验中,随着饲粮小檗碱添加量的提高,试验兔EE表观消化率逐渐升高,表明小檗碱可改善肉兔对饲粮中脂肪的消化吸收。饲粮中的有机物质,特别是蛋白质、碳水化合物及脂肪这三大养分都是能量之源,在有机营养物质代谢的同时必然伴随着能量代谢。本试验中,饲粮添加10、20及30mg/kg盐酸小檗碱均可显著或极显著提高试验兔的GE表观消化率,而添加20mg/kg盐酸小檗碱还可分别显著和极显著提高试验兔的DE利用率和GE利用率,表明小檗碱可改善饲粮有机营养物质在肉兔体内的代谢状况,提高饲粮的能量效率。饲粮添加小檗碱对肉兔氮平衡影响很大。与对照组相比,添加10和20mg/kg盐酸小檗碱可显著或极显著提高试验兔氮的表观消化率、氮利用率及消化氮利用率,而添加30mg/kg盐酸小檗碱可显著提高试验兔的氮利用率和消化氮利用率,表明小檗碱可改善肉兔氮代谢状况,提高氮的生物学价值和利用效率。
同时,本试验还发现,随着小檗碱添加量的提高,试验兔对饲粮DM、OM、CF、GE及氮的表观消化率表现出先升后降的趋势,显示小檗碱对肉兔营养物质利用效率的影响存在剂量效应,其原因可能是:第一,小檗碱对肠道常驻有益菌抑制作用较弱,而对有害菌抑制作用较强,这有利于肠道内环境的稳定[12-13];第二,小檗碱对平滑肌具有双重调节作用,低浓度时对平滑肌具有兴奋作用,而高浓度时会抑制平滑肌运动[14-15];第三,小檗碱对胰腺消化酶的分泌作用呈剂量效应关系,低浓度可刺激胰酶分泌,高浓度则起抑制作用[16-17]。刘岭等[18]在断奶仔猪饲粮中添加100mg/kg土霉素及200、500、1 000mg/kg三颗针提取物(相当于含小檗碱39.6、99.0和198.0mg/kg),结果表明,适量(500mg/kg)添加三棵针提取物可提高仔猪对饲粮营养物质的表观消化率,而添加量过低或过高时改善效果并不理想。王志祥等[19]与丁景华等[20]在1日龄艾维茵肉仔鸡基础饲粮中添加5mg/kg阿维拉霉素及0.5、2.0、3.5、5.0g/kg三颗针提取物(相当于含小檗碱99、396、693、990mg/kg),结果发现,添加2.0g/kg三颗针提取物可极显著提高十二指肠食糜中淀粉酶活性,而添加3.5和5.0g/kg三颗针提取物则会极显著降低饲粮粗蛋白质表观代谢率和十二指肠食糜中淀粉酶的活性。本试验结果与上述研究有相近之处。
3.2 小檗碱对肉兔盲肠内环境参数的影响
盲肠内容物pH系评价盲肠发酵状况的基本指标,受饲粮性质及盲肠内有机酸的生成、吸收与排出的综合影响,决定着盲肠微生物对底物的发酵利用效率,而引起盲肠内容物pH波动的根本原因是饲粮结构与营养水平[21]。本试验中,由于基础饲粮相同,故肉兔盲肠内容物pH基本不受小檗碱添加量的影响。MTD活性既可反映微生物发酵时脱氢酶传递氢的能力,又可反映微生物活性的高低。微生物内有各种各样的酶,其中参与生物氧化的重要酶有氧化酶和脱氢酶2大类,而以脱氢酶尤为重要[22]。脱氢酶把代谢产生的氢原子活化并传递给特定的受氢体,从而完成微生物的生物氧化过程中关键的一步[23]。MTD活性的提高意味着微生物发酵时氢传递加快,微生物活动能力增强[24]。本试验结果表明,饲粮添加10和20mg/kg盐酸小檗碱可提高肉兔盲肠内有益微生物的活性。NH3-N是盲肠内蛋白质和内、外源尿素分解的终产物,也是微生物合成蛋白质的原料,其在盲肠内的浓度受饲粮蛋白质降解度、盲肠壁吸收和食糜排空速度的影响[25]。作为盲肠内环境的重要参数,NH3-N浓度在一定程度上反映了盲肠微生物分解含氮物质产氨的速度及其对氨的摄取利用情况,反映了特定饲粮组成下蛋白质降解与合成之间所达到的平衡关系[26]。本试验结果表明,饲粮添加10和20mg/kg盐酸小檗碱可提高肉兔盲肠微生物利用碳架和氨合成MCP的效率,而MCP浓度的测定结果也印证了这一点。荣娜[27]给安装盲肠瘘管的獭兔饲喂盐酸小檗碱添加量分别为0、10、20及30mg/kg的饲粮,结果表明,饲粮添加小檗碱不会引起盲肠内容物pH的改变,但会提高 MTD活性,降低NH3-N浓度,促进MCP的合成,这与本试验结果一致。
4 结 论
① 在本试验条件下,饲粮添加小檗碱可改善肉兔对饲粮中DM、OM、CF、EE、GE和氮的利用效率,提高盲肠内容物MTD活性和MCP浓度,降低 NH3-N 浓度。
② 综合而言,肉兔饲粮中添加20mg/kg盐酸小檗碱较为适宜。
[1] IMANSHAHIDI M,HOSSEINZADEH H.Pharmacological and therapeutic effects of Berberis vulgaris and its active constituent,berberine[J].Phytotherapy Research,2008,22:999-1012.
[2] 国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999:213-223.
[3] 李波,朱维良,陈凯先.小檗碱及其衍生物的研究进展[J].药学学报,2008,43(8):773-787.
[4] YAW L S,LINDSEI S,KARMIN O.Redox regulation in health and disease:therapeutic potential of berberine[J].Food Research International,2011,44:2409-2417.
[5] NRC.Nutrient requirements of rabbits[S].2nd ed.Washington,D.C.:National Academy Press,1977.
[6] DE BLAS C,MATEOS G G.Feed formulation[M]//DE BLAS C,WISEMAN J.The nutrition of the rabbit.New York:CABI Publishing,1 9 9 8:2 4 1-2 5 3.
[7] HUMEYAN D B,NAGARAJA T G,MILLER G W,et al.Rumen microbial changes in cattle fed diets with or without salinomycin[J].Applied and Environmental Microbiology,1986,51:340-345.
[8] BRODERICK G A,KANG J H.Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J].Journal of Dairy Science,1980,63:64-70.
[9] WINDSCHITL P M,STERN M D.Effect of urea supplementation of diets containing lignosulfonate-treated soybean meal on bacterial fermentation in continuous culture of ruminal contents[J].Journal of Animal Science,1986,66:2948-2958.
[10] 杨凤.动物营养学[M].北京:中国农业出版社,2000.
[11] 冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.
[12] KYOKO H,KAZUKI M,YASUO N,et al.Antiviral activity of berberine and related compounds against human cytomegalovirus[J].Bioorganic & Medicinal Chemistry Letters,2007,17:1562-1564.
[13] 王志祥,王自恒,刘岭,等.三颗针提取物对仔猪生长及肠道菌群和挥发性脂肪酸的影响[J].西北农林科技大学学报:自然科学版,2 0 0 8,3 6(6):3 4-3 8,4 4.
[14] TANG J,FENG Y B,TSAO S,et al.Berberine and coptidis rhizoma as novel antineoplastic agents:a review of traditional use and biomedical investigations[J].Journal of Ethnopharmacology,2009,126:5-17.
[15] IAUK L,COSTANZO R,CACCAMO F,et al.Activity of Berberis aetnensis root extracts on Candida strains[J].Fitoterapia,2007,78:159-161.
[16] ALAN W B,CORMAC T T,DAVID J B.Non-antibiotic anti-diarrhoeal drugs:factors affecting oral bioavberberine and loperamide in intestinal tissue[J].Advanced Drug Delivery Reviews,1997,23:111-120.
[17] KOSALEC I,GREGUREK B,KREMER D,et al.Croatian barberry (Berberis croatica Horvat):a new source of berberine:analysis and antimicrobial activity[J].World Journal of Microbiology & Biotechnology,2009,25:145-150.
[18] 刘岭,王志祥,刘建华,等.三颗针提取物对断奶仔猪生长、养分表观代谢率和血清指标的影响[J].饲料研究,2006(6):20-23.
[19] 王志祥,王自恒,丁景华,等.三颗针提取物对肉仔鸡抗氧化水平和脂类代谢的影响[J].西北农林科技大学学报:自然科学版,2006,34(10):16-20.
[20] 丁景华,王志祥,姜树林,等.三颗针提取物对肉仔鸡生长、养分表观代谢率和消化酶活性的影响[J].饲料博览,2006(6):1-4.
[21] RACHEL B,GIDENNE T,VERNAY M,et al.In vitro study of circadian variations of the cecal fermentation pattern in postweaned and adult rabbits[J].Journal of Animal Science,1995,73:128-135.
[22] 李广贺,张旭,卢晓霞,等.土壤残油生物降解性与微生物活性[J].中国地质大学学报,2002,27(2):181-185.
[23] 刘志恒.现代微生物学[M].北京:科学出版社,2002:418-420.
[24] JONES G A,HUMPHREY B A.Evaluation of dehydrogenase based on tetrazolium reduction for rapid in vitro estimation of fermentation activity in rumen contents[J].Canada Journal of Animal Science,1978,58:501-509.
[25] FORSYTHE S J,PARKER D S.Ammonia-nitrogen turnover in the rabbit caecum and exchange with plasma urea-N[J].British Journal of Nutrition,1985,54:285-292.
[26] COPPINGS R,SHANHBEDIZADEH M,ANDREWS G.Utilization of urea by the domestic rabbit:effect of age[J].Journal of Applied Rabbit Research,1988,11:212-221.
[27] 荣娜.小檗碱促进獭兔生长代谢、盲肠微生物活力及免疫性能的研究[D].硕士学位论文.扬州:扬州大学,2007:40-48.

