表面印迹磁性壳聚糖对水溶液中钍离子的吸附行为
黄国林,陈中胜,梁喜珍,Shi Jeffrey
(1.东华理工大学放射性地质与勘探技术国防重点学科实验室,江西 南昌 330013;2.悉尼大学化学与生物分子工程系,澳大利亚 悉尼 NSW 2006)
钍属于锕系元素,在地球上钍元素的贮藏量比铀元素还要丰富,作为核燃料具有广阔的应用前景[1].但钍又是一种放射性的重金属元素,释放出γ射线,能对人体产生放射性辐射损伤.通过被污染的饮水和食物链等途径,钍可能会进入人体并造成潜在威胁.从溶液中分离钍的方法主要包括色谱柱分离、固相萃取、微球菌分离、水凝胶膜以及吸附等[2-4].吸附剂包括凝灰岩、蒙脱石、珍珠岩、凹凸棒石、铝交联累托石、泥炭以及胶原纤维等[5-8].近年来,壳聚糖改性技术及其对放射性金属元素的吸附取得了一定的突破[9],但将该技术应用于对钍的吸附方面的研究鲜见报道.由于磁性壳聚糖(SI-MC)中氨基和羟基含量大,对钍有双重螯合作用,能提高对水溶液中钍的吸附能力.
本研究以壳聚糖为原料,纳米Fe3O4为磁性核心,钍离子为模板剂,环氧氯丙烷为交联剂合成表面印迹SI-MC,并研究各工艺参数对吸附效果的影响,以确定工艺条件,建立吸附过程等温式和动力学模型.
1 试验材料与方法
1.1 试 剂
壳聚糖(上海国药集团化学试剂有限公司),相对分子量为1.3×105,脱乙酰度为90%.所用化学试剂均为分析纯.试验用水为去离子水.
1.2 表面印迹磁性壳聚糖制备
将1 g壳聚糖溶于100 mL体积分数为2%的醋酸中,制成质量分数为1%的壳聚糖溶液.加入0.5 g纳米磁性Fe3O4颗粒,在HS-600D超声机(宁波桦升超声波机械厂)超声分散30 min后,置于HH-2数显恒温水浴锅(金坛金城国胜实验仪器厂)中,温度设置为60℃.加入4 mL环氧氯丙烷,用RW-20电动搅拌器(上海硕光电子科技有限公司)搅拌反应3 h,沉淀物分别用无水乙醇、丙酮、去离子水清洗至中性,60℃真空干燥5 h,得磁性壳聚糖.
取磁性壳聚糖0.5 g,加入100 mL质量浓度50 μg·mL-1Th(NO3)4溶液,震荡 5 h,用去离子水洗至中性,60℃真空干燥2 h.用浓度为0.5 mol·L-1HCl的乙醇溶液洗脱,直至检测不出Th4+,再用0.1 mol·L-1NaOH浸泡,过滤洗涤至中性,再分别用乙醇、乙醚洗涤,60℃真空干燥,制得表面印迹磁性壳聚糖(SI-MC).对SI-MC研磨后,采用 ZNS-200标准分样筛(北京兴时利和科技发展公司),筛分出粒径为80~120 μm颗粒待用.
1.3 样品表征
SI-MC的比表面积采用ASAP 2010微孔分析仪(美国麦克公司)测定,平均孔径采用Erba Model 200压汞仪(德国Carlo Erba公司).将SI-MC研成粉末后,真空干燥12 h,采用KBr压片法用Nicolet 380智能傅立叶红外光谱仪(美国尼高力公司)测定吸附前后官能团;采用镀碳作为导电介质,用EX-250 X射线能谱仪(上海天美科技有限公司)定点测定吸附钍前后能谱.
1.4 钍标准溶液的配制
准确称取2.3795 g硝酸钍[Th(NO3)4·4H2O]于100 mL烧杯中,加入少量水溶解,加入20 mL HCl,加热蒸干,再加入40 mL 浓度0.1 mol·L-1的 HCl溶液使其溶解,定容至1000 mL容量瓶中,此溶液钍的质量浓度为1 mg·mL-1.不同质量浓度的钍溶液可从钍标准溶液中稀释得到.
1.5 吸附试验
取 50 mL 100 μg·mL-1含钍溶液于 250 mL 锥形瓶中,加入一定量的SI-MC吸附剂,用0.5 mol·L-1H2SO4或0.5 moL·L-1NaOH 溶液调节溶液的pH值,放置在HY-4型调速多用振荡器(荣华仪器制造有限公司,江苏)30℃恒温震荡至平衡,抽滤后测定滤液钍的质量浓度,钍的测定采用偶氮胂Ⅲ分光光度法(GB/T 12690.15—1990).吸附过程的去除率和吸附容量计算如下:
式中:c0,ce分别为初始质量浓度和平衡时质量浓度,mg·L-1;V为溶液体积,mL;m为吸附剂质量,g;E为吸附去除率,%.
2 结果与讨论
2.1 吸附剂特征
SI-MC呈球形,粒径 80 ~120 μm,比表面积74.6 m2·g-1,平均孔径 814 nm.图 1 为 SI-MC 吸附钍前后的红外谱图.
由图1可知:a和 b的584 cm-1处为 Fe3O4特征吸收峰,说明Fe3O4包埋在壳聚糖内部稳定.在b的1510 cm-1处出现一个明显吸收峰,为Th-OH特征峰,说明SI-MC成功吸附了钍.
图2为SI-MC吸附钍前后X射线能谱图.由图2b可知:吸附后出现钍峰,表明SI-MC具有吸附钍的能力.
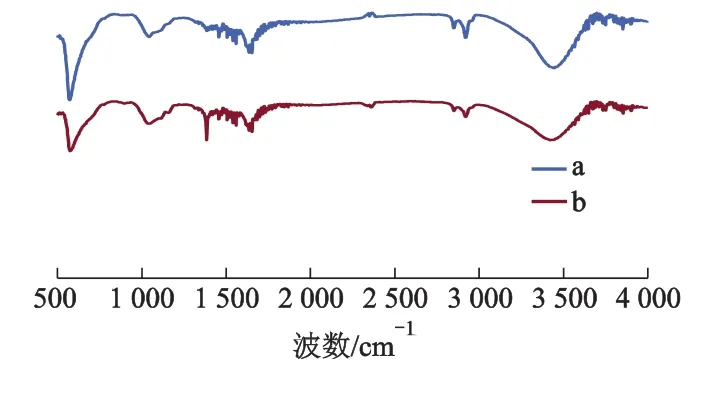
图1 SI-MC吸附钍前后红外谱图
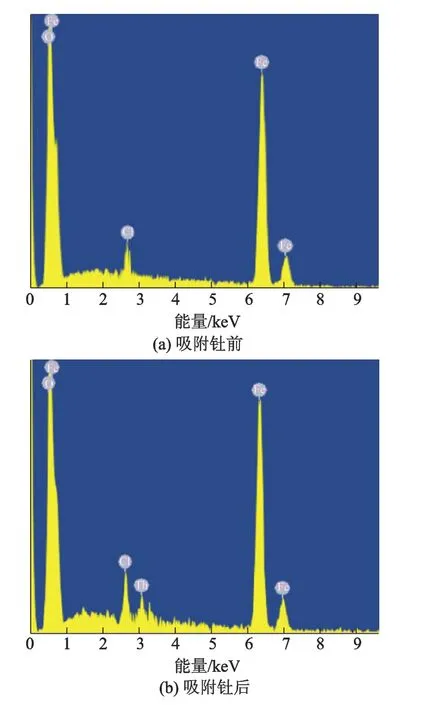
图2 SI-MC吸附钍前后X射线能谱图
2.2 用量的影响
取50 mL质量浓度为100 μg·mL-1含钍溶液,加入 SI-MC 的质量浓度分别为 0.4,0.6,0.8,1.0,1.2 和1.4 mg·mL-1,调节溶液 pH=3.5,30 ℃恒温震荡至平衡,测定滤液钍的质量浓度,考察SI-MC质量浓度对吸附效果的影响,结果见图3.
由图3可知:随着SI-MC质量浓度增大,钍去除率逐渐增加;当 SI-MC质量浓度为1.2 mg·mL-1时,钍去除率为95.1%;继续加大SI-MC质量浓度,钍去除率基本保持不变,确定适宜SI-MC质量浓度为 1.2 mg·mL-1.
2.3 pH 值影响
取于50 mL 质量浓度为 100 μg·mL-1含钍溶液,SI-MC 质量浓度为为1.2 mg·mL-1,用质量浓度为0.5 mol·L-1H2SO4或0.5 mol·L-1NaOH 调节溶液 pH 为分别为1.0,2.0,2.5,3.0,3.5,4.0,5.0,6.0,在30℃恒温震荡至平衡,测定滤液钍的质量浓度,考察pH值对吸附效果的影响,结果如图4所示.
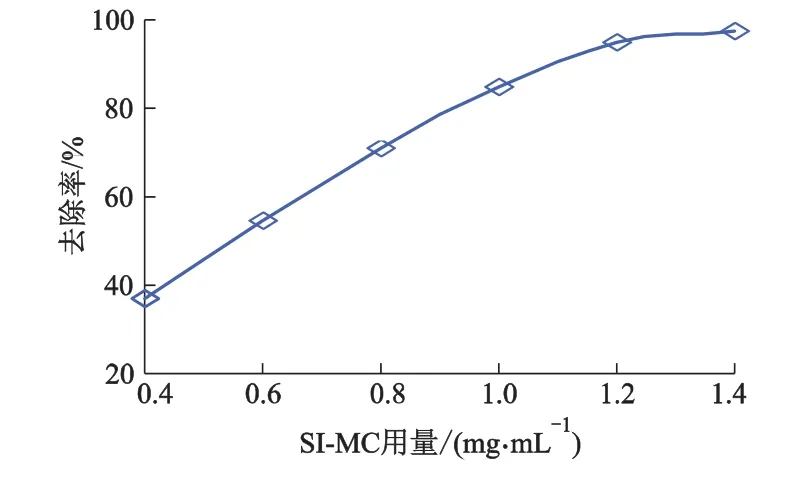
图3 SI-MC对吸附效果的影响
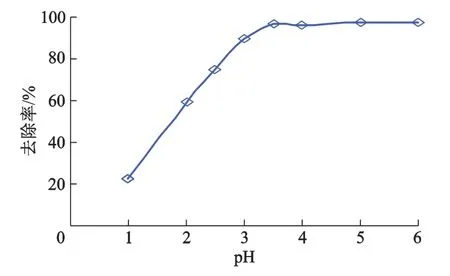
图4 pH对吸附效果的影响
吸附过程中,pH值可以改变吸附剂的表面电荷,对吸附效果影响较大.从图4看出,随着pH值升高,去除率逐渐增加,当pH=3.5时,钍的去除率达到95.6%;继续升高pH值,去除率基本保持不变.pH值较低时,SI-MC表面的氨基基团被质子化形成═ NH3+,H+与Th4+形成了竞争吸附,占据了SI-MC的有效吸附位,抑制了SI-MC与钍的螯合,降低了氨基与钍的螯合能力.在1.0<pH<3.5时,SIMC对Th(Ⅳ)的吸附除了离子交换还存在表面络合吸附,随着pH的增加,Th(Ⅳ)的水解加剧,有利于SI-MC对溶液中Th(Ⅳ)的吸附.pH>3.5时,出现白色沉淀,致SI-MC呈乳浊状态,不利于后续固液分离,本试验选定适宜的pH值为3.5.
2.4 吸附等温线
吸附等温线可以确定吸附剂与吸附质之间的相互作用和吸附机理.本研究采用Langmuir和Freundlich模型来拟合吸附过程的试验数据,即
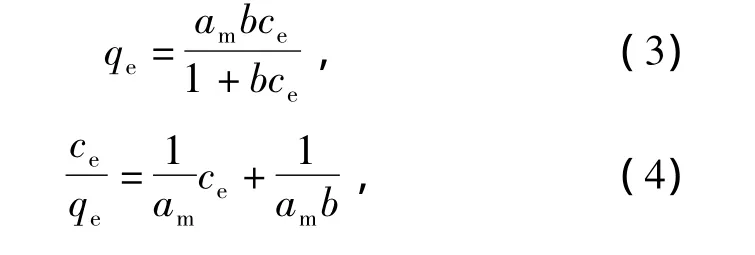
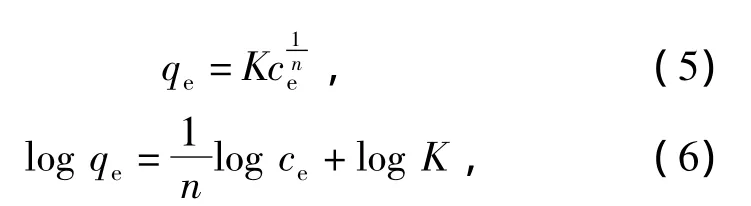
式中:am,b为 Langmuir等温式参数,mg·g-1,mL·mg-1;K,n为 Freundlich等温式参数,mL·mg-1;qe,qt分别为平衡时和 t时刻吸附容量,mg·g-1.用 Langmuir及 Freundlich模型对图 3 拟合,结果见图 5,6.

图5 Langmuir等温线
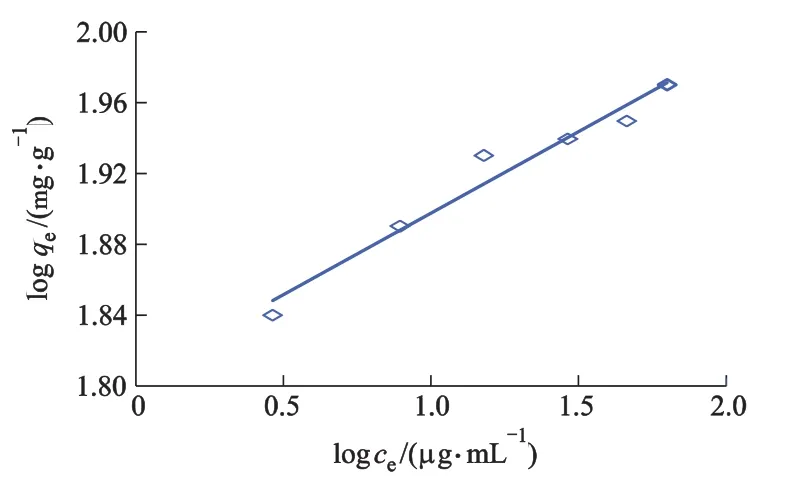
图6 Freundlich等温线
从吸附等温式相关参数计算结果可知:SI-MC对Th(Ⅳ)的吸附过程同时符合Langmuir和Freundlich吸附等温模型(Langmuir的 R2=0.9996;Freundlich的 R2=0.9651),但Langmuir模型能更好拟合试验数据,得到最大吸附容量92.5 mg·g-1,大于文献中其他材料对钍吸附容量.此外,Langmuir等温式本质特征可用式(7)分离因子RL进行揭示,即
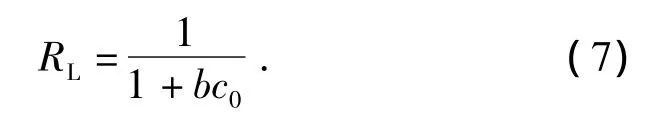
RL表示吸附剂对吸附质的亲和力,在0~1范围内,其值越大,表示吸附剂对吸附质的亲和力越大,吸附强度越大,本试验模拟出来的 RL较小(RL=0.089),表明SI-MC对Th(Ⅳ)的吸附既有氨基和羟基的单分子层螯合吸附,还伴随有氢键和物理吸附等,属于多分子层吸附.Freundlich常数中为0.09,说明吸附过程易于发生.
2.5 吸附动力学
取50 mL 质量浓度100 μg·mL-1含钍溶液,加入质量浓度为1.2 mg·mL-1SI-MC,调节溶液pH=3.5,在298,303和313 K 时,控制恒温震荡时间分别为20,40,60,80,100,120 和150 min,考察振荡时间对吸附容量的影响,结果见图7.由图7可知:随着吸附时间增加,吸附容量迅速增大,当吸附时间为2 h时,吸附过程趋于平衡,说明适宜吸附时间为2 h.
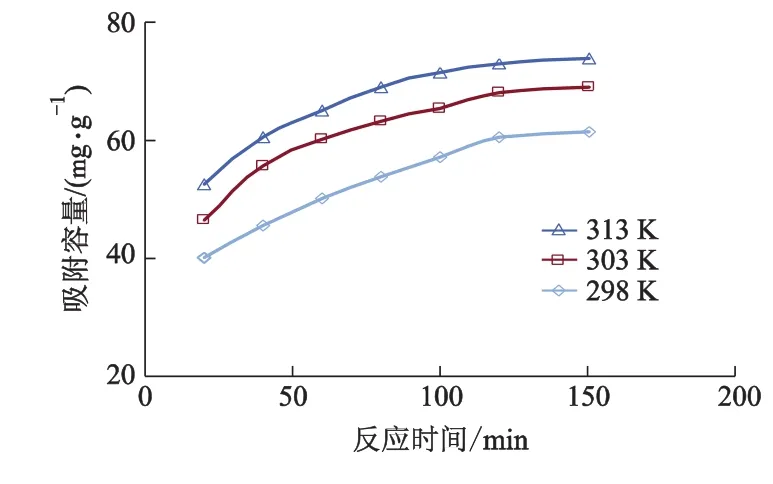
图7 反应时间对吸附容量的影响
为了研究吸附过程的动力学,更好地揭示吸附规律,本研究采用拟一级动力学模型式(8)和拟二级动力学模型式(9)进行拟合,即

对图7中试验数据拟合结果如图8,9所示,相关动力学参数列于表1.

图8 钍吸附的拟一级动力学
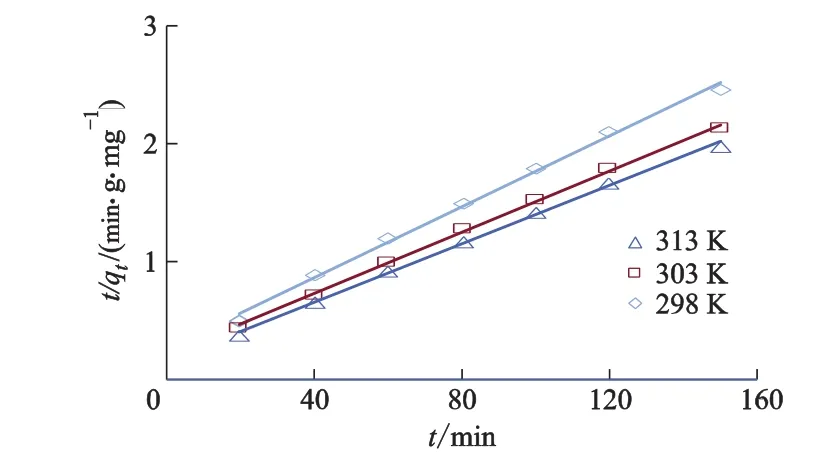
图9 钍吸附的拟二级动力学
除了相关系数(R2),本研究还采用了式(10)的误差平方和SSE来评判磁性壳聚糖SI-MC吸附钍动力学模型的可靠性,即
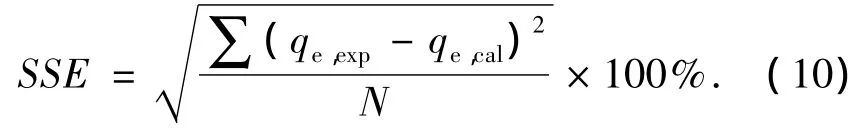
R2越大,SSE越低,拟合的效果越好.由表1可知:SI-MC吸附钍的过程用拟二级动力学方程(R2>0.99,SSE <1.93%)拟合优于一级动力学方程(R2>0.93,SSE <16.21%).

表1 钍吸附拟一级和二级动力学速率参数的比较
2.6 吸附剂再生
取吸附钍饱和后的SI-MC 0.2 g,加入20 mL的1 mol·L-1H2SO4溶液中,振荡4 h进行静态脱附.脱附后,在已定的适宜工艺条件下,对100 μg·mL-1含钍溶液进行吸附,结果发现,重复使用4次后吸附率仅降低了5.3%,说明SI-MC易回收,脱附后氨基等螯合配位点不被破坏,无溶解流失发生,可重复使用至少4次.
3 结论
制备的表面印迹磁性壳聚糖SI-MC能有效地吸附水溶液中的钍,适宜吸附条件:用量1.2 mg·mL-1,pH=3.5,温度为30 ℃,平衡时间为2 h.FTIR和EDS测试结果表明:钍成功地被吸附在SI-MC上;吸附过程用Langmuir等温式优于用Freundlich吸附等温式拟合,最大吸附容量达到92.5 mg·g-1;采用拟二级动力学模型比拟一级动力学模型能更好地拟合试验数据.
References)
[1]李功顺,朱 樱,齐 玲,等.极谱法同时测定岩石中的微量铀钍[J].铀矿地质,2009,25(4):240-243.Li Gongshun,Zhu Ying,Qi Ling,et al.Simultaneous determination of micro uranium and thorium in rocks by polarography[J].Uranium Geology,2009,25(4):240-243.(in Chinese)
[2]Sabale S R,Jadhay D V.Sorption study of U(VI),Th(IV)and Ce(III)on poly[dibenzo-18-crown-6]in larginine to develop sequential column chromatographic separation method[J].Journal of Radioanalytical and Nuclear Chemistry,2010,284(2):273-278.
[3]Funda A A,Mustafa S.Solid phase extraction and preconcentration of uranium(VI)and thorium(IV)on Duolite XAD761 prior to their inductively coupled plasma mass spectrometric determination [J].Talanta,2007,72(1):187-192.
[4]Hegazy E A,El-Gammal B.Evaluation of anionic-and cationic-supported hydrogel membranes for sorption of Th(IV)and U(VI)ions from nitric acid medium[J].Journal of Applied Polymer Science,2006,102(1):320-332.
[5]Humelnicu D,Drochioiu G.Kinetic and thermodynamic aspects of U(VI)and Th(IV)sorption on a zeolitic volcanic tuff[J].Journal of Radioanalytical and Nuclear Chemistry,2006,270(3):637 -640.
[6]Chen L,Yu X J.The sorption of Th(IV)ions onto montmorillonite:the effect of pH,ionic strength and fulvic acid[J].Adsorption Science& Technology,2006,24(4):301-310.
[7]Talip Z,Eral M,Hicsonmenz U.Adsorption of thorium from aqueous solutions by perlite[J].Journal of Environmental Radioactivity,2009,100(2):139-143.
[8]Fan Q,Wu W.Effect of humic acid,fulvic acid,pH and temperature on the sorption-desorption of Th(IV)on attapulgite[J].Radiochimica Acta,2008,96(3):159-165.
[9]王彩霞,刘云海,花 榕,等.壳聚糖及其衍生物吸附铀的研究进展[J].铀矿地质,2010,26(5):313-319.Wang Caixia,Liu Yunhai,Hua Rong.et al.Progress of research on the adsorption of chitosan and its derivatives to uranium [J].Uranium Geology,2010,26(5):313-319.(in Chinese)

