SHP-2和转化生长因子β在中老年患者宫颈鳞癌组织中的表达
宋 利
(沈阳医学院奉天医院妇产科,辽宁 沈阳 110024)
肿瘤的发生与信号转导密切相关〔1〕。蛋白酪氨酸磷酸酶是一种经典的非跨膜性蛋白酪氨酸磷酸酶,在信号转导过程中起关键作用,并在许多生理调节过程中也具有重要作用,其主要通过调节细胞内酪氨酸的磷酸化水平来调控细胞的生长、增殖、分化、代谢、迁移、适应、防御、基因转录和凋亡等〔2〕。目前有证据表明,蛋白酪氨酸磷酸酶1B与肿瘤具有相关性〔3〕。SHP-2是一种非受体型蛋白酪氨酸磷酸酶,其介导的信号转导异常与多种疾病包括肿瘤的发生和发展密切相关〔4〕。大量研究提示,转化生长因子β(TGF-β)可能参与了宫颈癌的发生与发展〔5~7〕。而 SHP-1/2 能够调节 TGF-β 介导的信号分子(如src kinases)的活性〔8,9〕,基于此,课题组假设 SHP-2 在宫颈癌的形成和发展中发挥着重要的作用。本实验采用分子生物学技术从蛋白和基因水平观察正常宫颈、宫颈上皮内肿瘤(CIN)和宫颈鳞癌组织中SHP-2和TGF-β的表达。
1 资料与方法
1.1 标本来源 纳入2009年7月至2012年4月在沈阳医学院奉天医院妇产科住院治疗的患者。其中宫颈鳞癌患者120例,年龄45~72岁,平均(43±5)岁;CIN患者80例,年龄42~72岁,平均(45±4)岁;宫颈正常患者30例,年龄43~67岁,平均(42±3)岁。所有患者在取材前均未经任何治疗,均经病理诊断证实,排除宫颈腺癌患者。所有患者均签署知情同意书。
1.2 方法
1.2.1 免疫组化染色检测宫颈组织SHP-2和TGF-β的表达取宫颈组织,10%甲醛固定后,脱水,浸蜡,包埋,行4μm厚连续切片,切片经二甲苯脱蜡,梯度乙醇水化后微波修复抗原;3%过氧化氢阻断内源性过氧化物酶;在兔抗SHP-2和TGF-β多克隆抗体(1∶500;Santa Cruz公司)中4℃孵育过夜;生物素标记的羊抗兔IgG中孵育2 h(37℃);DAB显色,显微镜下控制反应时间,蒸馏水洗涤终止反应,苏木精复染,自来水冲洗,返蓝;梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜观察。用PBS代替一抗作为阴性对照。每例标本随机取3个视野(100倍),应用 Image-Pro Plus图像分析软件测量 SHP-2和TGF-β的IOD,取平均值。
1.2.2 实时RT-PCR检测宫颈癌组织SHP-2 mRNA的表达按Trizol试剂说明提取各组宫颈标本组织细胞总RNA,并检测RNA完整性和纯度,利用cDNA反转录试剂盒将RNA反转录成 cDNA。根据 GenBank(http://www.ncbi.nlm.nih.gov/Genbank/)的人SHP-2 mRNA序列,以primer5.0设计其上、下游引物序列。SHP2:上游:5'-GGA GGG CGG GAG GAA CAT GAC ATC-3',下游:5'-GGG AGA GGG TGA AAG TCC ACA TCT AT-3';β-actin:上游 5'-CAT CTC TTG CTC GAA GTC CA-3',下游:5'-ATC ATG TTT GAG ACC TTC AAC A-3'。利用特异引物和PCR扩增试剂盒分别合成SHP-2和β-actin基因。PCR反应条件:94℃,预变性 5 min。94℃变性 45 s,55℃退火 45 s,72℃延伸1 min,共40个循环。72℃延伸10 min。应用 Rotor-Gene 3000荧光实时定量PCR仪(香港基因有限公司)的Comparative Delta-delta Ct法对获得的荧光曲线结果进行分析,以同一样品目的基因扩增产物和内参β-actin的扩增产物的比值确定目的基因的表达水平。
1.2.3 Western印迹法检测宫颈癌组织SHP-2蛋白的表达分别取各组宫颈标本组织,用细胞裂解液提取蛋白,Bradford方法测蛋白浓度;调节蛋白浓度一致,取等量蛋白样品,行SDSPAGE电泳分离蛋白,然后用半干式电转的方法将蛋白质转移至PVDF膜上,5%牛血清白蛋白37℃封闭2 h,1∶200的兔抗SHP-2单克隆抗体中4℃孵育过夜;生物素标记的羊抗兔IgG中37℃孵育2 h,DAB显色,见有清晰条带出现即用双蒸水终止显色。所得图像用扫描仪扫描,应用北京航天航空大学CM-2000B型生物医学图像分析系统测量条带的吸光度值,将目的蛋白吸光度值与GAPDH的比值作为结果。
1.3 统计学方法 采用SPSS16.0软件进行分析,结果用x±s表示,组间比较采用单因素方差分析,两两比较采用q检验。
2 结果
2.1 正常宫颈、CIN及宫颈鳞癌组织TGF-β的表达 免疫组化染色结果显示在正常宫颈组织仅有个别标本中可见TGF-β的表达,显示出弱的棕黄色,主要集中在胞质;CIN标本中TGF-β阳性表达的数量较正常宫颈标本多,但染色依旧较弱;宫颈鳞癌组织TGF-β阳性标本数目明显增多,染色也相对较深,见图1。应用Image-Pro Plus图像分析软件对所有标本TGF-β的IOD值进行测量,结果显示在正常宫颈、CIN及宫颈鳞癌组织,TGF-β的表达分别为(0.934 ±0.652),(2.673 ±0.638),(3.784±0.538),三者间两两比较差异显著(P<0.05)。

图1 正常宫颈、CIN及宫颈鳞癌组织TGF-β的表达(免疫组化染色,×100)
2.2 正常宫颈、CIN及宫颈鳞癌组织SHP-2的分布与表达免疫组化染色结果显示SHP-2的表达以胞质染色阳性为主,也有少许胞核染色阳性,见图2。与正常宫颈组织比较,CIN及宫颈鳞癌组织中SHP-2的表达明显增高(P<0.05),且宫颈鳞癌组织中SHP-2的表达明显高于CIN(P<0.05),见表1。
2.3 正常宫颈、CIN及宫颈鳞癌组织SHP-2 mRNA的表达宫颈鳞癌组织中SHP-2 mRNA表达最高,其次是CIN,在正常宫颈中表达最低,见表1。
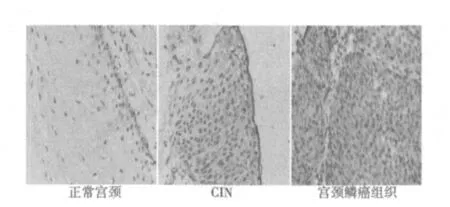
图2 正常宫颈、CIN及宫颈鳞癌组织SHP-2的表达(免疫组化染色,×100)
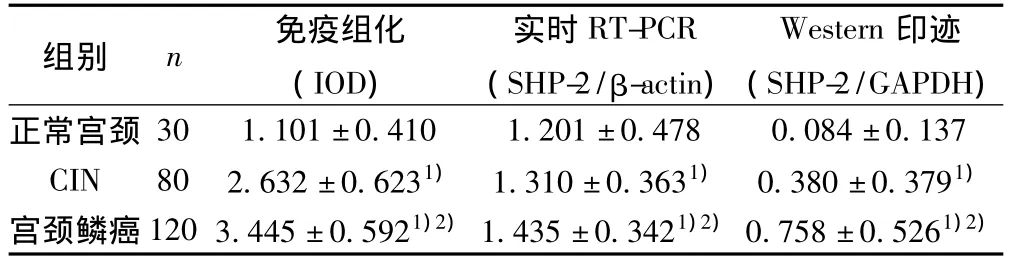
表1 正常宫颈、CIN及宫颈鳞癌组织SHP-2蛋白及mRNA的表达(x±s)
2.4 正常宫颈、CIN及宫颈鳞癌组织SHP-2蛋白的表达Western印迹可见,在正常宫颈组织中几乎看不到SHP-2蛋白的表达,而在宫颈鳞癌组织中SHP-2蛋白条带较深,表达最多,CIN组织中的SHP-2蛋白条带介于正常宫颈和宫颈鳞癌组织之间,见图3,三者间两两比较差异显著(P<0.05),见表1。

图3 Western印迹检测正常宫颈、CIN及宫颈鳞癌组织SHP-2的表达
3 讨论
SHP-2是一种由PTPNII基因编码的广泛分布在胞浆中的蛋白酪氨酸磷酸酶,含有2个SH结构域和1个催化功能结构域。其作为细胞因子、生长因子及其他胞外刺激因素的下游信号分子参与了细胞的增殖、分化、死亡等过程〔10〕。同时一些研究发现,其与一些癌症密切相关。然而赵硕〔11〕对癌症组织中SHP-2 mRNA水平进行检测并未发现SHP-2在癌症组织及正常组织中表达明显差异,发现了与其同源性较高的pseudo基因的差异表达。但也有研究显示〔12〕,在人体几种主要器官,包括肺癌、胃癌、卵巢癌、直肠癌、乳腺癌、结肠癌等的正常和癌变组织中,SHP-2在蛋白和mRNA水平上均产生了差异表达。且研究发现其在一些恶性肿瘤中高度活化,可能与癌症的发生离不开信号转导改变有关。而SHP-2在从细胞表面到细胞核的信号传导通路中扮演重要角色,主要包括JAK-STAT途径、Ras-MAPK途径及PI3K途径。而且SHP-2通过对细胞内磷酸化的酪氨酸残基去磷酸化调节细胞的增殖与分化,而异常的增殖和分化正是肿瘤细胞的特征之一。
本研究发现SHP-2在宫颈鳞癌组织中表达最高,CIN组织次之,正常宫颈组织中表达最低,与孟斐〔13〕测得的SHP-2在宫颈癌患者血清中SHP-2的表达升高相一致。提示SHP-2参与了宫颈癌的发生,且与癌症的分型密切相关。SHP-2的过度表达参与了宫颈癌的发生。
TGF-β是功能复杂的细胞因子,具有调节细胞生长、分化、血管形成、细胞凋亡等多种功能,还参与细胞外基质的重建、间质细胞的产生和机体抗肿瘤免疫等,因此其与很多肿瘤的发生、发展有密切关系〔14,15〕。本实验发现 TGF-β1在宫颈鳞癌组织中表达最高,CIN组织次之,正常宫颈中表达最低,验证了TGF-β在宫颈癌形成中的作用。
总之,本实验从蛋白和基因水平证实了SHP-2在宫颈鳞癌组织高表达,可能参与了宫颈癌的形成及分型,并发现了SHP-2和TGF-β在宫颈癌组织中表达具有一致性,但具体的作用机制及信号调节通路还有待进一步研究。
1 孙桂丽,王大鹏.蛋白激酶C在细胞及肿瘤细胞凋亡中的作用〔J〕.中国组织工程研究与临床康复,2009;13(7):1360-3.
2 卢 斌,吴 鸿,蔡在龙,等.大鼠蛋白酪氨酸磷酸酶1B基因靶向RNA干扰重组腺病毒的构建〔J〕.中国组织工程研究与临床康复,2008;12(37):7302-5.
3 孔德姣,石 琨.蛋白酪氨酸磷酸酶1B在肿瘤发生和发展中的作用〔J〕. 肿瘤,2011;31(12):1122-6.
4 桂 秋.Shp2参与调控IL-22活化肿瘤细胞MAPK通路〔D〕.扬州:扬州大学,2010.
5 张 競,李胜泽.TGF-β1及Smad4蛋白在子宫颈癌组织中的表达及其意义〔J〕.实用癌症杂志,2008;23(5):465-8.
6 陈文殊,吕杰强,徐 峰,等.宫颈癌组织中P-ERK和TGF-β1蛋白的表达及其相关性〔J〕.浙江医学,2010;32(8):1177-9.
7 陈 星,郑曙民,籍海虹,等.子宫颈癌组织中VEGF与TGF-β1间关系的探讨〔J〕.中国肿瘤临床,2004;31(22):1290-2.
8 Mittal Y,Pavlova Y,Garcia-Marcos M,et al.Src homology domain 2-containing protein-tyrosine phosphatase-1(SHP-1)binds and dephosphorylates G(alpha)-interacting,vesicle-associated protein(GIV)/Girdin and attenuates the GIV-phosphatidylinositol 3-kinase(PI3K)-Akt signaling pathway〔J〕.J Biol Chem,2011;286(37):32404-15.
9 Mertsching E,Bafetti L,Hess H,et al.A mouse Fcgamma-Fcepsilon protein that inhibits mast cells through activation of FcgammaRIIB,SH2 domain-containing inositol phosphatase 1,and SH2 domain-containing protein tyrosine phosphatases〔J〕.J Allergy Clin Immunol,2008;121(2):441-7.
10 胡 波.酪氨酸蛋白磷酸酶SHP-2和白血病抑制因子影响HL-60细胞增殖与分化过程中的相互关系〔D〕.上海:第二军医大学,2002.
11 赵 硕.癌症组织中SHP-2在mRNA水平上的表达〔D〕.长春:吉林大学,2007.
12 王德利.SHP2在正常与癌变组织中表达差异的研究〔D〕.长春:吉林大学,2007.
13 孟 斐.宫颈病变患者SHP-2与CD4+T表达意义的研究〔J〕.当代医学,2010;16(31):46-7.
14 郭宝良,闫朝岐,仲 雷,等.Smad4 siRNA对转化生长因子β诱导Ⅰ型胶原表达的作用〔J〕.中国组织工程研究与临床康复,2009;13(11):2062-5.
15 刘 苹,李 平,彭 艳,等.原代成纤维细胞和纤维肉瘤细胞自分泌转化生长因子β1浓度检测及对转化生长因子β1增殖的调节〔J〕.中国组织工程研究与临床康复,2011;15(41):7669-72.

