奥卡西平对癫患儿外周血MDR1表达的影响
戴园园 沈栋林 李 蕊 孙明霞
徐州医学院附属医院儿科 徐州 221000
1 材料与方法
1.1 临床资料
1.1.2 对照组:对照组来自于同期上呼吸道感染住院患儿,年龄6个月~12岁,平均(4.5±3.8)岁,既往无抽搐史,无慢性病史,无长期服用任何药物史。以上3组儿童年龄、性别差异无统计学意义(P>0.05),留取血液标本征得家长同意。
1.2 方法
1.2.1 半定量RT-PCR检测:抽取外周静脉2mL,用淋巴细胞分离液分离单个核细胞,Trizol试剂提取细胞RNA。引物设计:β-actin为内参标准,依据GenBankBC002409应用DNAStar软件设计为扩增片段长度526bp:上游5’-CTTAGTTGCGTTACACCCTTTC-3’,下 游:5’-GT-CACCTTCACCGTTCCAGT-3’;MDR1引物扩增片段长度165 bp:上游5’-AGCCCATCCTGTTTGACTGC-3’,下游5’-TGATGCGTGC2CATGCTCCTT-3’;RT-PCR采用 Tukala试剂盒 (大连宝生物公司)、PE9600基因扩增仪 (美国PERKINELMER公司)。反应体系包含5×Buffer 4μL,10 mmol/L dNTPs混合液1μL,上、下游引物各1μL,混合酶1 μL,溶解液3μL,上述反转录生成的cDNA 1μL,无RNase ddH2O 8μL,共20μL。置于PCR仪中,37℃15min逆转录,95℃15min激活进入PCR循环:94℃预变性3min,94℃变性30s,57.5℃退火30s,72℃延伸1min,内参进行33个循环。取RT-PCR产物12μL,1μL 6×溴酚兰,TAE应用TAE电泳缓冲液,2%琼脂糖凝胶电泳,电压100μV、40 mA,45min后紫外成像系统 (Vilber凝胶成像分析系统,法国Lourmat公司)观察电泳结果并照相。以特定扩增产物条带灰度值与β-actin扩增产物条带灰度值之比代表MDR1的表达水平。
1.3 统计学处理 采用SPSS 16.0软件进行处理,正态分布数据以均数±标准差表示,数据经方差齐性检验,用完全随机设计的单因素方差分析进行各组间比较,用SLD-t检验方法进行两两比较。P<0.05为差异有统计学意义。
2 结果
OXC组外周血 MDR1-mRNA表达在用药后6个月和12个月较服药前均有增高(F=6.32,P<0.05);OXC组和CBZ组2组患儿外周血MDR1-mRNA表达在用药后6个月和12个月较服药前亦有增高(F=5.43,P<0.05);用药后6个月及12个月,OXC组外周血 MDR1-mRNA相对表达量和CBZ组比较差异无统计学意义(F=2.68,P>0.05)。见图1、表1。1、2、3、4分别为OXC组治疗后12个月、OXC组治疗后6个月、OXC组治疗前和对照组;5、6、7、8分别为CBZ组治疗后12个月、CBZ组治疗后6个月、CBZ组治疗前和对照组。
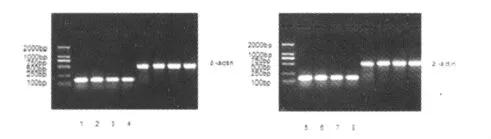
图1 MDR1/β-actin的 RT-PCR电泳结果
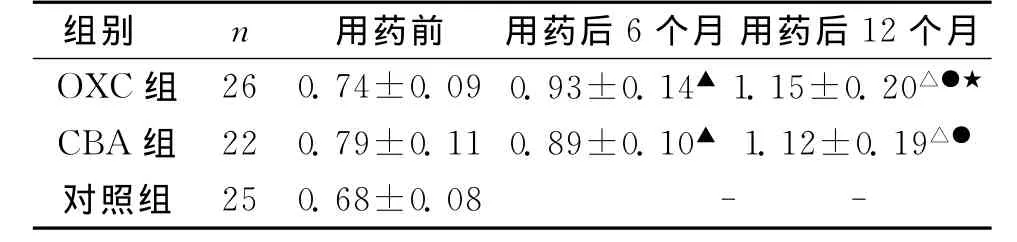
表1 3组患儿不同时间点外周血MDR1/β-actin比值
3 讨论
有体外实验显示[8],OXC、CBZ及其活性代谢产物均是Pgp的底物;Clinckers等[9]应用微量透析法研究显示OXC可以增加癫大鼠血脑屏障Pgp含量,而加用耐药蛋白抑制剂丙磺舒或维拉帕米后OXC的抗惊厥疗效显著增强;Marchi等[10]应用RT-PCR法观察OXC耐药癫患者切除脑组织发现 MDR1-mRNA表达增高,推测难治性癫脑内MDR1和Pgp的表达增高和药物之间有一定关联。本研究中选择了OXC单药治疗的癫患儿,经过1a的观察,结果显示,口服OXC半年后,患儿外周血中 MDR1-mRNA表达量即开始增加,1a后MDR1-mRNA表达量较半年时增加,显示长期口服OXC可以增加癫患儿MDR1的表达,并且和时间相关,长期应用后可被Pgp识别从而限制其通过血脑屏障,降低药物在脑中的浓度,影响药物疗效。实验采用的是测外周血MDR1-mRNA相对表达量的方法,取材简易方便,有利于动态观察,癫发作后,血脑屏障受损,脑内MDR1基因mRNA及其表达产物Pgp可进入外周血内,因此,外周血MDR1基因mRNA可在一定程度上反映其在脑内的表达。
[1]Eun SH,Kim HD,Chung HJ,et al.A multicenter trial of oxcarbazepine oral suspension monotherapy in children newly diagnosed with partial seizures:a clinical and cognitive evaluation[J].Seizure,2012,21(9):679-684.
[2]张军利 .奥卡西平治疗儿童部分发作性癫80例临床分析[J].中国实用神经疾病杂志,2011,14(12):76-78.
[3]Marchi N,Gonzalez-Martinez J,Nguyen MT,et al.Transpor ters in drug-refractory epilepsy:clinical significance[J].Clin Pharmacol Ther,2010,87(1):13-15.
[4]St pieńKM,Tomaszewski M,Tomaszewska J,et al.The multidrug transporter P-glycoprotein in pharmacoresistance to antiepileptic drugs[J].Pharmacol Rep,2012,64(5):1 011-1 019.
[5]Liu X,Yang Z,Yang J,et al.Increased P-glycoprotein expression and decreased phenobarbital distribution in the brain of pentylenetetrazole-kindled rats[J].Neuropharmacology,2007,53(5):657-663.
[6]Yang HW,Liu HY,Liu X,et al.Increased P-glycoprotein function and level after long-term exposure of four antiepileptic drugs to rat brain microvascular endothelial cells in vitro[J].Neurosci Lett,2008,434(3):299-303.
[7]Luna-Tortós C,Rambeck B,Jürgens UH,et al.The antiepileptic drug topiramate is a substrate for human P-glycoprotein but not multidrug resistance proteins[J].Pharm Res,2009,26(11):2 464-2 470.
[8]Zhang C,Zuo Z,Kwan P,et al.In vitro transport profile of carbamazepine,oxcarbazepine,eslicarbazepine acetate,and their active metabolites by human P-glycoprotein[J].Epilepsia,2011,52(10):1 894-1 904.
[9]Clinckers R,Smolders I,Meurs A,et al.Quantitative in vivo microdialysis study on the influence of multidrug transporters on the blood-brain barrier passage of oxcarbazepine:concomitant use of hippocampal monoamines as pharmacodynamic markers for the anticonvulsant activity[J].Pharmacol Exp T-her,2005,314(2):725-731.
[10]Marchi N,Guiso G,Rizzi M,et al.A pilot study on brain-toplasma partition of 10,11-dyhydro-10-hydroxy-5H-dibenzo azepine-5-carboxamide and MDR1brain expression in epilepsy patients not responding to oxcarbazepine[J].Epilepsia,2005,46(10):1 613-1 619.
[11]Fortuna A,Alves G,Falc o A,et al.Evaluation of the permeability and P-glycoprotein efflux of carbamazepine and several derivatives across mouse small intestine by the Ussing chamber technique[J].Epilepsia,2012,53(3):529-538.

