热激活过硫酸盐氧化法降解敌草隆*
高乃云 朱延平 谈超群 肖雨亮 隋铭皓
(同济大学 污染控制与资源化研究国家重点实验室,上海 200092)
敌草隆化学名为N-(3,4-二氯苯基)-N',N'-二甲基脲(C9H10C12N2),是一种广泛使用的苯基脲除草剂.敌草隆化学性质稳定(土壤光解半衰期为173 d,水解半衰期大于1000 d),难生物降解(好氧和厌氧降解时间分别为372 和995 d).土壤中残留的敌草隆会随农田灌溉排水进入附近水体而污染地表水,由于土壤对敌草隆吸附常数(Koc值)较低(2.77),敌草隆不易吸附土壤和沉积物,因而会通过土壤渗透至地下水层污染地下水.欧盟已将敌草隆列入了优先控制污染物名单[1].
目前常规水处理工艺无法有效去除饮用水中日趋复杂的难降解污染物,以羟基自由基(OH·)为主要活性物种的高级氧化技术(AOTs)得以迅速发展.应用较多的均相AOTs 有UV/H2O2,O3/H2O2,O3/UV,H2O2/Fe2+等[2].而O3的不稳定性以及H2O2的腐蚀性大大限制了基于O3和H2O2的AOTs 的运用推广.基于过硫酸盐的新型AOTs 近年来得到国内外越来越多的关注,主要由于其具有以下特点:①过硫酸盐一旦通过某种方式被激活将产生硫酸根自由基,氧化还原电位E0=2.6 V,类似羟基自由基OH·(E0=2.8 V),氧化能力较强,理论上能氧化大部分有机污染物[3];②过硫酸盐具有较大水溶性(25 ℃时100 g 水可溶解74 g 过硫酸钠)[4];③相对于O3氧化法和芬顿氧化法而言,过硫酸盐氧化法是一个比较缓慢的过程,可增大氧化剂与污染物的接触机会,且不会以气、热等形式造成能量浪费;④研究表明,过硫酸盐氧化法最适pH 值在7 左右,适合处理接近中性的天然水体[5].
过硫酸盐的活化方式主要有热激活、光激活和过渡金属离子激活[6].热激活和光激活方程式[7]为
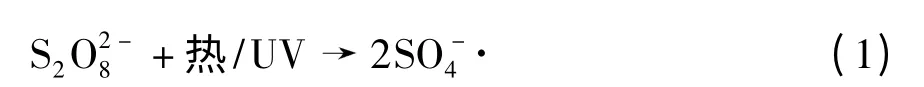
过渡金属离子激活方程式[8]为:
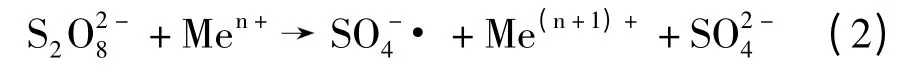
文中探索了热激活过硫酸盐氧化水中敌草隆的技术可行性,通过实验室试验确定动力学参数和敌草隆降解所需的活化能,同时还分析了温度、敌草隆初始浓度、过硫酸盐投加量、pH 值和共存离子等因素造成的影响.
1 材料和方法
1.1 试验材料
试验用敌草隆和流动相甲基氰均为色谱纯试剂,购自Sigma 公司.其他化学试剂如硫代硫酸钠(Na2S2O8)、乙醇(EtOH)、磷酸氢二钠(Na2HPO4)、磷酸二氢钠(NaH2PO4)、氯化钠(NaCl)、碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)均为分析纯试剂,购自国药集团化学试验有限公司.试验用水均采用Milli-Q 出水.由于磷酸盐类(如H2PO-4和HPO-2)对硫酸根自由基氧化剂的影响可忽略,所以缓冲溶液用NaH2PO4和Na2HPO4配制,调节反应过程中溶液pH 值为5.5~8.1.
1.2 试验方法
所有试验都在装有200 mL 敌草隆的试剂瓶内进行.反应器为水浴摇床(SHZ-B 型),以便控制所需温度.通过快速振荡确保溶液处于完全混合状态.过硫酸钠储备液(0.05 mmol/L)在反应前30 min 内配制.当一定体积的过硫酸钠储备液加入到反应器后氧化反应开始.分别在0、20、40、60、80、100 和120min 时取样,取样量0.8 mL,储存于1.0 mL 液相瓶中作进一步分析.液相瓶内预先加入0.2 mL 乙醇作为淬灭剂.
1.3 分析方法
敌草隆浓度采用高效液相色谱仪(岛津LC-2010AHT 型)分析,色谱柱为Agilent BDS-C18 反相色谱柱(填料粒径5 μm,柱长150 mm,柱直径4.6 mm).测定条件如下:流速为0.8 mL/min;流动相为Milli-Q去离子水与HPLC 级甲醇的混合液(体积比35∶65);检测波长为254 nm.溶液pH 值由Mettler Toledo pH计测定.所有试验至少有3 个平行样.数据使用Origin8.0 软件分析.通过线性回归计算敌草隆一级降解速率常数.
2 结果与讨论
2.1 动力学参数
氧化剂过硫酸盐初始浓度固定为0.375 mmol/L,在敌草隆初始浓度为0.0375 mmol/L、初始pH 值为5.1 的条件下,对敌草隆在不同反应温度下的降解情况进行研究,并与无氧化剂时敌草隆在343K 下的降解情况进行对比.敌草隆在313~343 K 下的试验结果如图1 所示.

图1 温度对热激活过硫酸盐工艺降解敌草隆的影响Fig.1 Effect of temperature on degradation of diuron by heat-activated persulfate oxidation
由图1 可知:温度为313 K 时,未发现敌草隆有明显的降解,表明热激活过硫酸盐降解敌草隆的最低温度可能是313 K;当温度高于313 K 时,在不同温度下敌草隆均发生了不同程度的降解,说明敌草隆在高温下的降解很可能是由于一定温度下热激活过硫酸盐生成了硫酸根自由基,而不是由于过硫酸盐本身的氧化作用.
采用准一级动力学反应拟合不同温度下敌草隆降解程度随反应时间的变化规律,发现在323~343 K下ln(cD/cD0)和时间t 呈良好的线性关系,具有较高的相关系数(r2>0.95).因此,一定温度下热激活过硫酸盐对敌草隆的降解符合准一级动力学.敌草隆降解的速率方程为

式中,kobs是准一级速率常数,代表系统中所有氧化剂(如·、OH·和S2)对敌草隆的降解速率常数之和,cD0为敌草隆的初始浓度,t 为反应时间,cD为t 时刻敌草隆的浓度.在敌草隆初始浓度为0.0375 mmol/L 的条件下,当温度由323 K 升至343 K时,速率常数kobs由0.00077 升到0.02551 min-1.
采用阿伦尼乌斯公式拟合不同温度下速率常数的变化规律:

式中,A 为频率因子,Ea为活化能,R 为普适气体常数,T 为绝对温度.当反应温度T 为313~343 K 时,ln kobs与1/T 呈线性关系,如图2 所示,能较好地拟合式(4)(r2=0.949 3).本研究中得出的平均活化能Ea((166.7 ±0.8)kJ/mol)与Ghauch 等[9]用热激活过硫酸盐于323~343 K 下降解布洛芬得到的Ea((168 ±9.5)kJ/mol)类似,高于Ghauch 等[10]用热激活过硫酸盐降解比索洛尔时在313~343 K 所得到的Ea((119.8 ±10.8)kJ/mol).

图2 准一级动力学表观速率常数kobs与T -1的关系Fig.2 Relationship between pseudo first-order observed rate constant kobs and T -1
2.2 过硫酸盐投加量对敌草隆降解过程的影响
敌草隆初始浓度固定为0.037 5 mmol/L,初始pH 值为5.1,反应温度设为333 K,考察不同过硫酸盐投加剂量(0.125、0.250、0.375 和0.500 mmol/L)下敌草隆的降解情况.如图3 所示,随过硫酸盐投加量由0.125 mmol/L 增加到0.500 mmol/L,在180 min时敌草隆的去除率由16%增至64%.这是因为增加过硫酸盐投加量,产生的SO-4·增多,其氧化效应增强,从而提高了降解率.
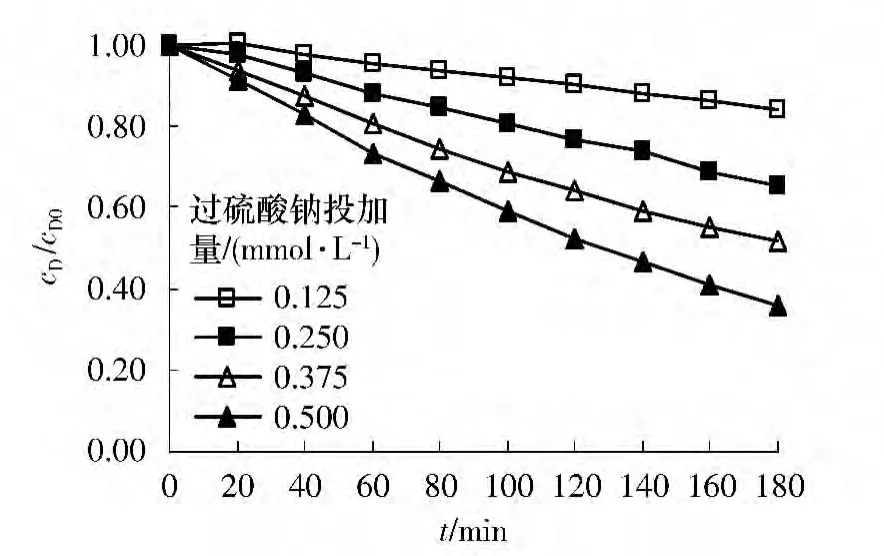
图3 过硫酸盐投加量对敌草隆降解过程的影响Fig.3 Effect of persulfate dosage on degradation of diuron
采用准一级动力学反应拟合不同过硫酸盐投加量下敌草隆浓度随时间的变化规律,在过硫酸盐投加量为0.125~0.500 mmol/L 时,ln(cD/cD0)和时间t 呈良好线性关系,具有较高的相关系数(r2=0.99).
如图4 所示,kobs和过硫酸盐投量呈正相关.因此式(3)又可写为

式中,cO为Na2S2O8投加量.根据动力学方程,增大过硫酸盐投加量会提高敌草隆的降解速率.类似结果在Xie 等[11]用热激活过硫酸盐降解苯胺的研究中也有体现,降解速率与过硫酸盐初始投量呈正相关.

图4 准一级动力学表观速率常数kobs与cO的关系Fig.4 Relationship between pseudo first-order observed rateconstant kobs and cO
2.3 敌草隆初始浓度对敌草隆降解过程的影响
过硫酸盐初始浓度为0.375 mmol/L、反应温度为333 K 时,将敌草隆初始浓度分别设定为0.0125、0.0250、0.0375 和0.0500 mmol/L,对比了不同敌草隆初始浓度下的降解情况.从图5 可看出,随敌草隆初始浓度的升高,曲线斜率逐渐减小,因此降解速率逐渐减小.这是因为理论上过硫酸盐投加量一定且其他反应条件都相同的情况下,硫酸根自由基的整体数量是恒定的.所以当敌草隆初始浓度较高时,被硫酸根自由基降解的部分相对比例较小.
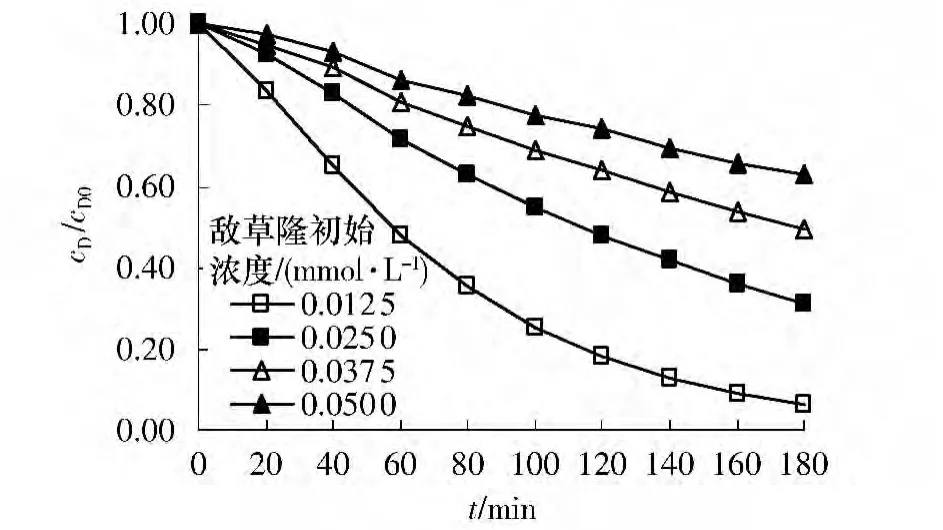
图5 敌草隆初始浓度对热激活过硫酸盐降解敌草隆的影响Fig.5 Effect of initial diuron concentration on the degradation of diuron by heat-activated persulfate oxidation
采用准一级动力学反应拟合敌草隆浓度随反应时间的降解规律,其去除率、kobs、相关系数及半衰期t1/2如表1 所示.当敌草隆初始浓度由0.012 5 增到0.050mmol/L 时,kobs由0.0155 减小到0.0027min-1.实验中得出的kobs(0.0155~0.0027 min-1)与Ghauch等[12]用1mmol/L 过硫酸盐降解不同浓度亚甲蓝时得到的相当.当亚甲蓝初始浓度在0.0156~0.311mmol/L时,测得的kobs由0.029 降至0.0025 min-1.
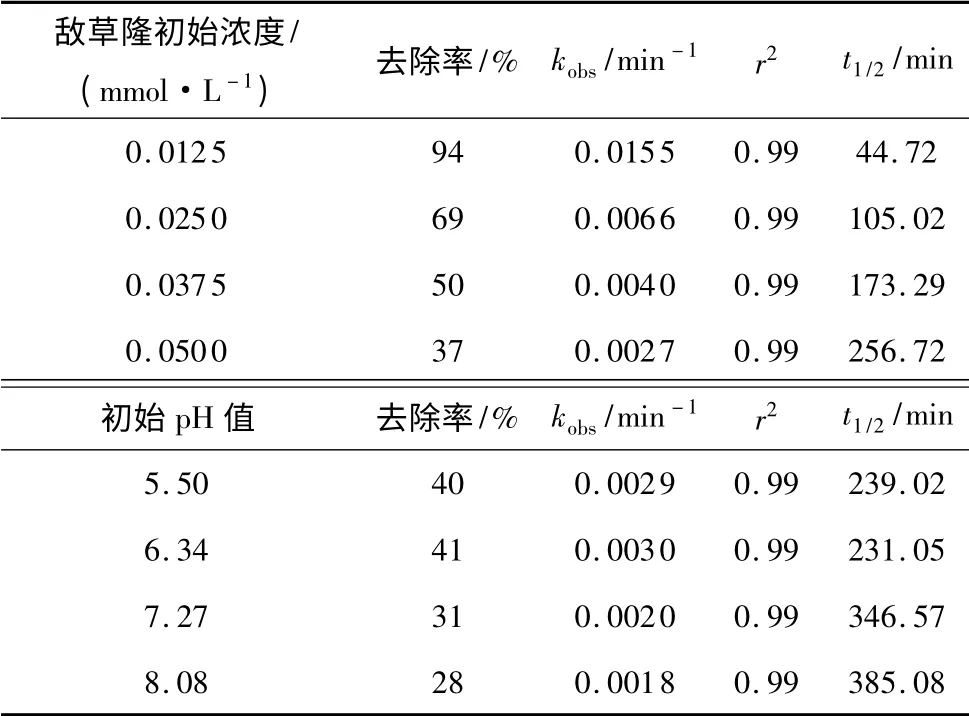
表1 不同初始条件(底物浓度,pH 值)下敌草隆降解的拟一级动力学模型的拟合参数Table 1 Fitting parameters of pseudo first-order kinetic models for degradation of diuron under different initial conditions (diuron dosages and pH value)
2.4 溶液pH 值对敌草隆降解过程的影响
控制敌草隆初始浓度为0.0375mmol/L、过硫酸钠投加量为0.375 mmol/L、反应温度为333 K,试验各工况分别设定初始pH 值为5.50、6.34、7.27、8.08,采用准一级动力学曲线拟合不同初始pH 值下敌草隆浓度随时间的变化规律,其kobs、r2及半衰期t1/2如表1 所示.可知pH 值为6.34 时降解速率最大(0.0030 min-1).
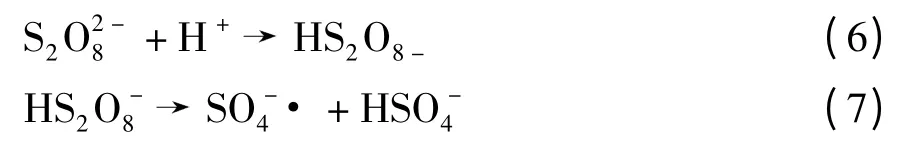
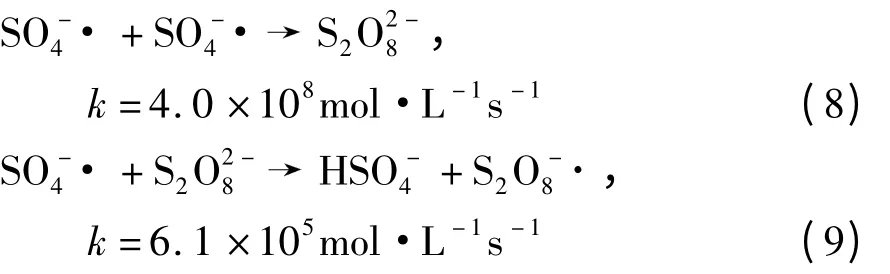
式中,k 为反应速率常数.这些弱活性种类如S2,·等会减少·的量,从而降低敌草隆的降解速率.因此pH 值为5.50 时敌草隆的降解速率低于pH 值为6.34 时.
当溶液pH 值超过6.34,渐渐达到中性条件时,一部分的·会转化为羟基自由基,反应式如下[15]:
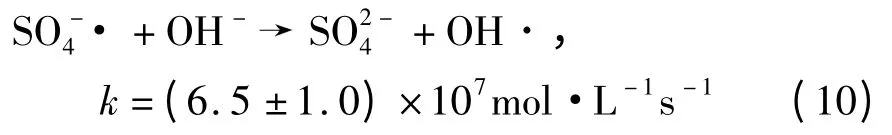
尽管·OH(E0=2.7 V)的氧化还原势能略高于·(E0=2.6 V),OH·的氧化没有选择性,可能会受许多其他共存物质的影响.例如,两种已被认可的OH·抑制剂——和可能会随pH 值的升高迅速增多,从而使反应速率降低.Lipczynska-Kochany 等[16]研究了抑制芬顿反应中OH·降解4-氯酚的几种阴离子的影响程度:.与相比,的影响很小.而在热激活过硫酸盐氧化系统中,SO2-4 作为过硫酸盐的最终产物,在反应系统中含量很高,所以若将SO-4·换作OH·,在碱性条件下敌草隆的降解速率会明显下降.因此,弱酸性比弱碱性条件更利于敌草隆的降解.在本研究的pH 值范围内(5.50~8.08),敌草隆的最高降解速率是最低速率的1.6 倍.发现pH 值为7 时降解速率达到最大.表1 为不同初始条件下敌草隆降解的拟一级动力学模型拟合参数.
2.5 碱性物质对敌草隆降解过程的影响

式中,Ka为酸的解离平衡常数.和的比例受pH 值的影响很大.当HCO-3 初始浓度分别为0.00、0.37、3.75、18.75 和37.50 mmol/L 时,化学反应平衡式中和的摩尔比分别为1.72 ×105,400,56,56 和0.006 8 左右.也就是说,当cHCO-3≤18.75 mmol/L 时,占主导地位,而当cHCO-3>18.75 mmol/L 时,占主导地位.

2.6 氯离子对敌草隆降解过程的影响
试验中控制敌草隆初始浓度为0.0375mmol/L、过硫酸钠投加量为0.375 mmol/L、反应温度333 K、初始pH 值为5.1,参考Kapil Dev Brahman 等[18]在对巴基斯坦地区地下水中氟、砷含量及其他物化参数的评估中以及Ilker Akin 等[19]在地下水除砷研究中测得的几个地区地下水中氯离子浓度范围,确定试验各工况分别投加氯化钠0.37、3.75、18.75 和37.50 mmol/L.采用准一级动力学曲线拟合不同离子投加量下敌草隆浓度随时间的变化规律.其kobs、r2及半衰期t1/2如表2 所示.
表2 不同浓度阴离子(、Cl -)影响下敌草隆降解的拟一级动力学模型的拟合参数Table 2 Fitting parameters of pseudo first order kinetic models for degradation of diuron under the action of and Cl - with different concentrations
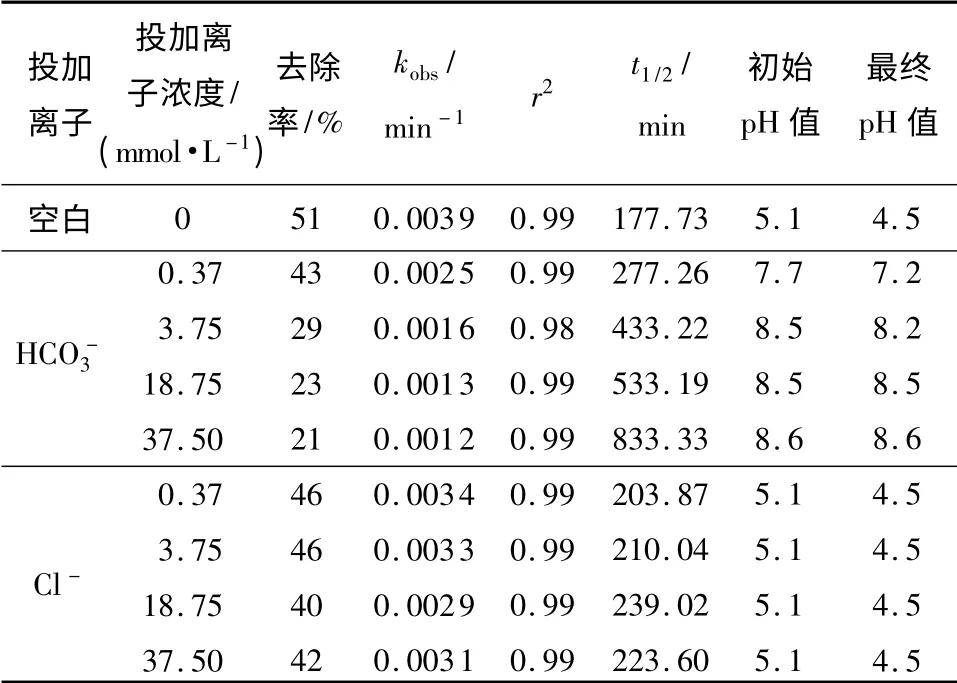
表2 不同浓度阴离子(、Cl -)影响下敌草隆降解的拟一级动力学模型的拟合参数Table 2 Fitting parameters of pseudo first order kinetic models for degradation of diuron under the action of and Cl - with different concentrations
投加离子投加离子浓度/(mmol·L-1)去除率/%kobs/min -1 r2 t1/2/min初始pH 值最终pH 值空白0 51 0.0039 0.99 177.73 5.1 4.5 HCO -3 Cl -0.37 3.75 18.75 37.50 0.37 3.75 18.75 37.50 43 29 23 21 46 46 40 42 0.0025 0.0016 0.0013 0.0012 0.0034 0.0033 0.0029 0.0031 0.99 0.98 0.99 0.99 0.99 0.99 0.99 0.99 277.26 433.22 533.19 833.33 203.87 210.04 239.02 223.60 7.7 8.5 8.5 8.6 5.1 5.1 5.1 5.1 7.2 8.2 8.5 8.6 4.5 4.5 4.5 4.5
由表2 可知,当Cl-浓度由0.37 mmol/L 增至18.75 mmol/L 时,敌草隆降解速率减少约13%.SO-4·和Cl-参与的反应如下[20]:

3 结论
本研究旨在考察热激活过硫酸盐氧化地下水中的一种代表性除草剂——敌草隆.敌草隆通过热激活过硫酸盐产生的高活性硫酸根自由基的氧化得以分解.结果表明热激活过硫酸盐氧化法能有效地降解目标化合物,为敌草隆和其他地下水中关注较多的有机污染物的降解提供了一种可行的途径.研究结果也表明,地下水中的一些常见阴离子可能会不同程度地影响敌草隆的降解,因此,这些影响在实际应用中应加以考虑.过硫酸盐活化法现已应用于原位化学氧化技术(ISCO),热激活过硫酸盐法可作为一种原位热修复技术(ISTR)与原位化学氧化技术联用.
热激活过硫酸盐氧化法可以快速、有效地降解敌草隆,降解情况符合拟一级动力学.该工艺受反应温度、敌草隆初始浓度、过硫酸盐投加量、反应初始pH 值、无机阴离子等因素的影响,具体如下:
(1)其他条件一定时,343 K 下激活过硫酸盐具有最佳的去除效果;313K 下检测不到敌草隆的降解;随温度升高,敌草隆的降解速率加快.
(2)敌草隆初始浓度增加会降低反应速率,而增加氧化剂的投加量会加快反应速率.
(3)初始pH 值对敌草隆降解有较大影响,强酸或强碱条件都不利于反应进行,且碱性条件比酸性条件的抑制作用更显著;在pH 值为6.34 的弱酸性条件下,降解速率最大.
[1]Malato S,Blanco J,Cáceres J,et al.Photocatalytic treatment of water-soluble pesticides by photo-Fenton and TiO2using solar energy [J].Catalysis Today,2002,74(2/3/4):209-220.
[2]张晏晏,高乃云,高玉琼,等.高级氧化技术去除水中双酚A 研究进展[J].水处理技术,2012,38(8):1-4.Zhang Yan-yan,Gao Nai-yun,Gao Yu-qiong,et al.Application of advanced oxidation processes for treatment of bisphenol A in aquatic environment[J].Technology of water treatment,2012,38(8):1-4.
[3]王兵,李娟,莫正平,等.基于硫酸自由基的高级氧化技术研究及应用进展[J].环境工程,2012,30(4):53-57.Wang Bing,Li Juan,Mo Zheng-ping,et al.Progress in advanced oxidation processes based on sulfate radical[J].Environmental Engineering Journal,2012,30(4):53-57.
[4]杨世迎,陈友媛,胥慧真,等.过硫酸盐活化高级氧化新技术[J].化学进展,2008,20(9):1433-1438.Yang Shi-ying,Chen You-yuan,Xu Hui-zhen,et al.A novel advanced oxidation technology based on activated persulfate[J].Progress in Chemistry,2008,20(9):1433-1438.
[5]Liang C J,Wang Zih-Sin,Bruell J C.Influence of pH on persulfate oxidation of TCE at ambient temperatures[J].Chemosphere,2007,66(1):106-113.
[6]杜肖哲.基于热活化过硫酸盐新型高级氧化技术深度处理水中对氯苯胺的研究[D].广州:华南理工大学环境科学与工程学院,2012.
[7]House D A.Kinetics and mechanism of oxidations by peroxydisulfate[J].Chemical Reviews,1962,62(3):185-203.
[8]Anipsitakis G P,Dionysiou D D.Radical generation by the interaction of transition metals with common oxidants[J].Environmental Science & Technology,2004,38(13):3705-3712.
[9]Ghauch A,Tuqan A M,Kibbi N.Ibuprofen removal by heated persulfate in aqueous solution:a kinetics study[J].Chemical Engineering Journal,2012,197(7):483-492.
[10]Ghauch A,Tuqan A M.Oxidation of bisoprolol in heated persulfate/H2O systems:kinetics and products [J].Chemical Engineering Journal,2012,183(12):162-171.
[11]Xie X F,Zhang Y Q,Huang W L,et al.Degradation kinetics and mechanism of aniline by heat-assisted persulfate oxidation [J].Journal of Environmental Sciences,2012,24(5):821-826.
[12]Ghauch A,Tuqan A M,Kibbi N,et al.Methylene blue discoloration by heated persulfate in aqueous solution[J].Chemical Engineering Journal,2012,213(12):259-271.
[13]Robert E H,Carol L C.Rate constants for hydrogen abstraction reactions of the sulfate radical,SO-4alkanes and ethers[J].International Journal of Chemical Kinetics,1989,21(8):611-619.
[14]Buxton G V ,Bydder M ,Salmon G A.The reactivity of chlorine atoms in aqueous solution(Part II):the equilib-rium+ Cl= Cl-+[J].Physical Chemistry Chemical Physics,1999,1(2):269-273.
[15]Hayon E,Treinin A,Wilf J.Electronic spectra,photochemistry,and autoxidation mechanism of the sulfite-bisulfite-pyrosulfite systems.radicals[J].Journal of the American Chemical Society,1972,94(1):47-57.
[16]Lipczynska-Kochany E,Sprah G,Harms S.Influence of some groundwater and surface waters constituents on the degradation of 4-chlorophenol by the Fenton reaction.[J].Chemosphere,1995,30(1):9-20.
[17]Waldemer H R,Tratnyek G P,Johnson L R,et al.Oxidation of chlorinated ethenes by heat-activated persulfate:kinetics and products [J].Environmental Science &Technology,2006,41(3):1010-1015.
[18]Kapil Dev Brahman,Tasneem Gul Kazi,Hassan Imran Afridi,et al.Evaluation of high levels of fluoride,arsenic species and other physicochemical parameters in underground water of two sub districts of Tharparkar,Pakistan:a multivariate study[J].Water Research,2013,47(3):1005-1020.
[19]Ilker Akin,Gulsin Arslan,Ali Tor,et al.Arsenic(V)removal from underground water by magnetic nanoparticles synthesized from waste red mud[J].Journal of Hazardous Materials,2012,235/236(10):62-68.
[20]Anipsitakis P G,Dionysiou D D,Gonzalez A M.Cobaltmediated activation of peroxymonosulfate and sulfate radical attack on phenolic compounds implications of chloride ions [J].Environmental Science & Technology,2005,40(3):1000-1007.
[21]Liang C J,Wang Zih-Sin,Mohanty N.Influences of carbonate and chloride ions on persulfate oxidation of trichloroethylene at 20 ℃[J].Science of The Total Environment,2006,370(2/3):271-277.

