影响果胶钙凝胶形成的因素以及果胶钙凝胶应用*
黄雪松,郭秀君
(暨南大学理工学院食品科学与工程系,广东 广州,510632)
果胶钙凝胶是果胶分子中的游离羧基阴离子与钙离子结合而形成的凝胶[1]。该凝胶常以含水凝胶或干燥固体的形式存在于植物组织中,现已逐渐将其应用于微生物固定化、果胶生产、食品、药品等领域。由于果胶钙凝胶的形成、性质与应用受果胶的化学结构、理化性质和环境等因素的影响,因此,深入分析形成果胶钙凝胶的影响因素有助于解决果胶钙凝胶应用中存在的问题。本文重点综述影响果胶钙凝胶形成的因素与果胶钙凝胶的应用。
1 果胶钙凝胶的形态与安全性
果胶溶液,尤其是低甲氧基果胶(酯化度<50%)溶液,在偏碱性条件下,其游离羧基带负电,常常与环境中的游离钙离子结合形成果胶钙凝胶,该凝胶的钙含量、凝胶强度、刚性、黏弹性、透性、含水量等特征因形成的条件而异。如果去掉水分,就成为干燥状态的果胶钙。
大量研究证实,食用果胶钙凝胶是安全的。1977年美国生命科学研究所就提出果胶和果胶酸盐添加剂具有保健功能,在果胶或果胶酸分子中引入钙离子并不改变其食用安全性。Borzelleca 等人进而通过毒理学实验证明了果胶钙对人体健康没有危害,是GRAS(公认安全无害)物质[2],该结果为果胶钙在医药、微生物、酶、食品等领域的安全使用奠定了基础。
2 果胶钙凝胶的化学结构
单纯的果胶钙凝胶或干燥的果胶钙,不溶于水或其他溶剂,因此其分子质量、形状、谱学特点等分子结构特征的资料报道较少。人们主要还是通过果胶的分子结构了解和推测果胶钙凝胶分子的化学结构。
果胶是由D-半乳糖醛酸(GalA)以α-1,4 糖苷键连接而成的线性杂多糖,且其部分半乳糖醛酸含有甲氧基,据其甲氧基含量将果胶分为高甲氧基果胶和低甲氧基果胶[3]。
天然果胶存在于植物中,在不同的植物、植物的不同组织及不同生长阶段,果胶的结构均不同,所以,果胶结构具有多样性。此外,提取方法和提取过程也会使其结构发生变化[4]。由此可见,由果胶所形成的果胶钙凝胶的结构自然也不均一。
果胶类多糖分子结构内有光滑区和毛发区:光滑区由α-D-半乳糖醛酸残基以(1→4)-糖苷键连接;毛发区由高度分支的α-L-鼠李半乳糖醛酸组成。因此,根据结构不同,可将果胶分子结构区分为半乳糖醛酸聚糖(HGA)、鼠李半乳糖醛酸聚糖-I (RG-I)和鼠李半乳糖醛酸聚糖-II(RG-II)三类不同的结构区[3]。
HGA 是α-D -半乳糖醛酸残基以(1→4)-糖苷键连接而成的线性糖链区,其羧基有不同程度的甲酯化[4-6],该区域主要为果胶或果胶钙的光滑区结构;若在HGA 中间插入鼠李糖(Rha),即为RG-I 区,它是由半乳糖醛酸和鼠李糖交替组成的重复单元:4-α-D-GalA-(1→2)-α-L-Rha-1[4,6];RG-II 与RG-I 的结构完全不同,其骨架常由9 个半乳糖醛酸经α-1,4 糖苷键连接而成,已确认该骨架常由固定且不同单糖组成4 种支链结构,进而构成果胶的毛发区域,已发现这些固定单糖残基有11 种之多,包括一些稀有单糖类似物,如芹菜糖、槭汁酸、2-脱氧酮-3-D -甘露-辛酮糖酸,因而该种结构区域更为复杂[4-6]。
上述果胶分子结构表明,虽然果胶钙凝胶是由果胶分子自由羧基与钙离子靠静电力结合而形成的,但其化学结构仍然由于果胶分子的多样性而呈现诸多不同。除此之外,果胶与钙离子的结合也会导致果胶钙结构的差异。如果胶钙凝胶膜的红外光谱显示:其甲酯基与自由羧基(1 740 cm-1),以及离子化羧基(1 610 cm-1)的吸收峰向高波数移动,这些峰的吸收强度随着与钙离子结合浓度的升高而增加,这些说明钙离子与果胶的结合改变了果胶官能团之间的相互作用[7]。介观结构研究表明,果胶钙凝胶呈现均匀的网络状结构,随着果胶钙凝胶形成的时间和钙离子浓度的变化,网状结构也会发生变化[8]。
3 形成果胶钙凝胶的模型——“蛋箱(egg-box)”结构模型
早在1973 年Grant 等人就提出了“egg-box”蛋箱结构模型(图1),他们认为,2 条反平行双螺旋果胶糖链共同连接钙离子,构成“波状”的蛋箱结构,两条链通过静电力紧密相连[9];就像两条锯的锯齿的齿尖相互结合一样,而锯齿齿距间即凹型部分构成了“蛋箱”式结构。蛋箱模型被广泛接受,并且得到证实[10-11]。但是,只有当分子链上连续未酯化的GalA残基达到6 ~13 时,才能形成蛋箱结构[12-13]。
4 形成果胶钙凝胶的影响因素
果胶钙凝胶的形成受内因和外因的影响。内因是指果胶分子结构的特征,如甲氧基的数量和分布、链长、侧链、酰胺基、乙酰基、钙离子和果胶浓度等。而外因则指形成果胶钙凝胶的条件,如糖浓度、离子强度、pH 值和温度等,这些因素之间是相互制约和相互影响的。例如,随着钙离子浓度的提高,凝胶性质的改变受酯化度、果胶浓度、pH 值的影响也越大。

图1 果胶钙凝胶蛋箱模型Fig.1 “Egg-box”model of calcium pectinate gels
4.1 影响形成果胶钙凝胶的内因
4.1.1 果胶的酯化度(DM)和甲氧基区域分布程度(degree of blockiness,DB)
DM 值越低,即果胶链中未酯化GalA 越多,越有利于与钙离子的结合,即越有利于形成果胶钙凝胶[14-15]。
果胶钙凝胶蛋箱结合区的形成能力还也取决于DB。果胶链上甲氧基有区域分布(图2 -a 和图2 -c)和随机分布(图2 -b)2 种类型。前者DB 值高于后者,有利于果胶链与钙离子的连接形成蛋箱结构[15]。所以,DB 值越高,越有利于形成果胶钙凝胶。
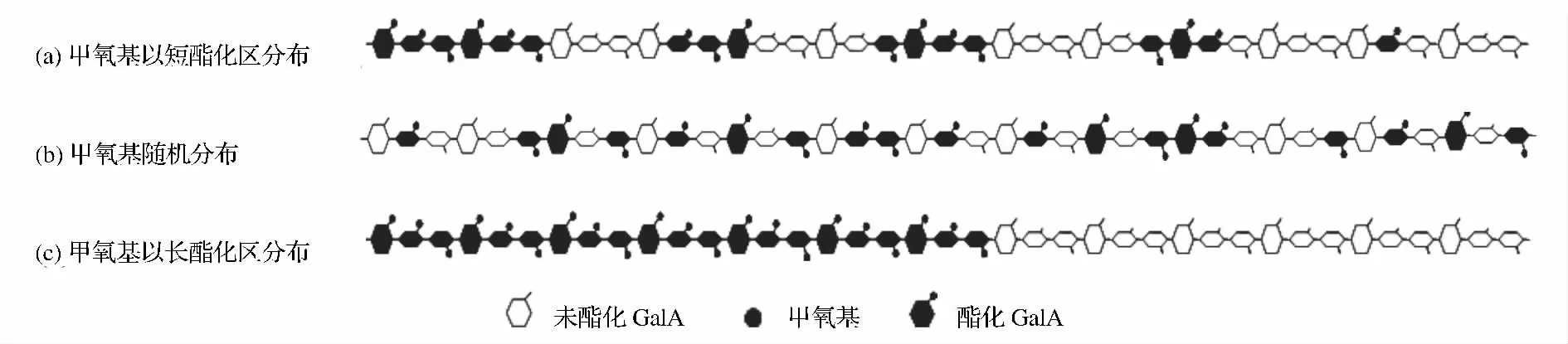
图2 高甲氧基果胶(DM=50%)中的甲氧基分布示意图Fig.2 Distribution of carbomethoxy in HM pectin(DM=50%)
一般地,利用半乳糖醛酸内切酶(PGE)专一性地降解果胶链,利用酶指纹技术来描述和测定DB 值。PGE 是内切酶,可以切断未酯化GalA 之间的糖苷键,使果胶链中未酯化的GalA 以单糖、二聚糖和三聚糖的形式释放出来(图3),进而根据图3 所示计算DB。DB 等于被PGE 释放的低聚物总数与未酯化GalA 总数之比。这个参数仅与未酯化GalA 数目有关,与GalA 总数目无关。但DB 不能反映DM 的变化,因此与果胶钙凝胶特性相关性不大[15]。为了得到更准确的甲氧基的分布与凝胶特性的定量关系,Guillotin 等提出了绝对甲氧基区域分布程度(absolute degree of blockiness,DBabs)的概念[16]。DBabs等于被PGE 释放的低聚物总数与GalA 残基总数(酯化GalA和未酯化GalA 之和)之比。前人用不同方法(碱和酶)脱去果胶甲氧基,并以得到的果胶进行果胶钙凝胶研究[6,17]。结果表明,DBabs与果胶钙凝胶强度有很强的相关性。

图3 半乳糖醛酸内切酶(PGE)水解果胶原理及DM、DB、DBabs的计算Fig.3 Simplified scheme of pectin digestion by PGE and calculation of DM,DB and DBabs
但是,根据DBabs仅能估计整个果胶样品的酯化区域分布,它不能反映果胶样品中每条分子链的酯化区域的分布。在果胶链上,有的酯化区域较短(图2-a),而有的则相反(图2 -b),前者形成的凝胶强度更大[18]。在一定酯化度下,当未酯化GalA 区域的GalA 数量等于形成稳定蛋箱结构所需的GalA 最小值时,形成的凝胶强度最大,因为这种分布可以使结合区域(蛋箱结构)最大化[19]。
4.1.2 分子质量
果胶钙凝胶的强度和分子量呈正相关[20-21],分子量太小的果胶不能形成果胶钙凝胶。但在特定聚合度范围内,适当添加过量钙离子可以防止凝胶强度的下降,即增加离子交联可以弥补共价键断裂造成的凝胶强度降低[22]。研究发现,每条果胶链上至少有两个结合区才能形成网络,仅有一个结合区的短链不但不能形成交联,还会占用长链的结合位点,阻碍果胶钙凝胶形成[13,23-24]。
4.1.3 支链
果胶主链上的鼠李糖残基使线性半乳糖醛酸链出现分支,少量D-木糖、L-阿拉伯糖和D-半乳糖等残基存在于这些分支上。一定量的支链可以防止果胶钙凝胶脱水,但是支链过多会增加果胶链的空间位阻,阻碍糖链的交联[22]。Budolfsen 和Heldt-Hansen发现,果胶甲酯酶(PME)和脱支酶对凝胶强度和流变性质的改变有协同作用[25]。脱支酶可能会提高PME 活性,降低酯化度,并且/或直接地加强果胶钙的交联。但是Schmelte 等人的研究有不同的结论,他们分别用混合酶(PME、脱支酶)和PME 处理果胶,2种果胶形成的果胶钙凝胶有相似的性质[26]。但是Schmelt 的研究没有说服力,因为脱支酶仅释放少量的中性糖,它对果胶的功能性质影响很小。这些差异还有待进一步研究。
4.1.4 酰胺基
酰胺基是果胶在脱甲氧基的过程中与氨基反应形成的,它可以改变果胶钙凝胶的黏弹性[22,27]。由于酰胺基之间氢键的连接,酰胺化果胶具有更高的凝胶强度(尤其在低pH 值条件下)[28]。与一般果胶相比,由于氢键的增加和游离羧基的减少,酰胺化果胶形成果胶钙凝胶需要的钙离子要少[29]。
4.1.5 乙酰基
乙酰基使果胶与钙离子的连接不牢固,乙酰化果胶(如甜菜果胶)难以形成果胶钙凝胶[29]。Oosterveld 等用乙酰酯酶和PME 共同处理甜菜果胶后,果胶的凝胶强度明显提高。乙酰酯酶除去乙酰基后,PME 的活性提高,大大降低了果胶的酯化度,果胶钙凝胶更易形成[30]。但是,该研究不能说明酰胺基对蛋箱结构的形成有直接影响。
4.2 影响形成果胶钙凝胶的外因
4.2.1 钙离子浓度
在果胶钙凝胶的研究中,钙离子浓度常以R(R=2[Ca2+]/[COO-])表示[31-32],而不是以全部钙离子浓度表示。R 体现了Ca2+浓度与果胶链上游羧基数量的联系,进而间接地体现了与酯化度的联系。
在果胶溶液中,随着R 的升高,蛋箱结合区增加,凝胶强度提高。假设所有的钙离子都存在于蛋箱结构中(图1),R=0.5,果胶钙结构稳定。但是,再添加钙离子,只是会增加一些微弱的静电力,这些力对凝胶强度的贡献非常小[21]。当R >1 时,钙离子阻碍凝胶强度的提高[1,33]。
R 值过高,凝胶发生相分离或分层现象。相分离类型取决于果胶浓度。浓度低时,果胶沉淀(盐析作用)。浓度高时,凝胶脱水[34-35]。凝胶沉淀和脱水影响食品的品质,所以在食品应用中,要避免发生相分离。
4.2.2 果胶浓度
R 值一定时,凝胶强度随果胶浓度的提高而增加[1,33]。果胶浓度低时,分子内形成离子键的概率很大,但这种分子内键对凝胶网络结构的形成却没有任何贡献。随着果胶浓度的提高,分子内键减少[32],更多有效的交联区域形成[35]。
4.2.3 pH 值
为了使果胶的羧基和钙离子之间形成离子交联,果胶必须带电荷,羧基处于解离状态。GalA 单体的pKa 约为3.5,果胶中GalA 的pKa 略有不同,它取决于DM 和DB[15]。pH >5 时,凝胶性质与pH 无关;而当果胶钙凝胶的pH 降到4.5 以下,果胶的电荷密度下降,与钙离子的亲和力随之降低。但是,这种影响也会因为质子化的羧基之间形成氢键而得到一定程度的补偿[32,35]。pH <3.5 时,即使没有钙离子,低甲氧基果胶也会凝胶。随着pH 值的降低,伴随着羧基质子化,果胶由双螺旋向三螺旋构象转换。三螺旋果胶链之间通过氢键交联[35]。在强酸性条件下,虽然果胶的电荷密度低,钙离子仍会促进凝胶。此外,酰胺基也有助于低甲氧基果胶在酸性条件下凝胶,因为酰胺化果胶电荷密度比非酰胺化果胶低,同时酰胺基之间的氢键也可强化凝胶结构[29]。
4.2.4 糖浓度
研究表明,可溶性固形物(如糖类)的添加有利于果胶钙凝胶的形成。凝胶强度的增加程度取决于糖的浓度、种类和pH。例如,蔗糖比葡萄糖更能提高凝胶强度,而果糖则比葡萄糖的作用更小[36]。目前,小分子糖类提高凝胶强度的机理还不是很清楚。有研究认为,糖可以降低水分活度,加强果胶-果胶相互作用,降低果胶-水的作用[28]。而部分多元醇(如山梨醇)会与果胶竞争钙离子,对凝胶不利。
4.2.5 离子强度
低甲氧基果胶溶于水后,分子间存在电荷斥力,所以果胶链之间的交联。但是,钙、钠、钾等金属离子可以掩蔽聚合物的电荷,减小分子间斥力,当分子间斥力减小到最低时,离子成为交联剂,分子链间形成网络。研究表明,有NaCl 存在时,果胶能在较低的钙离子浓度时形成果胶钙凝胶[37]。但是在仅有Na+、K+这样的一价阳离子存在的情况下,也能形成凝胶,电荷中和和离子强度效应的共同作用促使凝胶形成[38]。
但是,柠檬酸、酒石酸、抗坏血酸等有机酸对凝胶的形成有不利影响。这些在食品工业中常见的有机酸会螯合二价离子,从而与果胶竞争钙离子[55],增加形成凝胶所需的钙离子量[39]。
4.2.6 温度的影响
为了得到均匀的果胶钙凝胶,果胶和钙离子需要在高温下先混合再冷却。降温过程中,果胶-钙混合物由溶胶向凝胶转变,随着温度的缓慢下降,凝胶强度逐渐增加[36]。溶胶-凝胶转化的温度取决于果胶结构和凝胶组成[29],高温下形成短的结合区,在冷却过程中,由于氢键形成,这些结合区更加稳定,与此同时钙离子被固定在其中。
需要注意的是,果胶钙凝胶受热后能够熔化,是热可逆凝胶。但是凝胶熔化的温度比形成凝胶时要高(热滞后效应)[40]。然而,过高的温度会导致果胶发生解聚,解聚的机理和速率取决于果胶的酯化度和pH[41],果胶的解聚会对果胶钙凝胶产生不利影响。
5 果胶钙凝胶的应用
由于含水量高的果胶钙凝胶和干性果胶钙均不溶于水,因此,对于各种果胶钙的应用,都是先将低甲氧基溶解后,再加入适量的氯化钙等钙离子溶液,在适当的条件下,形成果胶钙或其凝胶等形式。具体地说,主要应用在食品、药物、微生物、生产果胶等方面。
5.1 应用于食品
果胶钙凝胶可以做食品添加剂涂布于焙烤和油炸食品(如面包、土豆、洋葱圈、肉类等)的表面,防止食品在油炸过程中吸收油分,保持食品的水分,提高酥脆性和热稳定性[2,42]。Gerrish 等认为,可以用钙敏感型果胶溶液处理富含钙离子的食品,或者将果胶溶液涂布于食品表面再用钙盐溶液浸泡,这2 种方式都可以使食品表面覆盖果胶钙凝胶[2]。酯化度低于40%的低甲氧基果胶对钙离子敏感,是做食品果胶钙凝胶涂层的首选。此外,果胶的分子质量对果胶钙凝胶的拦油能力有很大影响,分子质量越大效果越好,若低甲氧基果胶的分子质量高于15 000 u,果胶钙凝胶的拦油能力最大。
5.2 靶向药物
果胶钙凝胶具有很好的生物相容性和黏膜靶向性,被广泛地用作药物和生物活性物质的载体。以果胶钙凝胶为载体的药物制剂,经口服给药后具有缓控释放的作用。果胶钙凝胶作为缓控制剂的新型辅料,克服了以往缓控制剂在体内受饮食、疾病等因素影响的缺陷[43],尤其是作为结肠定向释放药物优点更突出,是目前研究较多的一个方向。果胶钙凝胶在pH值较低的溶液中稳定,在碱性溶液中溶胀,而结肠恰好具有较高的pH 值和合适的果胶酶,因此果胶钙凝胶就能保证制剂中药物在结肠中的特异性释放[44]。而单纯的果胶则不完全具备这些特性,因此在药物载体的应用中受到限制。果胶的分子质量、酯化度和钙离子的浓度会影响果胶钙凝胶性质,进而影响药物释放效果[45-47],因此,要根据不同的药物和药物在体内的作用位置选用合适的果胶钙。
5.3 固定化微生物
果胶钙凝胶还常被用于固定微生物细胞。Toth等用藻酸钙凝胶和果胶钙凝胶分别包埋大肠杆菌,比较2 种凝胶对大肠杆菌代谢活性的影响。结果表明,2 者均能保持较长时间代谢过程,但是,果胶钙凝胶传递代谢产物的速度更快[48]。Jozef Nah'alka 等将重组大肠杆菌包埋在果胶钙凝胶中,用来生产三磷酸核苷。在他的研究中,果胶钙凝胶颗粒在培养液中浸泡60 d 仍保持稳定。前人对果胶钙凝胶做了改良,使该凝胶使用时间更长[49]。Kurillova 等人在果胶钙凝胶颗粒的表面覆盖了一层聚乙烯亚胺和戊二醛混合物,结果表明,该工艺拦截了高浓度的酒石酸等掩蔽剂对果胶钙凝胶的破坏,使果胶钙凝胶能保留细胞长达360 多天[50]。果胶钙凝胶的稳定性使其在固定微生物细胞方面得到广泛应用。
5.4 生产果胶
果胶钙凝胶还可以作为生产果胶的中间产物[51]。将果胶钙凝胶与酸性乙醇溶液以一定比例混合,并结合搅拌或匀浆等处理方式使H+与Ca2+的置换,再经过过滤、干燥后得到果胶。Olsen 认为这种方法得到的果胶会含有少量的钙离子,但是Ca2+的存在不影响果胶的凝胶性质[52]。与目前常用的乙醇沉淀法和铁、铝等盐析沉淀法生产果胶相比,这种方法所生产果胶的成本和能耗均较低,且不存在有害金属残留的缺点。
6 今后的研究重点
尽管利用果胶钙凝胶生产果胶是解决果胶生产成本高的一个途径,但这种生产工艺推广的难度比较大,主要是因为果胶原料的果胶含量、相关果胶的性质(分子质量、酯化度、DB、R 等)、生产工艺条件(粒度、处理pH、温度、时间)等因素均影响果胶钙凝胶的性质与产量,这些条件与果胶钙凝胶脱钙过程同样有关。所有,有必要继续加强果胶钙凝胶的形成与脱钙等方面化学热力学与动力学等方面的研究,以掌握好利用果胶钙凝胶生产果胶的生产工艺和操作参数的区间范围。
由于DB、DBabs、R 值是影响果胶钙凝胶形成的重要参数,但用PEG 测定这些指标时,会受到酶供应的制约,并且测定过程比较繁琐。因此,毫无疑问,简便、快速、准确地测定DB、DBabs值的方法是一个迫切需要解决的问题。
果胶钙凝胶的应用研究,除进一步拓展其在药品、食品、生物工程等领域中的应用外,应当进一步开展其生物活性(如降血脂[53]等)等理化性质的研究,以为扩大其应用提供必要理论依据。
7 结语
由于果胶钙的制作工艺简单且生产成本低,具有化学性质稳定、食用安全、生物相容性好等优点,相信其化学结构、理化性质、生物活性、分析测定等方面的系统研究,会有效地控制形成果胶钙凝胶的质量,进而满足不同加工产品的要求,进一步拓宽其在食品、药品、生物工程等领域的应用。
[1] MacDougall A J,Needs P W,Rigby N M,et al. Calcium gelation of pectic polysaccharides isolated from unripe tomato fruit[J]. Carbohydrate Research,1996,293(2):235 -249.
[2] Borzelleca J F,Filer L J,Kinoshita F K,et al. Evaluation of the safety of sodium pectate as a food ingredient[J].Food and Chemical Toxicology,1996,34(1):21 -25.
[3] 金征宇,顾正彪,童群义. 碳水化合物化学[M]. 北京:化学化工出版社,2008:239.
[4] Vincken J P,Schols H A,Oomen R J F J,et al. If homogalacturonan were a side chain of rhamnogalacturonan I.Implications for cell wall architecture[J]. Plant Physiology,2003,132(4):1 781 -1 789.
[5] Ridley B L,O'Neill M A,Mohnen D A. Pectins:structure,biosynthesis,and oligogalacturonide-related signaling. [J]. Phytochemistry,2001,57(6):929 -967.
[6] Willats W G T,Orfila C,Limberg G,et al. Modulation of the degree and pattern of methyl-esterification of pectic homogalacturonan in plant cell walls[J]. Journal of Biological Chemistry,2001,276(22):19 404 -19 413.
[7] Assifaoui A,Loupiac C,Chambin O,et al. Structure of calcium and zinc pectinate films investigated by FTIR spectroscopy[J]. Carbohydrate Research,2010,345:929 -933.
[8] Sriamornsak P,Thirawong N,Cheewatanakornkool K,et al. Cryo-scanning electron microscopy (cryo-SEM)as a tool for studying the ultrastructure during bead formation by ionotropic gelation of calcium pectinate[J]. International Journal of Pharmaceutics,2008,352:115 -122.
[9] Grant G T,Morris E R,Rees D A,et al. Biological interactions between polysaccharides and divalent cations-eggbox model[J]. Febs Letters,1973,32(1):195 -198.
[10] Braccini I,Grasso R P,Pe Rez S. Conformational and configurational features of acidic polysaccharides and their interactions with calcium ions:a molecular modeling investigation[J]. Carbohydrate Research,1999,317(1 -4):119 -130.
[11] Fang Y P,Al-Assaf S,Phillips G O,et al. Binding behavior of calcium to polyuronates:comparison of pectin with alginate[J]. Carbohydrate Polymers,2008,72(2):334 -341.
[12] Liners F,Thibault J F,Vancutsem P. Influence of the degree of polymerization of oligogalacturonates and of esterification pattern of pectin on their recognition by monoclonal antibodies[J]. Plant Physiology,1992,99(3):1 099 -1 104.
[13] Luzio G A,Cameron R G. Demethylation of a model homogalacturonan with the salt-independent pectin methylesterase from citrus:part II. Structure-function analysis[J]. Carbohydrate Polymers,2008,71(2):300 -309.
[14] Garnier C,Axelos M A V,Thibault J F. Selectivity and cooperativity in the binding of calcium-ions by pectins[J]. Carbohydrate Research,1994,256(1):71 -81.
[15] Ralet M C,Dronnet V,Buchholt H C,et al. Enzymatically and chemically de-esterified lime pectins:characterization,polyelectrolyte behaviour and calcium binding properties[J]. Carbohydrate Research,2001,336(2):17 -125.
[16] Guillotin S E,Bakx E J,Boulenguer P,et al. Populations having different GalA blocks characteristics are present in commercial pectins which are chemically similar but have different functionalities[J]. Carbohydrate Polymers,2005,60(3):391 -398.
[17] Pasculli R,Geraeds C,Voragen F,et al. Characterization of polygalacturonases from yeast and fungi[J]. LWTFood Science and Technology,1991,24(1):63 -70.
[18] Kim Y,Wicker L. Valencia PME isozymes create charge modified pectins with distinct calcium sensitivity and rheological properties[J]. Food Hydrocolloids,2009,28(1):957 -963.
[19] Vincent R,Cucheval A,Hemar Y,et al. Bio-inspired network optimization in soft materials-insights from the plant cell wall. [J]. European Physical Journal,2009,28(1):79 -87.
[20] Kim Y,Yoo Y H,Yam K O,et al. Texture properties of gelling system of low-methoxy pectins produced by demethoxylating reaction of pectin methyl esterase[J]. Journal of Food Science,2008,73(5):C367 -C372.
[21] Capel F,Nicolai T,Durand D. Influence of chain length and polymer concentration on the gelation of (amidated)low-methoxyl pectin induced by calcium[J]. Biomacromolecules,2005,6(6):2 954 -2 960.
[22] Fraeye I,Doungla E,Duvetter T,et al. Influence of intrinsic and extrinsic factors on rheology of pectin-calcium gels[J]. Food Hydrocolloids,2009,23(8):2 069 -2 077.
[23] Powell D A,Morris E R,Gidley M J,et al. Conformations and interactions of pectins:Ⅱ. Influence of residue sequence on chain association in calcium pectate gels[J]. Journal of Molecular Biology,1982,99(3):1 099-1 104.
[24] Fraeye I,Colle I,Vandevenne E,et al. Influence of pectin structure on texture of pectin-calcium gels[J]. Innovative Food Science & Emerging Technologies,2010,11(2):401 -409.
[25] Endress H U,Mattes F,Norz K. Handbook of Food Science,Technology and Engineering[M]. Boca Raton:CRC Press,2006.
[26] Budolfsen G,Heldt-Hansen H P. A process for the improvement of gel formation or viscosity increase[P]. Europe,0851736 A1. 1998 -07 -08.
[27] Schmelter T,Wientjes R,Vreeker R,et al. Enzymatic modifications of pectins and the impact on their rheological properties[J]. Carbohydrate Polymers,2002,47(2):99 -108.
[28] Lofgren C,Guillotin S,Hermansson A M. Microstructure and kinetic rheological behavior of amidated and nonamidated LM pectin gels[J]. Biomacromolecules,2006,7(1):114 -121.
[29] Lootens D,Capel F,Durand D,et al. Influence of pH,Ca concentration,temperature and amidation on the gelation of low methoxyl pectin[J]. Food Hydrocolloids,2003,17(3):237 -244.
[30] Ralet M C,Crepeau M J,Buchholt H C,et al. Polyelectrolyte behaviour and calcium binding properties of sugar beet pectins differing in their degrees of methylation and acetylation[J]. Biochemical Engineering Journal,2003,16(2):191 -201.
[31] Strom A,Ribelles P,Lundin L,et al. Influence of pectin fine structure on the mechanical properties of calciumpectin and acid-epectin gels[J]. Biomacromolecules,2007,8(9):2 668 -2 674.
[32] Capel F,Nicolai T,Durand D,et al. Calcium and acid induced gelation of (amidated)low methoxyl pectin[J].Food Hydrocolloids,2006,20(6):901 -907.
[33] Grosso C R F,Rao M A. Dynamic rheology of structure development in low-methoxyl pectin plus Ca2+plus sugar gels[J]. Food Hydrocolloids,1998,12(3):357 -363.
[34] Garnier C,Axelos M A V,Thibault J F. Phase diagrams of pectin-calcium systems influence of pH, ionicstrength,and temperature on the gelation of pectins with different degrees of methylation. Carbohydrate Research[J]. 1993,240:219 -232.
[35] Cardoso S A,Coimbra M A,Da Silva J A L. Calciummediated gelation of an olive pomace pectic extract[J].Carbohydrate Polymers,2003,52(2):125 -133.
[36] Fu J T,Rao M A. Rheology and structure development during gelation of low-methoxyl pectin gels:the effect of sucrose[J]. Food Hydrocolloids,2001,15(1):93 -100.
[37] Narayanan J,Deotare V W,Bandyopadhyay R,et al.Gelation of aqueous pectin solutions:a dynamic light scattering study[J]. Journal of Colloid and Interface Science,2002,245(2):267 -273.
[38] Wehr J B,Menzies N W,Blamey F P C. Alkali hydroxide-induced gelation of pectin[J]. Food Hydrocolloids,2004,18(3):375 -378.
[39] Marudova M,Jilov N. Influence of sodium citrate and potassium-sodium tartrate on gelation of low-methoxyl amidated pectin[J]. Journal of Food Engineering,2003,59(2 -3):177 -180.
[40] Cardenas A,Goycoolea F M,Rinaudo M. On the gelling behaviour of‘nopal’(Opuntia ficus indica )low methoxyl pectin[J]. Carbohydrate Polymers,2008,73(2):212 -222.
[41] Loey A. Influence of pectin properties and processing conditions on thermal pectin degradation[J]. Food Chemistry,2007,105(2):555 -563.
[42] Gerrish T,Higgins C,Kresl. Method of making battered and breaded food composition using calcium pectins[P].US,6261618B1. 2001 -07 -17.
[43] 吴嘉怡,张钧寿,胡林森. 果胶及果胶钙在缓、控释制剂中的应用[J]. 药学进展,2001,25(2):90 -92.
[44] 奚苗苗,张筱芳,张三奇. 果胶及果胶钙在结肠靶向给药系统中的应用[J]. 西北药学杂志,2005,20(4):183 -184.
[45] McCarry P,Greenwood R W,Smith A M,et al. production of calcium pectinate microspheres for oral colonic drug delivery:exploring process parameters[J]. Journal of Pharmacy and Pharmacology,2010,62(10):1 464 -1 465.
[46] 魏秀莉. 果胶/钙在体内结肠定位释药系统的研究[D]. 上海:复旦大学,2006.
[47] Cheng K,Lim L. Insulin-loaded calcium pectinate nanoparticles:effects of pectin molecular weight and formulation pH[J]. Drug Development and Industrial Pharmacy,2004,30(4):359 -367.
[48] Toth D,Tomasovicova D,Gemeiner P et al. Metabolic characteristics of bacterial cells entrapped in beaded calcium alginate and/or pectate gels[J]. Folia Microbiologica,1989,34(6):515 -524.
[49] Nahalka J,Liu Z,Gemeiner P,et al. Nucleoside triphosphates production using recombinant Escherichia coli entrapped in calcium pectate gel[J]. Biotechnology Letters,2002,24:925 -930.
[50] Kurillova L,Gemeiner P,Vikatovska A. Calcium pectate gel beads for cell entrapment. 6. Morphology of stabilized and hardened calcium pectate gel beads with cells for immobilized biotechnology[J]. Journal of Microencapsulation,2000,17(3):279 -296.
[51] 郭秀君,黄雪松. 不同工艺对桔皮果胶钙产量的影响[J]. 食品工业科技,2013,34(16):258 -261.
[52] Olsen A G. Method of preparing pectin[P]. US,2132577. 1938 -10 -11.
[53] 孙磊,翟莉茹,韩剑,等. 冰粉籽中酯化度果胶钙离子络合物对大鼠的降餐后血糖作用[J]. 营养学报,2009,31(1):71 -78.

