果胶酶酶解法辅助超声波法提取山楂中总黄酮的初步工艺优化
高文秀,赵文卓,李平平
(吉林化工学院化学与制药工程学院,吉林吉林132022)
近年来,随着黄酮类化合物的开发与应用,山楂中总黄酮的提取也愈加深入.研究表明山楂中的黄酮类化合物是降血压、降血脂、增加冠脉流量、抗心律失常的有效成分,是评价山楂质量的重要依据[1-5].目前对于山楂中黄酮类化合物的研究现多集中在叶,而山楂果实中黄酮类化合物含量丰富,因此本文利用酶解辅助超声波法对山楂果实中黄酮类化合物进行提取,并对提取工艺进行优化.
山楂果实的细胞壁主要成分是果胶和纤维素,果胶酶可破坏其果胶成分,有利于细胞中黄酮类化合物的溶出[6].而超声波振动可引起细胞内物质运动,使细胞浆流动、细胞震荡,从而使细胞壁变薄.利于溶剂与植物细胞内部的相互渗透,增加了有效成分在溶剂中的溶解[7-9].目前对山楂中总黄酮的提取多采用大孔树脂提取法、热回流法、醇提法、超声波提取法、酶解法等[10-16],但采用果胶酶酶解法辅助超声法提取山楂果实中总黄酮的方法还未见报道.因此,本文采用果胶酶酶解法和超声波法相结合,可以优势互补,在温和可控的条件下提取更多的黄酮类化合物.
1 药品与仪器
1.1 仪器设备
RT-08粉碎机(荣聪精密科技有限公司),DHG-9075A电热鼓风干燥箱(上海一恒科技有限公司),FA2004N电子天平(上海精密科学仪器有限公司),KQ-250B超声仪(昆山市超声仪器有限公司),722N紫外可见分光光度计(上海欣茂仪器有限公司),HH-2数显恒温水浴锅(国华电器有限公司),80-1型离心机(江苏省金坛市正基仪器有限公司)
1.2 原料与试剂
山楂(吉林吉林),槲皮素标准品(科翔生物),果胶酶(活力≥50 U/g,国药集团化学试剂有限公司),无水氯化铝(分析纯,天津市大茂化学试剂厂),无水乙醇(分析纯,天津市大茂化学试剂厂)
2 实验方法
2.1 原料预处理
将干燥后的山楂果实粉碎过80目筛,120℃干燥60 min,备用.
2.2 标准曲线的绘制
精确称取干燥至恒重的槲皮素对照品适量置50 mL容量瓶中,用无水乙醇配制成0.054 mg/mL的溶液,量取4.0 mL置于25 mL容量瓶中,加入5%三氯化铝8.0 mL,无水乙醇定容,摇匀放置10 min.另取25 mL容量瓶,加入5%三氯化铝8.0 mL,加无水乙醇定容,以此为空白,在波长300~500 nm之间进行扫描,确定槲皮素对照品的最大吸收波长,以此波长为测定波长.
精确称取干燥至恒重的槲皮素标准品适量,用无水乙醇配制成0.054 mg/mL的槲皮素溶液,精取0.5、1.0、2.0、3.0、4.0、5.0、6.0 mL 分置 25 mL 容量瓶中,各加入5%三氯化铝的乙醇溶液8.0 mL,再加无水乙醇定容,摇匀放置10 min,另取一个25 mL容量瓶,加入5%三氯化铝的乙醇溶液8.0 mL,用无水乙醇定容,以此为空白.在最大波长处测定吸光度.以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,标准曲线方程:y=10.745x-0.005 7,R2=0.999 2,槲皮素浓度在0.004 8~0.057 6 mg/mL范围内呈良好的线性关系.
3 结果与讨论
3.1 单因素实验
3.1.1 单因素实验设计
分别称取山楂样品1.0 g置于带冷凝管的圆底烧瓶中,分别改变果胶酶的用量、pH值、酶解时间、酶解温度、料液比、乙醇浓度进行单因素实验.40℃超声提取 2次,频率为 40 kHz,时间为30 min.反应结束后,离心分离沉淀,将上清液全部转移置100 mL容量瓶中,加入无水乙醇溶液定容,作为待测样品溶液.精密量取2 mL,置25 mL量瓶中,照2.2标准曲线绘制项下的方法测定吸光度.对照标准曲线,求黄酮提取含量.
3.1.2 单因素实验结果与讨论
由图1~6可知,随着酶量的增加总黄酮的提取量随之增大,但酶量超过50 mg,随着酶量的增加总黄酮提取含量反而下降,这是因为过量的果胶酶覆在山楂的表面阻碍黄酮进入溶液中使提取量下降;当pH为4时,果胶酶的活性最高,酸性较强时酶失活,酸性较弱时导致酶活性降低,而且随着pH的增大溶出的杂质也越来越多;随着乙醇浓度的增大和用量的增加都会使总黄酮的提取量随之增大,但一味的增多会导致提取液中杂质含量增多,不利于进一步的分离并且成本增加;随着温度的升高,山楂黄酮提取含量先升高后降低,因为从热力学角度分析,温度越高越有利于黄酮类化合物的溶出,但温度过高时杂质易溶出,且高温会破坏黄酮化合物;随着时间的延长总黄酮的提取量随之增大,1.5 h以后酶解作用较小,黄酮的提取量明显下降.综合以上分析,通过单因素实验得到总黄酮的最佳提取条件为:果胶酶酶量为50 mg,70%乙醇溶液 40 mL,pH 为 4,50 ℃ 酶解1.5 h.

图1 酶量与黄酮提取含量的关系
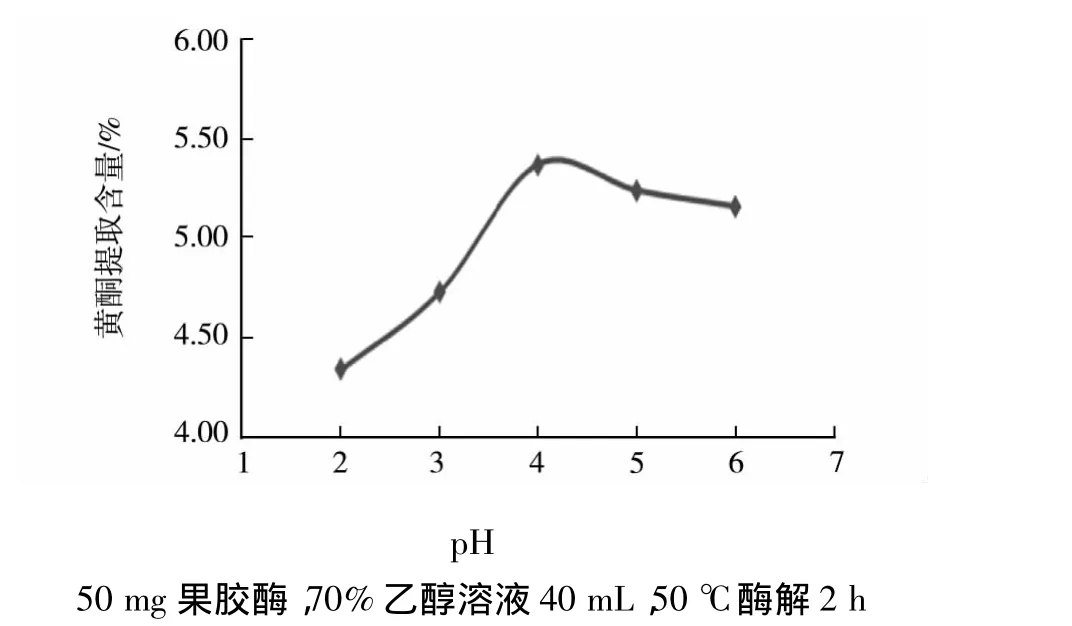
图2 pH与黄酮提取含量的关系

图3 乙醇浓度与黄酮提取含量的关系

图4 料液比与黄酮提取含量的关系

图5 酶解温度与黄酮提取含量的关系
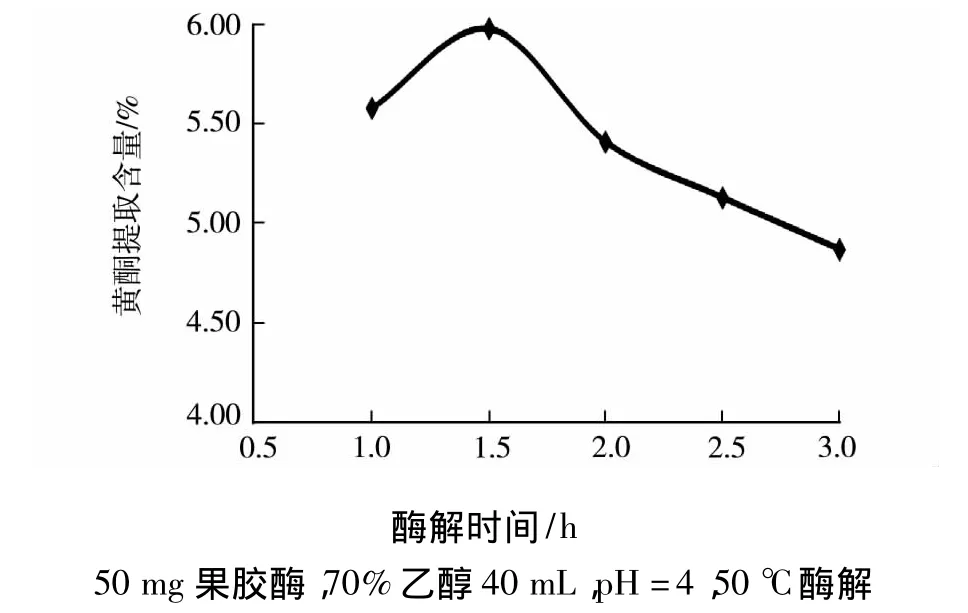
图6 酶解时间与黄酮提取含量的关系
3.2 正交实验
3.2.1 正交实验设计
考察影响山楂总黄酮酶解提取工艺的主要因素为:酶量(A),pH值(B),酶解时间(C),酶解温度(D),并采用紫外-可见分光光度法对提取物中总黄酮的提取量进行测定,并以此为指标进行比较分析,故以 L9(34)正交试验设计,见表1.

表1 正交实验因素水平表
3.2.2 正交实验结果与讨论
取山楂粉1.0 g置于带冷凝管的圆底烧瓶中,加70%的乙醇溶液40 mL,按L9(34)正交表设计方案进行试验,酶解后转移至超声仪中,温度设为40℃,频率为40 kHz,时间为30 min.反应结束后,离心分离沉淀,取上清液于100 mL容量瓶中,无水乙醇定容,作为待测样品溶液.精密量取2 mL于25 mL容量瓶中,照2.2标准曲线绘制项下的方法测定吸光度.对照标准曲线,求得黄酮提取含量,见表2.
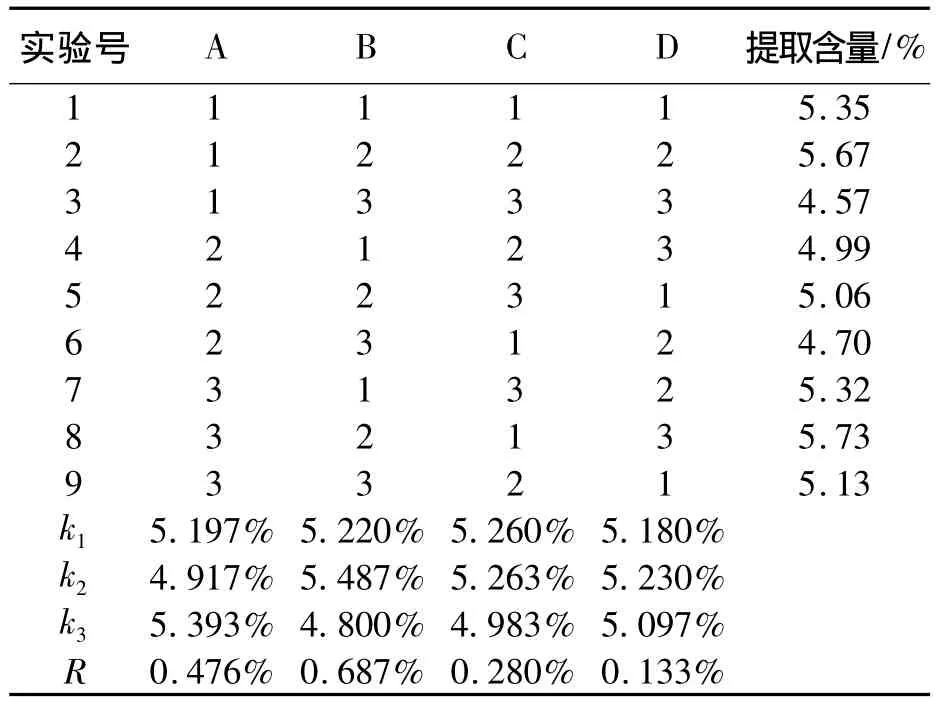
表2 正交试验数据处理
综合上表可知,RB>RA>RC>RD,所以酶解法提取山楂中黄酮的影响因素B>A>C>D,即影响因素的主次顺序为乙醇浓度,酶量,酶解时间,酶解温度.比较k值的大小,可知讨论所得的优化条件组合为A3B2C2D2..
3.3 验证实验
为进一步考察优选工艺的可靠性及稳定性,取3份样品按上述最佳提取工艺条件进行验证实验,测定结果,见表3.
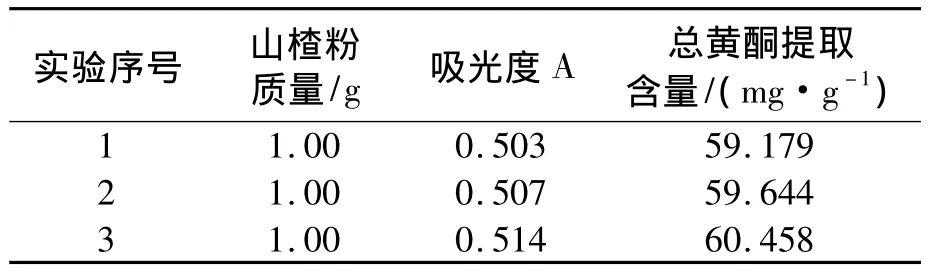
表3 验证试验结果
由表3的三次平行验证试验结果知,山楂中总黄酮的平均提取量为 59.760 mg/g,表明该优选工艺稳定可行.
3.4 对比实验
在该实验相同实验条件下,分别利用超声波法,索氏提取法对山楂总黄酮进行提取,所得数值如下:
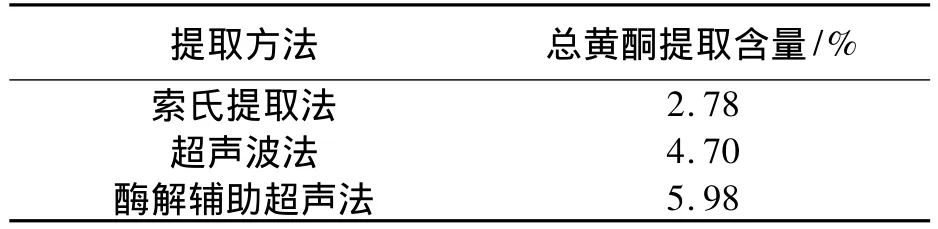
表4 不同提取方法的黄酮提取含量
由上述表格可知,与热回流提取法及超声波提取方法相比,酶解辅助提取法的提取含量比超声波提取方法高21.40%,比索氏提取法的提取含量高53.51%.说明采用酶解法协同超声法提取山楂中的总黄酮确实可以提高总黄酮的提取量.
4 结 论
本实验将果胶酶酶解法辅助超声波提取法应用于山楂果实中总黄酮的提取,对山楂中总黄酮提取工艺进行了新领域的研究.利用单因素实验和正交实验讨论了不同工艺条件对山楂中总黄酮提取含量的影响,优化后的工艺条件如下:果胶酶用量为50 mg/g,50℃酶解1.5 h,70%乙醇溶液40 mL,酶解pH值为4,40℃超声提取30 min,超声频率为40 KHz.在此条件下的总黄酮提取含量为5.98%.酶解法辅助超声法比超声波法的提取含量高21.40%,比索氏提取法的提取含量高53.51%.实验结果证实,采用果胶酶酶解法和超声法两种提取技术相结合提高了黄酮的提取量.
[1]高文秀,祝波,王亚红.酶解法协同超声波法提取山楂中总黄酮的工艺条件优化[J].江苏农业科技,2013,41(3):252-254.
[2]韩秋菊.山楂中黄酮类化合物提取工艺条件优化[J].化学与生物工程,2012,29(6):85-87.
[3]周艳,李连珍,韩丽,等.中药山楂的研究进展[J].民营科技,2008(11):99.
[4]Wei-Tien Chang,Jenny Dao,Zuo-Hui Shao.Hawthorn:Potential Roles in Cardiovascular Disease[J].The American Journal of Chinese Medicine,2005,30(1):1-3.
[5]付起凤,康毅华,林万里,等.正交法优化山楂总黄酮的提取工艺研究[J].中医药信息,2010,3(27):65-67.
[6]庞彩霞,金英姿.果胶酶在果蔬饮料中的应用[J].内蒙古农业科技,2008(1):81-82.
[7]高文秀,祝波,正交实验优选山楂中总黄酮的超声提取工艺[J].吉林化工学院学报,2012,29(11):51-55.
[8]王万能,全学军,陆天健.纤维素酶协同超声波法提取豆粕异黄酮的研究[J].高校化学工程学报,2007,21(3):370-374.
[9]吕帮玉,杨新河.超声波提取山楂叶总黄酮的工艺研究[J].安徽农业科学,2008,36(3):846-847.
[10]刘晓光,毛波,胡立新.酶解法提取山楂黄酮的工艺[J].食品研究与开发,2010,31(8):56-59.
[11]刘北林,董继生,霍红.山楂黄酮最佳提取工艺探讨[J].食品科学,2007,28(6):160-170.
[12]骆晓沛,张守勤,张格,等.不同提取方法对山楂总黄酮含量的影响[J].农机化研究,2008(9):145-146.
[13]张威峰.南山楂总黄酮提取工艺优化研究[J].安徽医药,2010,14(8):890-891.
[14]鲁巍巍,吕德国,李志霞,等.山楂叶总黄酮三种提取方法的比较研究[J].辽宁林业科技,2008(5):9-12.
[15]Guangyan Pan,Guoyong Yu,Julin Qiao etc.Optimization of ultrasound-assisted extraction(UAE)of flavonoids compounds(FC)from hawthorn seed(HS)[J].Ulrrasonics Sonochemistry,2012(19):486-490.
[16]Hao Wang,Zesheng Zhang,Ying Guo etc.Hawthorn fruit increases the antioxidant capacity and reduces lipid peroxidation in senescence-accelerated mice[J].Eur Food Res Technol,2011(232):743-751.

