低分子质量壳聚糖对镉胁迫引起河南华溪蟹氧化损伤的保护作用
樊冰心,任国锐,李瑞金,王 兰,*
(1.山西大学生命科学学院,山西 太原 030006;2.山西大学环境科学与工程研究中心,山西 太原 030006)
镉可以通过食物链传递进入动物体内,诱导机体产生大量活性氧自由基而形成氧胁迫,使机体抗氧化体制失衡,进而对机体造成损伤[1-2]。急性或慢性镉的作用会对动物器官尤其是肝脏产生明显损伤或危害。低分子质量壳聚糖(low molecular weight chitosan,LMWC)具有非常好的抗氧化、提高免疫、促生长和保护肝脏等诸多功能[3-5]。本课题组前期研究已发现,LMWC可以有效清除华溪蟹体内的自由基,提高其非特异性免疫,降低机体内氧化损伤程度[6]。近年来,LMWC抗氧化功能的研究越来越受到研究者的重视。鉴于此,本实验就LMWC和镉独立及共同作用下河南华溪蟹肝胰腺组织中超氧化物歧化酶(SOD)和谷胱甘肽硫转移酶(GST)活性、丙二醛(MDA)和谷胱甘肽(GSH)含量以及镉积累的变化规律进行研究,旨在探讨LMWC对镉引起氧化损伤的防护机制,为更好地利用壳聚糖提供参考。
1 材料与方法
1.1 材料与试剂
河南华溪蟹,于2011年9月购自太原市五龙口水产批发市场,置实验室水族缸(45cm×30cm×30cm)暂养2周以上后待用。养殖所用水为曝气48h的自来水,水温16~20℃,pH7.5,溶氧量8.0~8.3mg/L。每日换水1次,并及时清理缸内排泄物,每周投喂饲料3次。
低分子质量壳聚糖(≤5000D,灰分0.87%,细度80目) 浙江金壳甲壳生物公司;MDA、SOD、GSH和GST试剂盒 南京建成生物工程有限公司;氯化镉(CdCl2·2.5H2O)为分析纯。
1.2 仪器与设备
SpectraMax M5多功能酶标仪 美国分子仪器公司;Varian AA 240FS火焰原子吸收仪 美国安捷伦公司;MR 23低温冷冻离心机 美国Thermo公司;MM-49647-00电动匀浆器 德国Fluko公司;XW-80A漩涡混合器 上海棱谱仪器仪表有限公司;HH-4数显恒温水浴锅 江苏金坛市金城国胜实验仪器厂;CPA225D电子天平 德国赛多利斯公司。
1.3 方法
1.3.1 实验设计
通过镉对河南华溪蟹的急性毒性实验,由概率单位法求得96h时LC50为232.00mg/L[7]。根据LC50的12.5%、25%和37.5%实验设置3个镉处理组(A、B、C组):29、58、87mg/L,3个LMWC组(D、E、F组):20、40、80mg/L,镉(58mg/L)与3个不同质量浓度(20、40、80mg/L)LMWC联合作用组(G、H、I组),同时设对照组,每组设4个平行,处理时间96h。
随机选取60只健康、灵敏且体质量基本一致的河南华溪蟹个体(体质量(20.0±0.5)g)随机分成10组,置处理缸(45cm×30cm×30cm)中,每缸加2L曝气48h的自来水。镉处理组:首先将氯化镉配制成母液,再稀释至各实验质量浓度;LMWC组:根据不同质量浓度加入不同量的LMWC;镉和LMWC联合作用组:加入一定体积的氯化镉母液和不同量的LMWC。处理期间不喂食。
1.3.2 样品制备
将蟹体放在冰盘上活体解剖,迅速取出肝胰腺组织,其中一部分用于测定SOD、MDA、GST和GSH。具体方法:称质量后按1:10(m/V)加入预冷的生理盐水,电动匀浆器匀浆(冰上操作),将匀浆液4℃、4000r/min条件下离心15min,取上清液,-80℃冷冻备用;另一部分用于测定镉积累量,具体方法:在肝胰腺组织中加入混合酸液(高氯酸与浓硫酸的体积比为1:3)过夜,置电热板上,120℃消化4h左右,至棕色气体消失,得到透明溶液。如消化过程样品发生炭化则需补加相同比例的混酸,冷却后消化得到透明溶液用超纯水定容至10mL。
1.3.3 指标测定
SOD、GST活性及GSH、MDA含量和蛋白质水平采用南京建成生物工程有限公司试剂盒说明进行具体操作,镉积累量用火焰原子吸收仪测定。
1.4 数据处理
2 结果与分析
2.1 镉单独处理和LMWC与镉联合作用对河南华溪蟹肝胰腺组织镉积累的影响
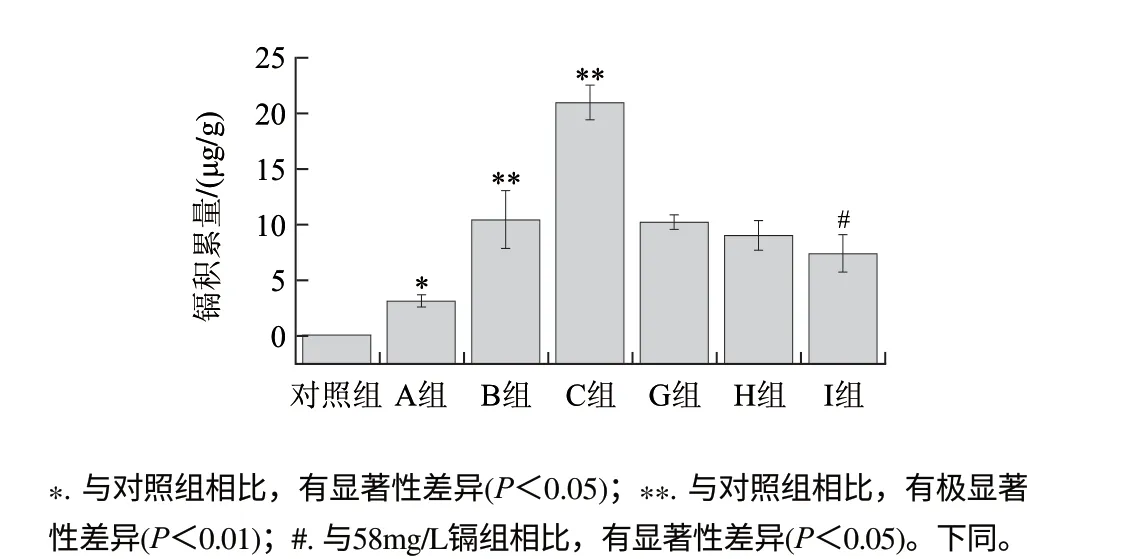
图 1 镉单独处理和LMWC与镉联合处理96h镉在河南华溪蟹肝胰腺组织中的积累Fig.1 Accumulation of Cd2+ in hepatopancreas of S. henanense exposed to Cd2+ alone or to both LMWC and Cd2+ for 96 h
由图1可知,镉在河南华溪蟹肝胰腺组织中的积累随着质量浓度的增加逐渐升高,且3个剂量组与对照组相比均表现出显著或极显著性差异(P<0.05或P<0.01);与58mg/L镉组相比,镉积累随着LMWC浓度的升高逐渐降低,且在80mg/L时表现出显著性差异(P<0.05)。
2.2 镉或LMWC作用下河南华溪蟹肝胰腺组织SOD活性的变化
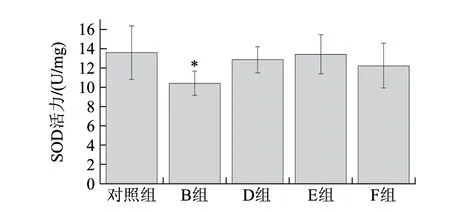
图 2 镉或LMWC处理96h SOD活性在河南华溪蟹肝胰腺组织中的变化Fig.2 SOD activity in hepatopancreas of S. henanense exposed to Cd2+or LMWC for 96 h
由图2可知,与对照组相比,用镉染毒96h,河南华溪蟹肝胰腺组织SOD活性显著下降,呈现显著性差异(P<0.05)。但是,LMWC对SOD活性的变化并未表现出显著性差异。
2.3 镉或LMWC作用下河南华溪蟹肝胰腺组织MDA含量的变化
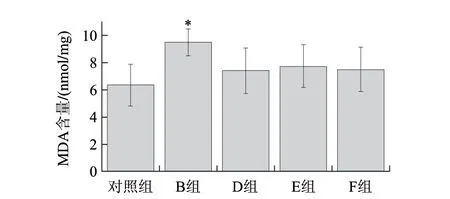
图 3 镉或LMWC处理96h MDA含量在河南华溪蟹肝胰腺组织中的变化Fig.3 MDA content in hepatopancreas of S. henanense exposed to Cd2+or LMWC for 96 h
由图3可知,与对照组相比,镉处理组的河南华溪蟹肝胰腺组织MDA含量显著增加,呈现显著性差异(P<0.05)。但是,LMWC对MDA含量的变化并未表现出显著性差异。
2.4 镉单独处理和LMWC与镉联合作用对河南华溪蟹肝胰腺组织GSH含量的影响

图 4 镉单独处理和LMWC与镉联合处理96h GSH含量在河南华溪蟹肝胰腺组织中的变化Fig.4 GSH content in hepatopancreas of S. henanense exposed to Cd2+alone or to both LMWC and Cd2+ for 96 h
由图4可知,GSH在河南华溪蟹肝胰腺组织中的含量随着质量浓度的增加逐渐降低,且3个质量浓度组与对照组表现出显著性差异(P<0.05);与58mg/L镉组相比,GSH含量随着LMWC质量浓度的升高逐渐升高,且在80mg/L时表现出显著性差异(P<0.05)。
2.5 镉单独处理和LMWC与镉联合作用对河南华溪蟹肝胰腺组织GST活性的影响

图 5 镉单独处理和LMWC与镉联合处理96h GST活性在河南华溪蟹肝胰腺组织中的变化Fig.5 GST activity in hepatopancreas of S. henanense exposed to Cd2+alone or to both LMWC and Cd2+ for 96 h
由图5可知,GST在河南华溪蟹肝胰腺组织中的活性随着染毒质量浓度的增加逐渐降低,且在58mg/L和87mg/L时相对于对照组表现出显著性差异(P<0.05);与58mg/L镉组相比,GST活性随着LMWC质量浓度的升高逐渐升高,且在80mg/L时表现出显著性差异(P<0.05)。
3 讨 论
3.1 镉在河南华溪蟹肝胰腺组织的积累及其脂质过氧化作用
肝胰腺组织是甲壳动物重要的解毒器官,在消除外来有毒物质对生物机体毒害影响方面起着重要作用,同时它也是主要的消化器官,是营养物质消化、吸收和贮存的主要场所,生理代谢活动的中心,更是重金属积累的主要器官[8]。自由基介导的生物体内的氧化损伤是重金属毒性效应的重要体现,脂质过氧化是这种氧化损伤的一种主要形式[9]。SOD是一种以自由基为底物的抗氧化酶,能有效清除超氧阴离子自由基,是生物体内防御氧化损伤的一种非常重要的金属酶。MDA作为脂质过氧化的终产物,能够很好地反应生物体过氧化胁迫的程度。本实验研究发现,镉处理后,河南华溪蟹肝胰腺组织中镉的积累量随着质量浓度的增加逐渐增加,58mg/L镉引起SOD活性显著下降,MDA含量显著上升,提示镉不仅能在溪蟹肝胰腺组织内积累,并可引起脂质过氧化。
3.2 低分子质量壳聚糖对镉胁迫下河南华溪蟹肝胰腺组织的保护作用
LMWC具有纯天然活性及无毒副作用,有研究报道LMWC用于水产养殖可以促进水生动物的生长,对水产养殖起到保护作用[10-11]。本课题组前期研究已发现LMWC与镉联合作用可以使华溪蟹肝胰腺组织SOD活性升高和MDA含量降低[12],LMWC能提高镉胁迫下机体的抗氧化能力。本研究结果表明,在LMWC单独作用下没有引起SOD活性和MDA含量的显著变化,说明LMWC单独作用不会引起河南华溪蟹肝胰腺组织脂质过氧化,不会对华溪蟹的生长带来负面影响。同时,在镉处理下肝胰腺组织中镉的积累量随着质量浓度的增加逐渐增加,但是,在80mg/L LMWC和镉的联合作用下,镉的积累量显著下降。LMWC引起镉在肝胰腺组织积累量下降的原因可能是:1)LMWC是自然界中唯一的一种碱性多糖,水溶性好,其本身具有较多的活性基团(氨基、羟基),这些活性基团可以与重金属有效结合起到去除重金属的作用和良好的解毒作用[13-15],大量的镉在华溪蟹体外被络和,进入体内的量会减少,镉在机体内的积累和毒性明显降低。2)LMWC对肝胰腺组织的保护作用。通常,当外来毒物对华溪蟹造成胁迫时,肝胰腺组织自身有一定的解毒作用。GSH属于含有巯基的、小分子肽类物质,由谷氨酸、半胱氨酸和甘氨酸组成的三肽。GSH作为一种解毒物质,通常在肝胰腺组织中含量最高[16]。GSH对机体中活性氧自由基的清除起着重要的作用,GSH含量的变化可以灵敏地反映机体解毒能力强弱[17]。GSH中半胱氨酸上的巯基为活性基团可以和重金属络合,以巯基-镉的形式将镉排出体外,从而起到解毒的作用;同时GSH作为体内一种重要的抗氧化剂,其本身也极易被氧化,可起到保护蛋白质和酶等分子中巯基不被自由基等毒物氧化,从而使蛋白质和酶发挥其本来的功能[18]。GST广泛存在各种生物组织中,是一种小分子的水溶性蛋白,在机体受到氧化损伤后起着重要的作用[19]。GST可以催化体内的或者外来入侵的有害物质的亲电子基团与GSH中的巯基结合,增强有害物质的疏水性,且易于机体生理排泄,从而达到解毒的目的[20];此外,GST也可以通过修复自由基引起的细胞膜磷脂损伤来抑制氧化反应的发生,从而发挥其抗氧化作用[21]。GSH水平和GST活性的下降,意味着组织解毒能力下降。可见当外界有毒物质大量入侵时,GSH含量的多少和GST活性的高低对机体的解毒能力和抗氧化能力起到非常重要的作用。许多学者研究发现,镉、铅、铜作用于水生动物,随着重金属质量浓度的增大GSH含量和GST活性明显降低[21-23]。本研究表明,镉胁迫下使华溪蟹肝胰腺组织中GSH含量和GST活性显著下降,说明有大量毒物侵害时,华溪蟹肝胰腺组织本身的解毒作用已经不能达到明显的效果。而加入LMWC后,GSH含量和GST活性显著升高,在80mg/L LMWC与镉联合作用时有显著统计学意义。LMWC具有非常好的抗氧化活性,短链壳聚糖分子中的活性官能团更容易暴露出来,不仅有利于清除氧自由基,发挥其抗氧化能力[24],还能通过提高GSH和GST水平,增强机体的解毒能力,减少镉引起的氧化胁迫效应,对华溪蟹肝胰腺组织有积极的保护作用。
[1] CORTICEIRO S C, LIMA A I G, FIGUEIRA E M. The importance of glutathione in oxidative status of Rhizobium leguminosarum biovar viciae under Cd exposure[J]. Enzyme and Microbial Technology,2006, 40: 132-137.
[2] WAISBERG M, JOSEPH P, HALE B, et al. Molecular and cellular mechanisms of cadmium carcinogenesis[J]. Toxicology, 2003, 192(2):95-117.
[3] LI Ruijin, ZHOU Yanying, WANG Lan, et al. Low-molecular-weightchitosan ameliorates cadmium-induced toxicity in the freshwater crab,Simopotamon yangtsekiense[J]. Ecotoxicology and Encironmental Safety, 2011, 74(5): 1164-1170.
[4] 陈勇, 周洪琪, 冷向军, 等. 壳聚糖对异育银鲫生长和消化酶的影响[J]. 中国水产科学, 2006, 13(3): 440-445.
[5] AYYARU G, VENKATESAN A. Immunomodulatory effects of dietary intake of chitin, chitosan and levamisole on the immune system of Cyprinus carpio and control of aeromoans hydrophila infection in ponds[J]. Aquaculture, 2006, 255: 179-187.
[6] 吉晋芳, 王兰, 王茜. 低分子量壳聚糖对镉染毒引起的氧自由基变化的影响[J]. 食品科学, 2008, 29(7): 73-77.
[7] 闫博, 王兰, 李涌泉, 等. 镉对长江华溪蟹肝胰腺抗氧化酶活力的影响[J]. 动物学报, 2007, 53(6): 1121-1128.
[8] SWIERGOSZ-KOWALEWSKA R, BEDNARSKA A, KAFEL A.Glutathione levels and enzyme activity in the tissues of bank vole Clethrionomys glareolus chronically exposed to a mixture of metal contaminants[J]. Chemosphere, 2006, 65: 963-974.
[9] 金芬芬, 徐团, 秦圣娟. 镉对长江华溪蟹肝胰腺线粒体抗氧化酶活力和脂质过氧化水平的影响[J]. 水生生物学报, 2011, 35(6):1019-1024.
[10] 陆清儿, 刘新轶, 王宇希, 等. 壳聚糖及其复合物对三角鲂生长及鱼体成分的影响[J]. 淡水渔业, 2008, 38(1): 70-73.
[11] 徐介民, 赵玉蓉, 王红权, 等. 不同浓度的壳聚糖对草鱼生长的影响[J]. 饲料研究, 2008(3): 54-55.
[12] LI Ruijin, ZHOU Yanying, WANG Lan, et al. Oxidative damages by cadmium and the protective effects of low-molecular-weight chitosan in the freshwater crab (Sinopotamon yangtsekiense Bott 1967)[J].Aquaculture Research, 2011, 42: 506-515.
[13] YIN Heng, DU Yuguang, ZHANG Junzeng. Low molecular weight and oligomeric chitosans and their bioactivities[J]. Current Topics in Medicinal Chemistry, 2009, 9(16): 1546-1559.
[14] SUN Tao, ZHOU Dongxiang, MAO Fang, et al. Preparation of chitosan oligomers and their antioxidant activity[J]. European Food Research and Technology, 2007, 225: 451-456.
[15] 郭梅杰, 刘振, 李梅. 壳聚糖吸附重金属离子的研究进展[J]. 化工环保, 2004, 24(4): 262-265.
[16] ROGERIO L, VALFREDO T F. Competitive adsorption of Cu(II) and Cd(II) ions by chitosan crosslinked with epichlorohydrin-triphosphate[J].Bioresource Technology, 2011, 102: 8769-8776.
[17] VIJAYAVEL K, GOPALAKRISHNANOP S, THILAGAM H,et al. Dietary ascorbic acid and α-tocopherol mitigates oxidative stress induced by copper in the thornfish Teraponjarbua[J]. Science of the Total Environment, 2006, 372: 157-163.
[18] 程时, 丁海勤. 谷胱甘肽及其抗氧化作用今日谈[J]. 生理科学进展,2002, 33(1): 85-90.
[19] ZHANG Linbao, QIU Lihua, WU H F, et al. Expression profiles of seven glutathione S-transferase (GST) genes from Venerupis philippinarum exposed to heavy metals and benzo[a]pyrene[J].Comparative Biochemistry and Physiology: Part C, 2012, 155:517-527.
[20] 陈荣, 刘辉, 李东晓, 等. 水生动物谷胱甘肽硫转移酶研究进展[J].厦门大学学报: 自然科学版, 2006, 45(2): 176-184.
[21] CAO Liang, HUANG Wei, SHAN Xiujuan, et al. Tissue-specific accumulation of cadmium and its effects on antioxidative responses in Japanese founder juveniles[J]. Environmental Toxicology and Pharmacology, 2012, 33: 16-25.
[22] 陈亮, 郭红岩, 沈红, 等. 低浓度铅暴露对鲫鱼肝脏抗氧化系统的影响[J]. 环境化学, 2002, 21(5): 485- 489.
[23] 刘慧, 王晓蓉, 王为木, 等. 铜及其EDTA配合物对彭泽鲫鱼肝脏抗氧化系统的影响[J]. 环境化学, 2004, 23(3): 263-267.
[24] 王鑫, 林强, 田平芳, 等. 低分子量壳寡糖改型糖尿病大鼠症状及其作用机制研究[J]. 食品科学, 2007, 28(11): 529-532.

