人参皂苷Rg3的脂肪酸衍生物的合成及其体外抗肿瘤活性
叶 慧,张 兵,蒋海伟,程文娟,邓泽元,胡蒋宁,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学生命科学与食品工程学院,江西 南昌 330031)
人参为五加科植物人参(Panax ginseng C.A. Meyer)的根,在我国具有悠久的药用历史,对人体有滋脾益肺、生津止渴、安神益智、调荣养卫、大补元气、复脉固脱等功效[1-3]。其中主要有效成分人参皂苷(gingenoside)为固醇类三萜皂苷化合物,约占人参的4%。人参皂苷具有抗癌、抗动脉粥样硬化、抗疲劳等作用,其中人参皂苷Rg3效果突出[4-6]。人参皂苷Rg3为四环三萜皂苷,由日本学者北川勋在1983年首次从朝鲜红参中分离出,并鉴定其结构[7]。其抗癌作用主要作用于细胞的增殖周期的G2/M期,可有效抑制肿瘤细胞有丝分裂前期蛋白质和ATP的合成,使肿瘤细胞增殖速度减慢[8]。据文献报道,人参皂苷Rg3对肺癌、胃癌、肠癌、乳腺癌、肝癌等肿瘤细胞的增殖有良好的抑制作用[9-13],以及明显降低B16F17黑色素瘤肺细胞转移的功效[14]。同时,张艳等[14]通过对小鼠注入一定剂量的人参皂苷Rg3,延长了小鼠爬杆时间,提高疲劳小鼠的肌糖元含量,降低小鼠BUN含量,提高小鼠肌肉组织Na+-K+-ATP酶活力验证了人参皂苷Rg3的抗疲劳作用。然而,日本学者Hasegawa等[15]对人参皂苷在体内代谢过程做了大量工作。其研究结果表明大部分人参皂苷在体内代谢过程中直接排泄掉,有少量的人参皂苷经肠内菌复杂的代谢,降解掉侧链上若干糖基,降低极性,进入体内发挥作用[16]。国内学者谢海堂等[17]通过建立Caco-2细胞模型,研究人参皂苷Rg3的摄取和代谢机制也表明其生物利用率较低。
本实验旨在通过人参皂苷Rg3的棕榈酸酸衍生物的合成,分离纯化得到较纯的产物并进行结构鉴定,研究其对人乳腺癌细胞株MCF-7增殖的抑制作用,为新的抗肿瘤药物临床治疗做前期探索性实验。
1 材料与方法
1.1 材料、试剂与仪器
MCF-7细胞株 美国ATCC公司。
DMEM培养基 美国Gibco公司;胎牛血清、非必需氨基酸 美国Hyclone公司;谷氨酰胺、胰蛋白酶 美国Sigma公司;人参皂苷Rg3、棕榈酸酰氯 美国阿拉丁试剂公司;其余所用试剂均为分析纯。
UV-2450紫外分光光度计 日本岛津公司;Nicolet 5700智能傅里叶红外光谱仪 美国Nicolet公司;Agilent 1100高效液相色谱仪、Agilent 6538Accurate-Mass Q-TOF LC/MS 美国Agilent公司; Bruker 600核磁共振仪 德国Bruker公司;二氧化碳培养箱 德国Hearous公司;SX-40扫描电子显微镜 日本Hitachi公司。
1.2 方法
1.2.1 合成
人参皂苷Rg3 432mg、棕榈酸酰氯302.7mg、称取K2CO3190.7mg为缚酸剂,以CH2Cl2为溶剂,在40℃条件下加热搅拌6h,TLC跟踪反应进程。反应结束后,加适量硅胶旋干制样。
1.2.2 分离纯化
取上样量的15倍的硅胶(200~300目)70℃烘干,以少量无水Na2SO4以氯仿、甲醇体积比12:1、10:1、8:1为洗脱剂,梯度洗脱。每管接4~6mL,TLC检测,合并相同组分,旋干,得到白色化合物2。
1.2.3 鉴定
采用高效液相色谱法,色谱柱:Water C18(3.9mm × 150mm,4μm),检测器:紫外检测器(DAD),检测波长:203nm,检测柱温:25℃,流动相:85%甲醇和15%水,流速:1.000mL/min,进样量:10μL。紫外全波长扫描检测(190~550nm),质谱条件:电子轰击(EI)离子源;电子能量70eV;传输线温度275℃;离子源温度200℃;激活电压1.5V;质量扫描范围m/z 100~1500。红外光谱检测采用KBr压片制样。核磁共振检测,13C NMR(400MHz,DMSO)。
1.2.4 体外抗肿瘤实验
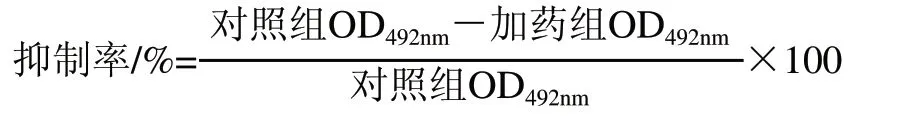
参照文献[18]做如下改进。采用MTT法检测,收集处于对数生长期的肿瘤细胞加入生长液(DMEM)稀释,在计数板上计数,细胞密度约为2×103~2×104个/mL。取配好的肿瘤悬浮液180μL置于96孔细胞培养板中,培养24h后,加入受试药物20μL(受试药物用少量的DMSO助溶,用PBS缓冲液稀释成4个质量浓度,分别为12.5、25、50、100μg/mL,每个质量浓度5孔,阴性对照为配药所用相同比例的溶剂和培养基,空白对照加等体积的DMEM培养液,在37℃、5% CO2培养箱中分别孵育24、48、72h,加入甲瓒15μL,DMEM培养液135μL,37℃温育4h,去上清液加入150μL DMSO使甲攒溶解,振荡器摇匀,用酶标仪在492nm波长处测定各孔光密度值(OD492nm)。并以相同质量浓度梯度的人参皂苷Rg3为阳性对照组,0.1%名称DMSO溶液为溶剂对照组。按照下式计算抑制率。
2 结果与分析
2.1 高效液相色谱法分离、纯化
利用高效液相色谱法分别检测Rg3标准品、反应后混合物,以及分离纯化所得的新化合物,结果见图1。人参皂苷Rg3的最大吸收峰为7min左右,而纯化后的生成物最大吸收峰为12min左右。根据理论预测,在人参皂苷Rg3分子结构,两分子伯醇的羟基化学性质较为活泼,有可能与两分子的棕榈酸酰氯反应,生成酯化物,其分子极性降低。此结果表明,硅胶柱柱层析分离所得衍生物纯度较纯,且产物相比人参皂苷Rg3具有较小的极性,符合推测。


图 1 高效液相色谱图Fig.1 HPLC profiles of ginsenoside Rg3, derivatization products and compound A
2.2 结构鉴定
Rg3:13C NMR (DMSO 400MHz)δ:88.15(C-3)、103.16(Glc C-1)、81.30(Glc C-2)、76.82(Glc C-3)、76.39(Glc C-4)、76.82(GlcC-5)、72.47(Glc C-6)、103.85(Glc C-7)、76.50(Glc C-8)、76.82(Glc C-9)、76.08(Glc C-10)、76.82(Glc C-11)、71.96(Glc C-12)。参照文献[19]进行对比,此化合物为人参皂苷Rg3。
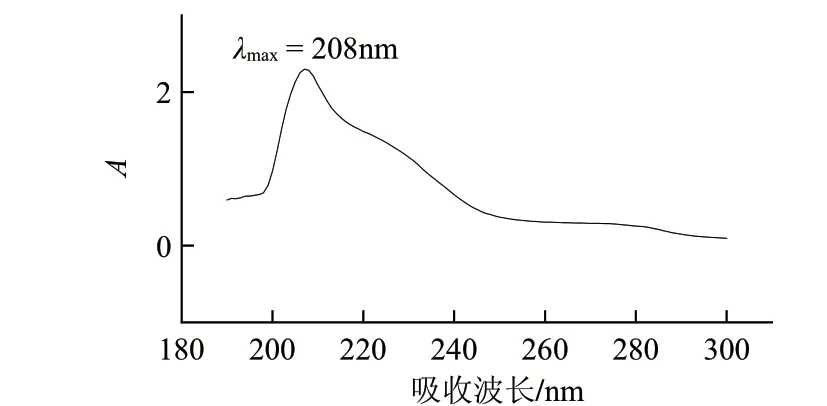
图 2 化合物A紫外吸收光谱Fig.2 UV absorption spectrum of compound A
由图2可知,化合物A最大吸收波长为208nm,表明该衍生物具有三萜皂苷类化合物特征吸收。

图 3 化合物A的红外吸收光谱Fig.3 IR spectrum of compound A
由图3可知,化合物A在3884.83cm-1存在-OH伸缩振动,2938.92 cm-1存在亚甲基伸缩振动,1750.42、1203.48cm-1存在C=O振动,1642.18cm-1存在C=C振动,1078.55cm-1存在O-C-O振动,724.29cm-1存在-CH2振动。衍生物除仍具有人参皂苷Rg3主要官能团外,由1750.42、1203.48cm-1推断分子结构中含有的羰基,由724.29cm-1推断其结构中具有长碳链。

图 4 化合物A质谱图Fig.4 Mass spectrum of compound A
由图4可知,EIS[M-H]-= 1259.82,又因为Rg3相对分子质量为785.01,棕榈酸酸酰氯相对分子质量为274.88,提示Rg3与两分子的棕榈酸酰氯发生取代反应。人参皂苷Rg3分子结构中含有两个伯羟基,都位于C3位的葡萄糖末端(图5),容易与棕榈酸酰氯发生取代反应。
由化合物A13C NMR碳谱图分析可知,13C NMR (DMSO 400MHz) δ:88.84(C-3’)、104.14(Glc C-1’)、81.40(GlcC-2’)、77.71(Glc C-3’)、76.59(Glc C-4’)、77.33(GlcC-5’)、73.05(Glc C-6’)、104.35(Glc C-7’)、76.68(Glc C-8’)、77.82(Glc C-9’)、76.27(Glc C-10’)、77.33(Glc C-11’)、73.27(Glc C-12’)、173.13(Glc C-6’-a)、33.43(Glc C-6’-b)、25.27(Glc C-6’-c)、29.41(Glc C-6’-d)、28.23(Glc C-6’-e)、29.54(Glc C-6’-f)、29.60(Glc C-6’-g)、29.60(Glc C-6’-h)、29.61(Glc C-6’-i)、29.70(Glc C-6’-j)、29.54(Glc C-6’-k)、29.63(Glc C-6’-l)、29.85(Glc C-6’-m)、31.91(Glc C-6’-n)、23.63Glc C-6’-o)、14.25(Glc C-6’-p)、173.14(Glc C-12’-a)。其中,δ=173.13、173.14,提示衍生物结构中含羰基,与红外光谱结果吻合,可推断人参皂苷Rg3骨架上C3以及所连葡糖糖基团发生化学位移。可以判断,两分子的棕榈酸酰氯取代了C3位葡萄糖基团末端羟基中的H。因此,鉴定该衍生物为人参皂苷Rg3棕榈酸二酯,分子式为C75H134O14,结构如图5所示。

图 5 人参皂苷Rg3及其衍生物结构图Fig.5 Chemical structures of ginsenose Rg3 and compound A
2.3 对MCF-7人类乳腺癌细胞株的生长抑制作用
MTT法检测Rg3衍生物抑制MCF-7细胞增殖作用,并用酶标仪在492nm波长处测定各孔光密度值(OD492nm),并计算抑制率IR。

图 6 人参皂苷Rg3衍生物对MCF-7细胞株的抑制作用 Fig.6 Comparison of the frowth-inhibitory effects of ginsenose Rg3 and compound A on MCF-7 cell line
由图6可知,药物作用24、48、72h的半数抑制率分别为146.68、122.39、101.95μg/mL。人参皂苷Rg3棕榈酸衍生物能够有效抑制MCF-7细胞的生长,抑制作用随质量浓度的增大而增强,随着药物作用的时间增长而增强。与前体化合物人参皂苷Rg3阳性对照进行比较,对MCF-7细胞株的抑制作用无明显差别。而空白对照组中,含有0.1% DMSO的PBS缓冲液对细胞株的存活率无明显影响。
3 结 论
通过棕榈酸酰氯与人参皂苷Rg3反应合成了人参皂苷Rg3脂肪酸衍生物,以不同比例氯仿甲醇为洗脱剂进行硅胶柱柱层析分析纯化而得较纯衍生物,并通过高效液相色谱法、UV、IR、核磁共振等手段鉴定其机构。该衍生物增强了人参皂苷Rg3的脂溶性。初步研究了其体外抗肿瘤活性,结果显示,该衍生物对MCF-7肿瘤细胞生长有较强抑制作用且具有质量浓度与时间依赖性。为研究人参皂苷前药提供了有力的实验条件,但此类人参皂苷衍生物的生物利用率,抗肿瘤活性机制,以及其他生物活性都有待进一步的深入研究探索。
[1] 石楸鸣. 人参皂苷的药理作用研究进展[J]. 中国药房, 2010(31): 2967-2969 .
[2] 赵文莉, 张立实, 李宁. 人参皂甙的药理及毒性作用研究进展[J]. 国外医学: 卫生学分册, 2008, 35(3): 165-169.
[3] 任莉莉, 魏影非, 杜惠兰. 人参抗肿瘤作用研究进展[J]. 中成药, 2005, 27(8): 947-950.
[4] 王铁生. 中国人参[M]. 沈阳: 辽宁科学技术出版社, 2001.
[5] 赵翌, 刘基巍. 20(R)-人参皂甙Rg3抗肿瘤作用的研究进展[J]. 临床肿瘤学杂志, 2001, 6(1): 81-82.
[6] COON J T, ERNST E. Panax ginseng: a systematic review of adverse effects and drug interactions[J]. Drug Saf, 2002, 25(5): 323-344.
[7] KITAPWA L, YOSHIKAWA M, YOSHIHAWA M, et al. Chemical studies on crude drugs[J]. Yakugaku Zasshi, 1983, 103(6): 612-622.
[8] 高勇, 王杰军, 许青, 等. 人参皂甙Rg3抑制肿瘤新生血管形成的研究[J]. 第二军医大学学报, 2001, 22(1): 40-42.
[9] 王兵, 王杰军, 徐钧, 等. 人参皂苷Rg3对胃癌诱导血管内皮细胞增殖的抑制作用[J]. 肿瘤防治杂志, 2001, 8(3): 234-236.
[10] IISHI H, TATSUAT M, BABA M, et al. Inhibition by ginsenoside Rg3 of bombesin-enhanced peritoneal metastasis of intestinal adenocarcinimas induced by azoxymethane in Wistar rats[J]. Clin Exp Metastasis, 1997, 15(6): 603-611.
[11] 陈大富, 赵杨冰, 白绍槐, 等. 人参皂甙Rg3对裸鼠原位种植人乳腺浸润性导管癌的抗癌作用及其机制的研究[J]. 华西医学, 2002, 17(3): 296-298.
[12] 刘基巍, 赵翌, 富力, 等. PCNA, P16, MMP9在人参皂苷Rg3抗肝癌淋巴道转移中的表达及意义[J]. 临床肿瘤学杂志, 2004, 9(3): 225-228.
[13] MOCHIZIKI M, ANTHONY M P, BROOK P C, et al. Inhibitory effect of tumor metastasis inmice by saponin, ginsenosideRb2, 20(R)-and 20(S)-ginsenoside-Rg3 of red ginseng[J]. Biol Pharm Bull, 1995, 18(9): 1197-1202.
[14] 张艳. 人参皂苷Rg3的抗疲劳作用研究[D]. 吉林: 吉林大学, 2007.
[15] HASEGAWA H, LEE K S, NAGAOAK T, et al. Pharmacokinetics of ginsenoside deglycosylated by intestinal bacteria and its transformation to biologically active fatty acid esters[J]. Biol Pharm Bull, 2000, 23: 298-304.
[16] 曹汐汐. RACK1对人乳腺癌增殖、迁移和侵袭转移的影响及相关机制的研究[D]. 上海: 复旦大学, 2010.
[17] 谢海堂, 王广基, 赵小辰, 等. Caco-2细胞对人参皂苷Rg3的摄取及代谢研究[J]. 中国临床药理学与治疗学, 2004, 9(3): 258-262.
[18] 徐泽平. 茶多酚诱导人乳腺癌MCF-7细胞凋亡及机理研究[D]. 广州: 华南理工大学, 2011.
[19] 李欣. 人参皂苷Rg3的制备[D]. 南京: 南京工业大学, 2003.

