定量PCR检测激光切割的若干细胞中基因NGF转录本
黄国韦
(汕头大学 医学院病理学教研室,广东 汕头 515041)
激光显微切割技术能够切割特定的靶细胞并进行核酸、蛋白分析.目前,激光显微切割技术可以切割至少200个细胞,并提取总RNA后,运用定量PCR技术分析基因的转录本[1].然而,切割少量细胞进行基因转录本的分析尚未见报道,本研究方案运用激光显微切割技术切割20个大鼠海马神经元细胞,在不提取RNA的情况下,进行NGF基因转录本的定量检测.
1 材料与方法
1.1 材料
SD大鼠,显微切割专用载玻片,0.5ml PCR管(EPPENDORF),无RNA酶的吸头、八连管(Xygene),DNase I(Invitrogen),NP-40(上海生工),小鼠抗NeuN(Millipore),驴抗小鼠IgG偶联 NL577荧光基团(R&D),定量PCR检测试剂盒(Takara),引物(上海生工)、7300定量PCR仪(ABI),反转录试剂盒(Toyobo),全自动激光切割系统(Leica).所有的PBS均用DEPC水处理.
1.2 方法
1.2.1 免疫荧光
出生后2-3个月大鼠被断颈处死,去除海马组织,在液氮中速冻后进行冷冻切片,切片厚度为5μm,95%的乙醇固定5分钟后,用含2M NaCl的PBS洗涤,小鼠抗NeuN的抗体室温抚育5分钟,洗涤后再用驴抗小鼠IgG偶联NL577荧光基团室温抚育5分钟,用含2M NaCl的PBS洗涤后,95%乙醇、100%乙醇、二甲苯依次处理1分钟,进行显微切割.
1.2.2 细胞裂解
提前滴加含3%NP-40的DNaseI buffer 10μl在0.5mlPCR管盖上,切割的细胞收集在管盖中,置于42°C抚育20分钟,管子倒置.
1.2.3 DNase I处理RNA后进行反转录
添加 2ul DNase I buffer、2ul DNase I、6ul无核酸酶水至上述离心管中,室温放置15分钟后进行反转录.反转录体系如下:4μl 10x RT buffer,4μl 25mM MgCl2,2μl 0.1M DTT,1μl 40U/μl RNaseOUT,1μl 200U/μl SuperScipt III RT.管子倒置,室温10分钟,再置于50℃的水浴锅中50分钟后,置于85℃ 5分钟,1μl RNase H添加至反应体系中,37℃ 20分钟后,进行定量PCR检测.
1.2.4 定量PCR检测
50μl的反应体系由 25μl Sybr Premix Ex Taq,1μl ROX reference dye,0.125μl 40pmol/μl上游引物,0.125μl 40 pmol/μl下游,2μl cDNA模板和21.75μl无核酸酶的水.反应体系按照95℃,5秒;60℃退火31秒,40个循环.
2 结果
免疫荧光检测神经元NeuN,特异切割20个大鼠海马神经元细胞,如下图1:
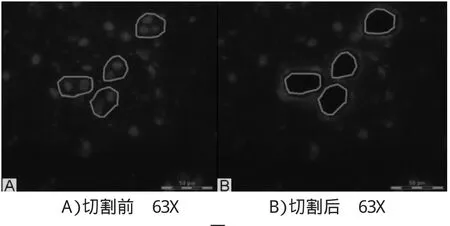
图1
PCR检测切割细胞中的NGF转录本,GAPDH作为内参,结果如下图2:
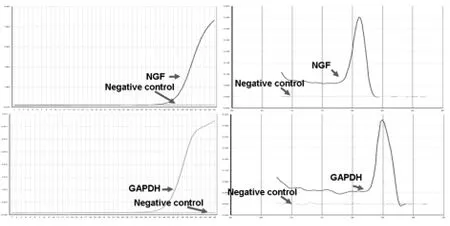
图2 定量PCR检测NGF和GAPDH转录本
由图2可知,NGF的扩增曲线(A)和融解曲线(B)是特异性的,作为内参,GAPDH的扩增曲线(C)和融解曲线(D)也是特异的.因此,在切割的20个细胞中,我们可以对NGF的转录本进行定量PCR检测.
3 讨论
神经因子(NGF,Nerve growth factor)简单来说,是一种蛋白质.在很多动物中可以得到.神经因子可以调节周围和中枢神经元的生长发育,维持神经元的存活.神经生长因子(NGF)是神经营养因子中最早被发现,目前研究最为透彻的,具有神经元营养和促突起生长双重生物学功能的一种神经细胞生长调节因子,它对中枢及周围神经元的发育、分化、生长、再生和功能特性的表达均具有重要的调控作用.NGF包含α、β、γ三个亚单位,活性区是β亚单位,由两个118个氨基酸组成的单链通过非共价键结合而成的二聚体,与人体NGF的结构具有高度的同源性,生物效应也无明显的种间特异性[2].
当神经受损伤后NGF的表达增加.有利于受损神经元恢复.实验证明NGF mRNA在切割小鼠跖肌后2-4h内开始增长,切割后NGF免疫反应性结构形成,大多与切割的部位相邻.此外,NGF可影响多种因子在背根神经节的表达[3].有实验研究了TrkB缺失对于NGF及其受体的影响发现TrkB缺失的小鼠NGF和TrkA表达水平降低降低的TrkB有益于神经损伤处的神经移植,TrkB缺失导致损伤处肥大细胞的聚集[4].
通过激光显微切割技术结合免疫荧光,特异切割大鼠海马神经元细胞,定量PCR检测NGF的变化,可将大鼠海马病变造成的神经生物学病变与NGF的变化联系起来,为进一步针对NGF的临床治疗提供参考依据.
〔1〕Porombka D,Baumg artner W,and Herden C.USA:J Virol Methods.2008,148(3):58–65.
〔2〕于一凡,谭晓琳.神经生长因子与周围神经病变相关性研究进展 [J].中国现代医药杂志,2009(1l):128-130.
〔3〕Wu C,Boustany L,I.iang H,et a1.Nerve growth factor expression after plantar incision in the rat[J].USA:Anesthesiology,2007,107(1):128-135.
〔4〕Kotulska K,Magdalena LB,Wieslaw M,et a1.The influence of trkB deficiency on long-term outcome of peripheral nerve injury in mice.England:Folia Neuropathol,2007,45(2):82-92.

