海洋酸化和升温对中间球海胆幼虫发育和生长的影响
秦艳杰,宋晓楠,李霞,赵祥吉、2
(1.大连海洋大学农业部北方海水增养殖重点实验室辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023; 2.江西省上饶市鄱阳中学,江西上饶333100)
海洋酸化和升温对中间球海胆幼虫发育和生长的影响
秦艳杰1,宋晓楠1,李霞1,赵祥吉1、2
(1.大连海洋大学农业部北方海水增养殖重点实验室辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023; 2.江西省上饶市鄱阳中学,江西上饶333100)
为了研究海洋酸化和气候变暖对海洋生物的联合作用,按照文献 [4]和 [7]中对海洋环境变化的预测趋势,设置了3组海水,即对照组 (pH为7.93~7.99,水温T为18℃)、试验组E3(在对照组基础上pH减小0.3,T升高3℃)、试验组E6(在对照组基础上pH减小0.6,T升高6℃),在此条件下对中间球海胆Strongylocentrotus intermedius幼虫的发育及生长情况进行了研究。结果表明:酸化及升温海水对海胆孵化率没有显著影响;E3组海胆与对照组发育进程一致,而E6组则较慢;E3和E6组海胆分别存活了18 d和12 d,分别发育至八腕幼虫和四腕幼虫阶段,可见试验海水环境严重影响海胆幼虫的存活;E3组海胆幼虫的生长在受精后的前10 d与对照组差异不显著 (P>0.05),之后显著低于对照组 (P<0.05),而E6组海胆幼虫的生长在整个试验阶段均显著低于对照组 (P<0.05);将骨针长度分解为口后腕骨针长度和躯干部骨针长度,各组海胆的生长差异主要表现在口后腕骨针长度上;试验组长腕幼虫畸形均不同程度地表现为腕短小、萎缩、腕骨针折断、骨针弯曲变形等。研究表明,中间球海胆对海洋酸化和气候变暖的海洋环境非常敏感,如果按照预测趋势,海洋环境变化将会对该海胆产生严重的负面影响。
中间球海胆;海洋酸化;升温;幼虫发育;生长
随着人类活动所排放的CO2日益增多,海洋吸收的CO2也将逐年增长,海水的化学性质将显著改变,从而导致海水逐渐酸化。有报道指出,自工业革命以来的250年里,海洋的酸性增加了30%,海洋表层海水的pH值下降了0.1个单位[1]。有预测表明,到2100年海水pH值将下降0.3~0.5个单位[2-4],到2300年可能下降0.77个单位[5]。一些特殊的环境也会影响pH,例如上升流区、深海区、潮间带池塘等[6]。另外,人类活动使得温室气体和碳粒粉尘排放增加,这些物质都具有吸热和隔热的功能,使太阳辐射到地球上的热量无法向外层空间发散,这也是引起地球升温的原因之一[2]。自1975年以来,地球表面的平均温度已经上升了0.5℃,由温室效应导致的全球变暖已成为人们关注的焦点。科学家预测:如果地球表面温度的升高按现在的速度继续发展,到2050年全球温度将上升2~4℃[7]。
海水酸化可能通过影响酸碱平衡对生物造成影响,对浮游幼虫阶段的影响可能更加明显[8]。国外已有报道表明,牡蛎Crassostrea gigas[9]、桡足类Calanusfinmarchicus[10]和棘皮动物海蛇尾Ophiothrix fragilis[11]都会受到酸化的影响。另外,pH的下降也会降低碳酸钙的饱和度,增加石灰岩的溶解度。因此,钙化生物如珊瑚、有孔虫、贝类、腕足动物和棘皮动物可能受到威胁[12]。国内有关环境因子对中间球海胆Strongylocentrotus intermedius生长发育的研究只局限于饵料、镉、农药等方面[13-15],至今尚未见温度和海水酸化联合作用对其影响的报道。本研究中,作者通过海水酸化和升温双因子联动模拟试验,研究了中间球海胆幼虫生长、发育可能受到的影响,旨在揭示海水酸化和升温对模式动物海胆幼虫发育和生长的影响模式和规律,预测当地海洋生物在面临气候变化时的反应和命运,为海洋环境保护相关措施的制定提供科学依据。
1 材料与方法
1.1 材料
试验海胆选用壳径为(6.07±0.18)cm且性腺发育成熟的种胆,取自大连新碧龙海产有限公司。
1.2 方法
1.2.1 试验海水环境的设置 根据全球气候变化中海洋酸化日益严重及海水温度日益上升的双重趋势,设置双因子联动试验。试验设对照组和两个试验组 (E3、E6),其中对照组海水pH为自然海水(pH为7.93~7.99),水温T为18℃;E3组海水在对照组基础上pH减小0.3,T升高3℃,记为pH-0.3&T+3℃;E6组海水在对照组基础上pH减小0.6,T升高6℃,记为pH-0.6&T+6℃。各组均设2个重复,试验在10 L水槽中进行。
试验中通过注入CO2调节酸化环境,对照组pH基本维持稳定,酸化试验组需对pH、溶解氧进行实时监测,并适时补充CO2,使其pH浮动范围<0.1个单位,溶解氧饱和度>90%。采用雷磁PHS-3C型精密pH计测定pH值,采用滴定法测定溶解氧。试验过程中,每天用事先调整到相应pH和温度的海水将每组半量换水一次。
1.2.2 海胆幼虫的培育及指标的测定 2012年10月19日,选取性腺发育成熟的种胆,从围口膜体腔注射1~2mL 50 g/L的KCl溶液,催产1~2min后开始排出精、卵。选取精、卵质量好的个体各1个,将精、卵以约1 000∶1的比例进行混合受精。受精后约5 h,海胆发育至32~64细胞期时倒入各组海水中避光进行孵化,孵化密度为 40~50个/mL。幼体破膜孵化出来并上浮时进行选育定量,同时计算各组幼虫孵化率 (上浮的幼虫数/受精卵总数)。然后进行幼虫培育,培育密度为1~2个/mL,每天投喂4次角毛藻,每升水中投喂约1 mL饵料 (浓度为100~200万个/mL)。
在选育定量后,每天对各组幼虫的发育进程进行观察,同时对各组幼虫的密度进行测定,统计畸形率。每两天用筛绢网捞取1次海胆幼虫,综合参照Moulin等[6]和Brennand等[16]的方法测量海胆的生长情况,各测量指标如图1所示。每个试验组测定不少于40个个体,在Olympus CKX41倒置相差显微镜下观察、测量,并用Nikon D7000数码相机进行拍照。
1.3 数据处理
利用SPSS 11.5软件对各组幼虫的生长指标进行单因素方差分析,用Duncan法进行多重比较。
2 结果
2.1 各组海胆的发育进程
各组海胆受精卵的孵化率均达到85%以上,且各试验组间无显著差别 (P>0.05)。
当试验进行到受精后第12天时,E6组用筛绢网捞取3次仅获得18个个体并进行生长指标测量,受精后第14天时所有个体均严重畸形死亡;受精后第18天时,E3组仅获得16个个体并进行生长指标测定;受精后第20天时,E3组用筛绢网仅捞得海胆八腕幼虫2个,且均为畸形个体,无法继续测量统计,因此试验结束。从发育进程来看,与对照组相比,虽然E3组幼虫首先发育至四腕和六腕阶段,E3组幼虫在存活时间内发育速度与对照组没有显著差异,但仅能发育至八腕幼虫阶段且全部畸形,其死亡高峰出现在受精后第16天。E6组发育速度较慢,仅发育至四腕幼虫阶段,未发现六腕幼虫个体,且E6组在受精后第10天时出现大量死亡现象。
2.2 各组海胆的生长差异
将海胆骨针长度分解为口后腕骨针长度和躯干部骨针长度两部分,口后腕骨针长度和躯干部骨针长度的比较见图2。对于口后腕骨针长度来说,受精后第4~10天时,E3组海胆幼虫与对照组无显著性差异 (P>0.05),而E6组明显低于E3组和对照组 (P<0.05);受精后第10天时,E6组海胆幼虫的口后腕骨针长度的标准差最大,达到平均值的48.16%,显微镜下观察发现,这时开始有部分个体出现腕骨针折断、腕严重萎缩畸形的症状;受精后第12天时,3组海胆幼虫的口后腕骨针长度依次为对照组>E3组>E6组 (P<0.05),此时E6组几乎所有个体腕变得非常短,而E3组幼虫的口后腕骨针长度的标准差达到最大,为平均值的25.77%;从第14天开始,E6组无法继续测量而终止试验,而E3组海胆幼虫的口后腕骨针长度在受精后第16~18天时显著低于对照组 (P<0.05),之后海胆幼虫全部畸形死亡 (图2)。
在试验期间内,各组海胆幼虫躯干部骨针长度的标准差均较小,各组个体维持稳定,其中E6组在整个试验阶段均明显低于对照组(P<0.05),而E3组仅在受精后第12天时显著低于对照组(P<0.05),其余时间均与对照组水平相当(P>0.05,图2)。各组海胆躯干部骨针长度的变化趋势与口后腕骨针长度变化趋势类似,只是标准差相应减小。
从各组海胆口后腕骨针长度与躯干部骨针长度的比值 (PO/BR)来看,其标准差均较大。E6组的PO/BR在整个试验阶段均明显低于对照组 (P<0.05),E3组的PO/BR在受精后第4天时显著低于对照组 (P<0.05),其余时间均与对照组无显著差异 (P>0.05),直至受精后第16~18天时又出现显著低于对照组的情形 (P<0.05),并逐渐死亡。E6和E3组的PO/BR标准差最大值分别出现在第10天和第12天,分别为平均值的43.20%和25.30%。
2.3 各酸化试验组海胆的畸形特征
显微镜下观察发现:对照组受精后第10天时,海胆幼虫为典型的四腕幼虫;受精后第16天时, 20%以上个体发育至六腕幼虫;第 18天时54.76%的个体发育至六腕幼虫;第20天时出现了少量八腕幼虫个体 (图3-A、B、C)。E3组海胆幼虫发育速度与对照组相当,第10天时出现腕萎缩畸形、骨针外漏的个体 (图3-D);受精后第16天和第20天时分别出现六腕幼虫和八腕幼虫,但与对照组相比个体较小,且腕明显畸形、偏短(图3-E、F)。E6组仅在受精后12天内存活,受精后第10天时绝大多数个体腕短小且较钝 (图3-G),或者严重畸形,表现在腕绝大部分脱落,仅留有躯干部 (图3-H、I)。
各试验组海胆畸形情况也有所差异,以受精后第6天为例,对照组骨针平滑、完整,而E3组在部分个体中出现腕骨针断裂 (图3-J),E6组个体不仅出现骨针断裂,同时还出现骨针弯曲变形的现象 (图3-K)。
3 讨论
pH和温度是影响海洋生物生长、存活和繁殖的关键因素,针对这两个因子对海洋生物精子活力、存活、幼虫生长和钙化的影响,国内外学者曾做了大量的研究工作。发现用矿物酸调节导致的海水pH值下降会使岩牡蛎Saccostrea glomerata贝壳变薄,死亡率升高[17],导致海胆Salmonella typhimurium胚胎畸形率升高[18],影响金黄水母Chrysaora melanoter幼体的生长与存活[19]。自2003年海洋酸化一词出现在 《Nature》杂志以来[1],国外学者针对CO2增多而导致的海洋酸化可能对海洋无脊椎动物的影响研究迅速展开。通过注入CO2调节海水pH的海水环境模拟试验系统也相继建立[11,20],结果表明,同一设定pH下,注入CO2比用矿物酸调节海水对海洋生物的负面影响更大[21],因此认为,通过注入CO2可以建立和模拟海水酸化理想的海水环境。近几年,通过注入CO2而形成的酸化海水对无脊椎动物幼虫发育的影响在中国也有报道,主要涉及对马氏珠母贝Pinctadamartensii、栉孔扇贝Chlamys farreri等的研究[22-24]。另外,CO2也是典型的温室气体,它的增加不仅使海水不断酸化,同时也会和其他温室气体联合起来使地球变暖。尽管海水酸化可能与温度变化无关[25],但依据预测,海水酸度与温度都同样趋于上升的趋势。与成体比较起来,幼虫发育能够忍受的温度变化幅度较窄[26],且温度的变化可能通过影响幼虫分散的距离进而影响群体的分布和结构[27],也可能影响幼虫的生长发育速度和存活[28-29]。
本试验中根据未来对pH和温度的预测趋势,设置酸度和温度的联合变化试验,对模式动物——中间球海胆进行了幼虫发育和生长的研究。研究结果与前人报道的研究结果相似。如岩牡蛎在pH-0.3时存活率较对照组下降了43%,在pH-0.5时存活率下降了72%,同时幼虫的发育时间会随着pH的降低而延长,或者说同一发育阶段酸化条件下的幼虫个体较小,且壳的畸形状况增多[30];太平洋牡蛎Crossostrea gigas在酸化 (7.4)条件下幼虫发育延缓且壳的钙化程度降低,大多数个体没有壳或者仅有部分壳[31];海蛇尾在pH为7.9和7.7时幼虫存活率和个体大小均下降,且幼虫畸形率升高[11];海胆Hemicentrotus pulcherrimus、Echinometra mathaei的胚胎在6个不同浓度CO2的酸化海水中发育至长腕幼虫时,幼虫的体积、腕的尺寸随着CO2浓度的增加而减小,并且其形态、幼虫的骨针发育畸形[9,32];海胆Psammechinusmiliaris、Heliocidaris erythrogramma也出现类似的现象[33-34]。
但也有一些研究结果表明,海洋酸化对某些海洋生物的影响不大。如Moulin等[6]报道在潮间带生活的海胆Paracentrotus lividus仅在pH低于7.4时发育才会受到影响,这个pH较其他潮下带研究的结果要低,推测原因是该种海胆分布广、适应性强,潮间带经常变动的环境可能使海胆能够更好地适应未来的海水酸化条件。而且在这个pH下,亲本经受较大的pH下降后,其配子的受精率显著提高,推测配子可以对pH胁迫很好地调整和适应。另有报道,海胆S.droebachiensis在较低 pH 下(7.9和7.7)培育,其到达变态期的成功率甚至高于正常pH下 (8.0)的海胆,尽管可能使浮游期延长[35]。Clark等[36]观察到北冰洋海胆Sterechinus neumayeri幼虫受到低pH的影响较热带和温带地区的海胆要低。也有一些报道认为,海胆受精和胚胎发育没有受到酸化的影响[36-37]。这些结果表明,即使是分类地位相近的种类,其早期生活阶段对海水酸化的反应可能完全不同。这可能与生物的生活环境变异幅度、分布区域和种属特异性有关。
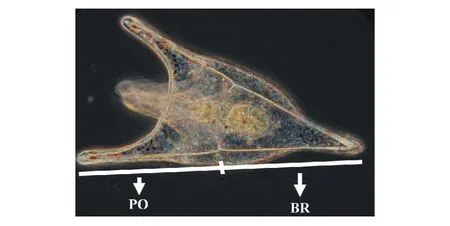
图1 海胆测量指标示意图Fig.1 Themorphometric indices of pluteus larvae

图2 受精后不同时间各组海胆口后腕骨针长度和躯干部骨针长度的变化情况Fig.2 Changes in length of postoral arms and skeletal rod in all groups various days after fertilization

图3 受精后不同时间各组海胆的形态以及受精后第6天时幼虫的畸形特征Fig.3 Themorphological characteristics of p luteus larvae in different groups various days after fertilization,and the deform ity characteristics of 6-day old pluteus larvae in all groups
多数研究仅关注了海洋酸化对生物生长发育的负面影响,而对全球变暖因素的影响考虑较少。仅有的研究结果表明,海胆Tripneustes gratilla在可承受的温度范围内,幼虫的生长与温度呈正相关,而与酸化程度呈负相关[27],表明pH降低会使幼虫变小,且温度在一定程度上能够抵消酸化的负面效应。本研究中也发现类似的现象,如中间球海胆在pH-0.3&T+3℃的联合作用下,海胆的生长、发育速度与对照组没有显著差别 (甚至个别个体快于对照组),也说明温度的适当升高可能会部分抵消酸化的负面效应,尽管这个过程仅持续到受精后第18天,之后幼虫因大部分腕折断、畸形而死亡。另外,本研究中还发现,酸化环境下的海胆个体极易出现畸形的部位是腕部,出现骨针折断、萎缩变短的情况,随着酸化程度的上升,腕部畸形情况严重,且个体较小。海胆的腕对于其摄食、游泳和逃避敌害至关重要,而且也有研究表明,其摄食的成功率与腕的长度紧密相关[38]。幼虫较小会导致浮游阶段延长,使其被捕食的危险增加,从而使生存率和种群繁衍能力下降。
总之,中间球海胆对海水酸化和升温的环境条件非常敏感,未来的海水环境将对海胆发育造成致命的威胁,好在海水环境的自然变化是一个较缓慢的过程,采用科学的方法提高海胆自身适应环境的能力并使其健康地生存,将是今后研究的热点。
[1] Caldeira K,Wickett M E.Anthropogenic carbon and ocean pH [J].Nature,2003,425:365.
[2] Haugan PM,Drange H.Effects of CO2on the ocean environment [J].Energy Convers Manage,1996,37:1019-1022.
[3] Caldeira K,Wickett M E.Ocean model predictions of chemistry changes from carbon dioxide emissions to the atmosphere and ocean[J].JGeophys Res,2005,110:12.
[4] Orr JC,Fabry V J,Aumont O,et al.Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms[J].Nature,2005,437:681-686.
[5] Fabry V J,Seibel B A,Feely R A,et al.Impacts of ocean acidification onmarine fauna and ecosystem processes[J].ICESJournal of Marine Science,2008,65:414-432.
[6] Moulin L,Catarino A I,Claessens T,et al.Effects of sea water acidification on early developmentof the intertidal sea urchinParacentrotus lividus(Lamarck 1816)[J].Marine Pollution Bulletin, 2011,62:48-54.
[7] Solomon S,Qin D,Manning M,et al.Contribution ofworking group I to the fourth assessment reportof the intergovernmental panel on climate change[EB/OL]//Cambridge University Press,2007.http://www.ipcc.ch/publications_and_data/ar4/wg1/en/ch10s 10-es-1-mean-temperature.html.
[8] Melzner F,Gutowska M A,Langenbuc M,et al.Physiological basis for high CO2tolerance inmarine ectothermic animals:pre-adaptation through lifestyle and ontogeny[J].Biogeosciences,2009,6: 2313-2331.
[9] Kurihara H,Shirayama Y.Effects of increased atmospheric CO2on sea urchin early development[J].Mar Ecol Prog Ser,2004,274: 161-169.
[10] Mayor D J,Matthews C,Kathryn C,et al.CO2-induced acidification affects hatching success inCalanus finmarchicus[J].Marine Ecology Progress Series,2007,350:91-97.
[11] Dupont S,Havenhand J,ThorndykeW,etal.Near-future level of CO2-driven ocean acidification radically affects larval survival and development in the brittlestarOphiothrix fragilis[J].Marine Ecology Progress Series,2008,373:285-294.
[12] Kurihara H.Effect of CO2-driven ocean acidification on the early developmental stages of invertebrates[J].Marine Ecology Progress Series,2008,373:275-284.
[13] 李霞,秦艳杰,辛丽.饥饿和再投喂对中间球海胆性腺发育的影响[J].大连水产学院学报,2007,22(1):6-10.
[14] 李霞,王秋实,李鸥.镉对中间球海胆精子发生的影响[J].大连水产学院学报,2007,22(5):319-324.
[15] 李娇,王姮,韩昭衡,等.8种农药对海胆胚胎各发育期的急性毒性[J].生态毒理学报,2010,5(2):255-261.
[16] Brennand H S,Soars N,Dworjanyn S A,et al.Impact of ocean warming and ocean acidification on larval development and calcification in the sea urchinTripneustes gratilla[J/OL].PLoSOne, 2010,5(6):e11372.
[17] Dove M C,Sammut J.Histological and feeding response of Sydney rock oysters,Saccostrea glomerata,to acid sulfate soil outflows [J].JShellfish Res,2007,26:509-518.
[18] Cipollaro M,Corsale G,Esposito A,et al.Sublethal pH decrease may cause genetic damage to eukaryotic cell:a study on sea urchins andSalmonella typhimurium[J].Teratog Carcinog Mutagen,1986,6:275-287.
[19] 杨为东,郭玲玲,赵文,等.pH、盐度和不同饵料对咖啡金黄水母幼体生长与存活的影响[J].大连海洋大学学报,2011,26 (3):223-226.
[20] Gazeau F,Quiblier C,Jansen JM,et al.Impact of elevated CO2on shellfish calcification[J/OL].Geophysical Research Letters, 2007,34,L07603.DOI:10.1029/2006GL028554.
[21] Kikkawa T,Kita J,Ishimatsu A.Comparison of the lethal effect of CO2and acidification on red sea bream(Pagrusmajor)during the early developmental stages[J].Mar Pollut Bull,2004,48: 108-110.
[22] 刘文广,林坚士.海洋酸化对马氏珠母贝受精及早期发育的影响[J].海洋科学,2012,36(4):19-23.
[23] 何盛毅,林传旭,何毛贤,等.海洋酸化对马氏珠母贝胚胎和早期幼虫发育的影响[J].生态学杂志,2011,30(4):747-751.
[24] 张明亮,邹建,方建光,等.海洋酸化对栉孔扇贝钙化、呼吸及能量代谢的影响[J].渔业科学进展,2011,32(4):48-54.
[25] Cao L,Caldeira K,Jain A K.Effectsof carbon dioxideand climate change on ocean acidification and carbonate mineral saturation[J].Geophysical Research Letters,2007,34(5).DOI:10.1029/ 2006GL028605.
[26] Foster B A.Desiccation as a factor in the intertidal zonation of barnacles[J].Mar Biol,1971,8:12-29.
[27] O'Connor M I,Bruno JF,Gaines SD,et al.Temperature control of larval dispersal and the implications formarine ecology,evolution and conservation[J].Proc Natl Acad Sci USA,2007,104: 1266-1271.
[28] 李岑,姜志强,刘庆坤,等.泰国斗鱼的胚胎发育及温度对胚胎发育的影响[J].大连海洋大学学报,2011,26(5):402-406.
[29] 王丹丽,徐善良,尤仲杰,等.温度和盐度对青蛤孵化及幼虫、稚贝存活与生长变态的影响[J].水生生物学报,2005,29 (5):495-501.
[30] Watson SA,Southgate PC,Tyler PA,etal.Early larval development of the Sydney rock oysterSaccostrea glomerataunder nearfuture predictions of CO2-driven ocean acidification[J].Journal of Shellfish Research,2009,28(3):431-437.
[31] Kurihara H,Kato S,Ishimatsu A.Effects of increased seawater pCO2on early development of the oysterCrassostrea gigas[J]. Aquat Biol,2007,1:91-98.
[32] Kurihara H,Shirayama Y.Effects of increased atmospheric CO2and decreased pH on sea urchin embryos and gametes[C]// Nebelsick JH,Heinzeller T.Echinoderm:Proceedingsof the11 th International Echinoderm Conference,Munich:Balkema Publishers,2003:1201.
[33] Miles H,Widdicombe S,Spicer J I,et al.Effects of anthropogenic seawater acidification on acid-base balance in the sea urchinPsammechinusmiliaris[J].Mar Pollut Bull,2007,54:89-96.
[34] Havenhand JN,Buttler F R,Thorndyke M C,et al.Near-future levels of ocean acidification reduce fertilization success in a sea urchin[J].Current Biology,2008,18(5):R651-R652.
[35] Dupont S,Thorndyke M C.Ocean acidification and its impact on the early life-history stages ofmarine animals[C]//Impacts of Acidification on Biological Chemical and Physical Systems in the Mediterranean and Black Seas.CIESM,Monaco,2008:89-97.
[36] Clark D,LamareM,BarkerM.Response ofseaurchin pluteus larvae(Echinodermata:Echinoidea)to reduced seawater pH:a comparison among a tropical,temperate,and a polar species[J]. Mar Biol,2009,156:1125-1137.
[37] Byrne M,Soars N A,Ho M A,et al.Fertilization in a suite of coastalmarine invertebrates from SE Australia is robust to nearfuture ocean warming and acidification[J].Mar Biol,2010,157: 2061-2069.
[38] Byrne M,Soars N,Selvakumaraswamy P,et al.Sea urchin fertilization in awarm,acidified and high pCO2ocean acrossa range of sperm densities[J].Mar Environ Res,2009,69:234-239.
Effects of ocean acidification and warming on growth and development in larval sea urchin Strongylocentrotus intermedius
QIN Yan-jie1,SONG Xiao-nan1,LI Xia1,ZHAO Xiang-ji1,2
(1.Key Laboratory of Mariculture & Stock Enhancement in North China's Sea,Ministry of Agriculture,Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province,Dalian Ocean University,Dalian 116023,China;2.Poyang Senior Middle School,Shangrao 333100,China)
Larval sea urchinStrongylocentrotus intermediuswere reared in conditions of changes in water temperature (T) and pH value (pH) (in control group,pH from 7.93 to 7.99,T=18℃;in E3 group,T=21℃ and pH value decreased by 0.3 from the level in the control group and in E6 group,T=24℃ and pH value decreased by 0.6 from the level in the control group for 20 d) to evaluate the effects of the joint effects ofwarming and increased acidification/p CO2on larval development and growth.Acidification and warming were not shown to affect on the hatching rates of fertilized eggs in sea urchin significantly,even though same development was found in both group E3 and control group,and lower developmentwas observed in group E6.Larval sea urchin was survival for 18 days in group E3 (as pluterus larvae with 8 arms) and for 12 days in group E6 (as pluterus larvaewith 4 arms),indicating effect of marine environment on survival of larval sea urchin.There were significantly shorter length of postoral arm,body rod and whole skeleton in E6 group than those in control during their living phases(P<0.05),though there was similar growth rate in sea urchin larvae in both group E3 and control group in the first10 days after fertilization(P>0.05),and then significant decrease in growth till death,indicating that elevated acidity/pCO2led to significant decrease in larval growth,especially in post oral arm.The dysmorphosis of pluterus larvae was characterized by short,atrophy,broked and/or bending arms in acidified conditions.The findings show thatS.intermediuslarvae will be negatively affected by exposure to the warming and acidified ocean.
Strongylocentrotus intermedius;ocean acidification;warming;larval development;growth
Q143
A
2095-1388(2013)05-0450-06
2013-04-15
辽宁省高等学校杰出青年学者成长计划项目 (LJQ2011077);国家海洋局近岸海域生态环境重点实验室资助项目 (201102)
秦艳杰 (1977-),女,副教授,博士。E-mail:qinyanjie@dlou.edu.cn

