大气CO2浓度升高对大型海藻孔石莼生长和色素含量的影响
付晚涛,刘佳,张菊林,冯天威,苏延明,朱翔铃,李月圆,刘靖,刘远,曹淑清,刘宏文
(1.大连海洋大学海洋科技与环境学院,辽宁大连116023;2.辽宁省高校近岸海洋环境科学与技术重点实验室,辽宁 大连116023; 3.大连海洋大学经济管理学院,辽宁大连116023;4.大连海洋大学 水产与生命学院,辽宁 大连116023;5.大连市环境监测中心,辽宁大连116023)
大气CO2浓度升高对大型海藻孔石莼生长和色素含量的影响
付晚涛1、2,刘佳3,张菊林1,冯天威1,苏延明4,朱翔铃1,李月圆1,刘靖1、2,刘远1、2,曹淑清4,刘宏文5
(1.大连海洋大学海洋科技与环境学院,辽宁大连116023;2.辽宁省高校近岸海洋环境科学与技术重点实验室,辽宁 大连116023; 3.大连海洋大学经济管理学院,辽宁大连116023;4.大连海洋大学 水产与生命学院,辽宁 大连116023;5.大连市环境监测中心,辽宁大连116023)
在实验室模拟研究了大气CO2浓度升高对海洋中大型绿藻孔石莼Ulva pertusa的生长和色素含量的影响。设置4个独立试验,每个试验的CO2浓度分别为387、500、600、800mg/L。每个试验设6个海水培养系统,其中3个通入一定浓度的CO2作为试验系统,另外3个通入大气作为对照系统。在每个海水培养系统中,分别装入25 L过滤海水 (滤膜孔径为0.22μm),放入 (50.0±1.0)g的孔石莼进行培养,试验进行7 d。结果表明:高浓度CO2对孔石莼生长无显著影响 (P>0.05),但降低了孔石莼中叶绿素a和类胡萝卜素的含量;试验结束时,CO2浓度为387、500、600、800 mg/L时,试验系统中孔石莼的叶绿素a含量分别为 (855.9±31.6)、(780.8±6.2)、(677.3±22.1)、(585.1±16.9)μg/g(鲜质量),分别为对照系统的98.3%、91.8%、78.4%和71.7%,试验系统中孔石莼的类胡萝卜素含量分别为 (185.6±5.0)、(167.8±2.4)、(150.6±2.3)、(128.3±4.3)μg/g(鲜质量),分别为对照系统的97.7%、91.5%、80.4%和69.4%;而对照系统中试验开始时和试验结束时,孔石莼的叶绿素a含量和类胡萝卜素含量均无显著性差异 (P>0.05)。
高浓度CO2;孔石莼;生长;色素含量
海洋平均每小时吸收约100万t CO2,其中约25%为人类活动释放于大气中的CO2[1]。自150年前人类进入工业化社会以来,大气中CO2浓度由280 mg/L左右升高至现在约387 mg/L,致使海洋中溶解CO2量不断增加,导致海水pH值降低,即海洋酸化,从而引起海洋生态系统发生不可逆变化[2-3]。2007年,联合国政府间气候变化委员会(IPCC)预测2100年大气CO2浓度可能达到800~1 000 mg/L[4],将导致海洋表层海水pH值比现在降低0.3~0.4[5-6],海洋酸化程度加剧。
大型海藻贡献约10%的海洋初级生产力[7],不仅具有固定大气中CO2的作用,而且对于维护海岸带基岩岸线生态健康具有重要作用。因此,研究大气CO2浓度升高对大型海藻的影响具有重要意义。自20世纪90年代,人们开始在实验室模拟高浓度CO2环境用于研究大气CO2浓度升高对大型海藻生长、生理生化指标等的影响[8-9],结果表明,大型海藻对大气CO2浓度升高的响应具有明显的种间异质性[10],如高浓度 CO2促进红藻条斑紫菜Porphyra yezoensis[8]和智利江篱Gracilaria chilensis[9]的生长,但是抑制红藻紫菜属的P.leucostica、P.linearis[11]和珊瑚藻Corallina sessilis[12]的生长; CO2浓度升高对产于欧洲的3种石莼Ulva pulchra、U.reticulata、U.rigida[13]和产于中国东海南澳岛潮间带的石莼U.lactuca[14]的生长则没有影响。另外,高浓度CO2能降低江蓠属大型海藻G.gaditana、G.tenuistipitata[15-16]和紫菜P.leucostica[11]的叶绿素a含量,导致珊瑚藻的叶绿素a含量下降和类胡萝卜素含量升高[12],并降低龙须菜G.lemaneiformis类胡萝卜素的含量[17]。大气CO2浓度升高对大型绿藻孔石莼Ulva pertusa的生长和色素含量的影响目前尚未见报道。
中国海岸线绵长,不同地理位置沿岸海域的大型海藻优势种和关键种差异较大。孔石莼属于绿藻门Chlorophyta、石莼纲 Ulvophyceae、石莼目 Ulvales、石莼科Ulvaceae、石莼属Ulva的一种大型海洋经济藻类,是中国野生经济藻类中资源极为丰富的一种,也是黄海、渤海基岩岸线海域的优势种[18-19]。本研究中,作者在实验室模拟研究大气CO2浓度升高对孔石莼生长和色素含量的影响,以期探索石莼属大型绿藻对大气CO2浓度升高响应的共性特征。
1 材料与方法
1.1 材料
孔石莼采集于大连市黑石礁潮间带海域,在0.5 h内运回实验室,选择新鲜藻体用沙滤海水洗去其表面的附着物,然后通气暂养于30 L水族缸中,1 d后用于试验。试验用水为沙滤海水。试验药品除标明外均为分析纯。
1.2 方法
1.2.1 实验室模拟生态系统
1)构建海水培养系统。在实验室构建模拟大气CO2浓度升高背景下的海水培养系统,其示意图见图1。海水培养箱用有机玻璃板黏合制作,容积30 L,每次装入25 L过滤海水 (KY-3B型空气压缩机与过滤器,滤膜孔径0.22μm,绍兴市卫星医疗设备制造有限公司产品)。气囊 (大连海德科技有限公司产品)250 L,可充满含有不同浓度的CO2气体。气囊有一个进气口和一个出气口,分别连接各自的气阀。出气口连接硅胶管,硅胶管连接有机玻璃管,有机玻璃管直接通至封闭的海水培养箱接近底部的位置,有机玻璃管与海水培养箱接触处用硅胶密封。通过蠕动泵 (BT100-2JYZ1515x,保定兰格恒流泵有限公司产品)作用于硅胶管使气囊中气体泵入海水培养箱的海水中;海水培养箱的出气口通过有机玻璃管与气囊的进气口连接。
2)不同浓度CO2的制备。设置4个CO2浓度:387(目前大气 CO2含量)、500、600、800 mg/L。高于目前大气CO2含量的气体制备方法如下:在250 L气囊内,先通入一定体积的过滤空气,再泵入一定体积的纯CO2,混合约0.5 h后用CO2红外检测仪 (GT901-CO2,深圳科尔诺电子有限公司产品)测定气囊中混合气体的CO2浓度,若在设定浓度±25 mg/L范围内,则密封气囊;否则,泵入过滤空气或纯CO2,至气囊中混合气体的CO2浓度在设定浓度±25 mg/L范围内。待12 h后,气囊中气体充分混合,再次检测气囊中CO2的浓度,在设定浓度±25 mg/L范围内则可以使用,否则泵入空气或纯CO2以使气囊中CO2浓度为设定浓度±25 mg/L。
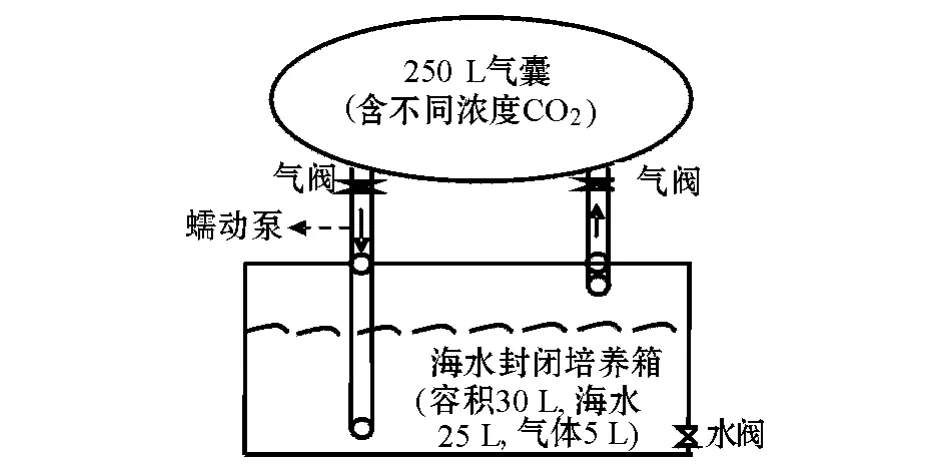
图1 CO2驱动海水酸化的实验室模拟生态系统Fig.1 Simulative ocean acidification ecosystem s in a laboratory driven by CO2
1.2.2 CO2对孔石莼生长与色素含量的影响试验
1)不同浓度的CO2对孔石莼生长的影响。设置4个独立试验,每个试验的 CO2浓度分别为387、500、600、800 mg/L。每个试验设6个海水培养系统,其中3个通入一定浓度的CO2作为试验系统,另外3个通入大气作为对照系统。试验系统的海水培养箱中,先分别装入25 L过滤的沙滤海水,再分别放入 (50.0±1.0)g在实验室暂养1 d的孔石莼,用硅胶封闭海水培养箱的箱体与上盖。将含有一定浓度CO2混合气体的气囊与海水培养箱连通,通过蠕动泵把气囊中的气体泵入系统的海水中,然后经培养箱出口回到气囊。气囊中CO2浓度分别为(387±25)、(500±25)、(600±25)、(800±25)mg/L。对照系统不使用气囊,蠕动泵将大气中的气体泵入生态系统中,正常大气CO2浓度为387 mg/L左右,其他与试验系统相同。试验期间,温度控制在19~22℃,每24 h更换含有一定浓度CO2气体的气囊 (气囊中CO2含量为设定浓度±25 mg/L),同时每24 h更换培养箱中全部海水,在更换海水前,检测海水的温度、pH。试验初始和试验结束时,分别测量孔石莼的鲜质量,并测定其色素含量。
2)孔石莼生长指标的计算。按下式计算孔石莼的相对生长率 (RGR,%):
RGR=[(Wt-W0)/W0]×100%,
其中:W0和Wt分别为第0天和第t天时孔石莼的鲜质量 (g);t为试验时间 (d)。
3)孔石莼色素含量的测定[20]。每次测定时,取0.1 g藻体 (鲜质量),研磨后置于装有10 mL甲醇的15 mL离心管中,在4℃黑暗条件下提取24 h。离心提取液 (5 000g,eppendorf,Germany) 10 min后,取上清液,用分光光度计 (UV 530, Beckman counlter,USA)测定其吸光值。
叶绿素a、叶绿素b和类胡萝卜素的含量Ca、Cb、Cc(μg/mL)按下式计算:
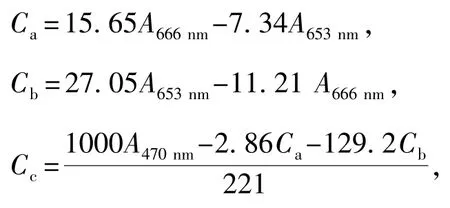
式中:A代表对应波长下的吸光值。
4)模拟生态系统中海水pH的测定。每天相同时间通过海水培养箱的阀门取海水 (图1),用pH计 (赛多利斯PB-10酸度计)测定海水pH,重复取水3次,取其平均值。
1.3 数据处理
试验数据采用SPSS 11.0进行统计分析。每次重复取样3次,采用t检验法进行组间显著性比较。
2 结果
2.1 海水的温度和pH的变化
试验期间,各培养箱中海水温度保持在19~23℃,其中对照系统CO2浓度为大气CO2浓度,海水pH值为8.23~8.32;试验系统CO2浓度分别为387、500、600、800 mg/L时,对应海水pH值分别为 8.23~8.33、8.01~8.09、7.84~7.92、7.70~7.77。
2.2 不同CO2浓度下孔石莼的生长情况
不同浓度CO2对孔石莼生长影响的试验结果见图2。在 CO2浓度分别为 387、500、600、800 mg/L环境下的4个独立试验中,对照系统和试验系统中的孔石莼在7 d分别生长了(19.6±1.1)、(20.5±1.0)g(图2-a),(20.6±1.2)、 (19.7± 1.6)g(图2-b), (24.1±3.8)、 (25.0±1.1)g (图2-c),(21.8±0.9)、 (23.2±1.1)g(图2-d);在各CO2浓度下,试验系统与对照系统中孔石莼的相对生长率无明显差异 (图3,P>0.05)。在CO2浓度为600、800mg/L的环境下,孔石莼的相对生长速率略高,这可能与每次试验所用孔石莼的健康状况相关。
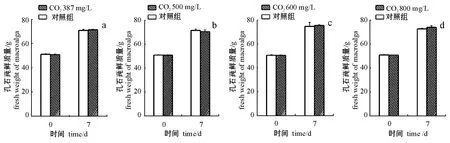
图2 不同浓度CO2对大型海藻孔石莼生长的影响Fig.2 Effects of CO2concentrations on grow th in macroalga Ulva pertusa
2.3 不同CO2浓度下孔石莼的色素含量
不同浓度CO2对孔石莼色素含量的影响结果见图4和图5。试验结束时,试验系统中孔石莼的叶绿素a和类胡萝卜素含量均随CO2浓度增加而逐渐降低,CO2浓度分别为387、500、600、800 mg/L时,试验系统孔石莼叶绿素a含量分别为(855.9± 31.6)、(780.8±6.2)、(677.3±22.1)、(585.1± 16.9)μg/g(鲜质量),分别为对照系统的98.3%、91.8%、78.4%和71.7%,试验系统孔石莼的类胡萝卜素含量分别为 (185.6±5.0)、(167.8± 2.4)、(150.6±2.3)和(128.3±4.3)μg/g(鲜质量),分别为对照系统的97.7%、91.5%、80.4%和69.4%。可见,孔石莼的叶绿素a与类胡萝卜素含量均随CO2浓度的增加而逐渐下降。而对照系统在试验开始和试验结束时,孔石莼的叶绿素a和类胡萝卜素含量均无显著性差异 (P>0.05)。

图3 不同CO2浓度对孔石莼相对生长速率的影响Fig.3 Im pacts of different CO2concentrations on relative grow th rate in macroalga Ulva pertusa at different CO2concentrations
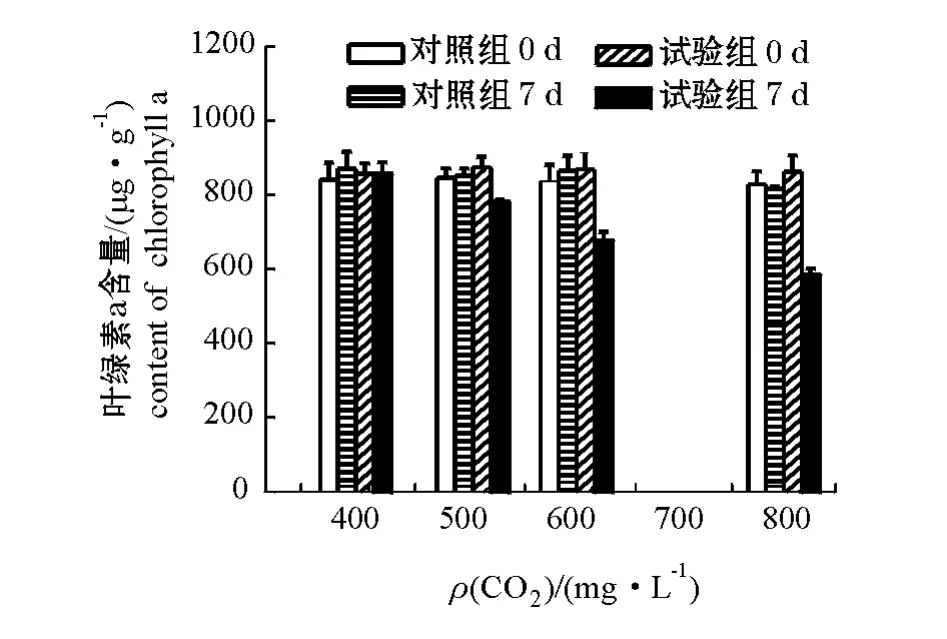
图4 不同浓度CO2对孔石莼叶绿素a含量的影响Fig.4 Im pacts of different CO2concentrations on chlorophyll a contents in macroalga Ulva pertusa
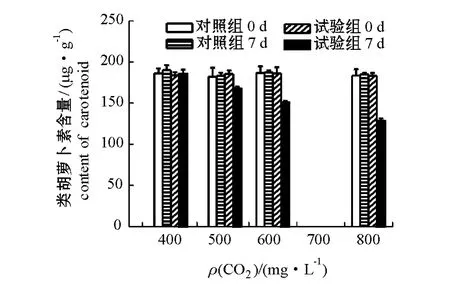
图5 不同浓度CO2对孔石莼类胡萝卜素含量的影响Fig.5 Impacts of different CO2concentrations on carotenoid contents in macroalga Ulva pertusa
3 讨论
3.1 不同浓度CO2对孔石莼生长的影响机制
本试验结果表明,高浓度CO2对孔石莼的生长没有显著影响 (P<0.05)。CO2浓度为387、500、600、800 mg/L时,孔石莼的相对生长率为(5.5± 0.3)%~(7.0±0.3)%,尽管该值比产于中国东海南澳岛潮间带石莼U.lactuca的相对生长速率(13.2 ±2.2)% ~(16.0±5.4)%低[14],但与其得出的高浓度CO2对石莼生长没有显著影响的结论一致, Björk等[13]对产于欧洲的 3种石莼U.pulchra、U.reticulate、U.rigida的研究也得到了类似的结果。
大气中CO2溶解于海水中,存在如下3个化学平衡式:
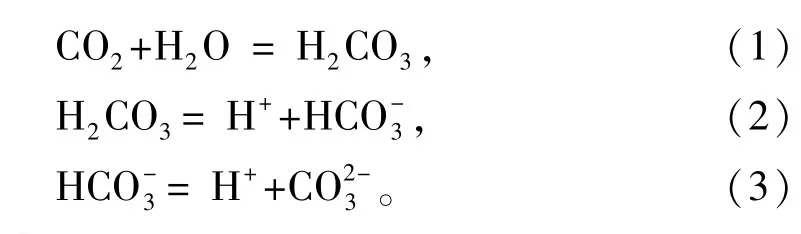
随着大气中CO2浓度的升高,溶解于海水中的CO2总量增加,导致海水中H+浓度增加 (即海洋酸化),式 (1)反应向右移动,式 (3)反应向左移动,即海水中HCO-3浓度和H+浓度增加。石莼属中的硬石莼具有高效利用海水中 HCO-3的能力[13,21],大气中CO2浓度升高导致海水的HCO-3浓度增加并没有影响其利用HCO-3的效率,即没有影响其生长[13],这种现象同样发生在石莼属中的孔石莼上。大型海藻具有CO2浓缩机制 (CCMs),在海藻叶绿体中的磷酸核酮糖羧化酶周围形成较高浓度的CO2,使海藻能有效地利用无机碳[22]。在高浓度CO2环境下,海藻将下调CCMs的作用,以节省细胞运作CCMs的能量[23]。在现有状态下,大气中CO2浓度与海水中无机碳含量相对应,硬石莼的光合作用能力已经达到饱和,大气中CO2浓度的升高不能改变硬石莼已经处于饱和状态的光合作用能力[13,21],因此,大气中CO2浓度的升高就不会显著影响包括硬石莼在内的石莼属海藻U.pulchra[13〛、U.reticulata[13]、U.lactuca[14]和孔石莼的生长。大气中CO2浓度升高对石莼属其他绿藻的生长是否都没有显著影响,需要进行更多的试验研究,进而阐明机制。
3.2 不同浓度CO2对孔石莼色素含量的影响机制
海藻中色素含量的变化反映海藻具有调节自身生理、生化反应以适应环境变化的能力[20]。本研究结果表明,CO2浓度从387 mg/L升高至500、600、800 mg/L时,孔石莼叶绿素a含量逐渐降低,试验结束时孔石莼叶绿素a含量分别为试验初始时的99.9%(387 mg/L)、89.3%(500 mg/L)、78.0%(600 mg/L)和67.8%(800 mg/L) (图4),这与高浓度CO2降低了江篱属G.gaditana和G.tenuistipitata[15-16]、 珊瑚藻[12]和龙须菜[17]等大型海藻的叶绿素a含量的试验结果一致,其影响机制可能是海藻细胞通过减少合成叶绿素a以降低光系统I(PSI)的吸收面积,并降低PSI和光系统Ⅱ(PSⅡ)的活性比,进而减少细胞中高能化合物腺嘌呤核苷三磷酸 (ATP)的生产,以节省能耗[23]。此外,随着大气中CO2浓度的升高,海水中无机碳浓度增加,即可供海藻利用的无机碳含量增加,但硬石莼的光合作用能力已经达到饱和[13,21],在适当降低光合作用也不影响其生长的状况下,硬石莼会调节自身生化反应,适当减少叶绿素a合成,降低其能量消耗。
随着大气中CO2浓度的增加,孔石莼类胡萝卜素含量也逐渐降低,孔石莼类胡萝卜素含量在试验结束时分别为试验初始时的101.1%(CO2浓度为387 mg/L)、90.5% (CO2浓度为 500 mg/L)、80.9%(CO2浓度为600 mg/L)和70.0%(CO2浓度为800 mg/L)(图5),这与徐智广等[17]得出的高浓度CO2降低了龙须菜类胡萝卜素含量的结论相似,但与高浓度CO2增加珊瑚藻类胡萝卜素含量的结论相反[12]。海藻细胞中类胡萝卜素具有抗氧化保护细胞作用[20]。本研究结果表明,CO2浓度升高没有影响孔石莼的生长,因此,孔石莼不需要增加合成类胡萝卜素保护自身细胞。相反,CO2浓度升高导致海水中无机碳含量增加,可能有利于孔石莼的生长,因此,孔石莼可能调节自身生化反应,减少类胡萝卜素的合成,降低能量消耗,这与其减少叶绿素a合成的结果相互印证。高浓度CO2对大型海藻中类胡萝卜素含量影响的关键因素在于高浓度CO2是否损伤海藻细胞,若海藻细胞受到伤害,则海藻中类胡萝卜素含量增加[12],以保护海藻细胞;若海藻细胞没有受到伤害,则海藻中类胡萝卜素含量减少[17],以降低细胞能量消耗。这也是大型海藻对高浓度CO2的响应表现为种间异质性的原因。
从已有研究[13-14]和本研究结果可知,CO2浓度升高没有显著影响石莼属大型绿藻的生长,反而促进其调节自身生理、生化反应以降低自身能量消耗,即减少体内叶绿素a含量和类胡萝卜素含量,这是否是石莼属大型海藻对高浓度CO2响应的共性特征,尤其是海藻细胞PSI与PSⅡ的活性关系和大气CO2浓度升高导致海水酸化对海藻正负两方面影响的机制[23],还需要通过对更多种类的石莼属海藻进行试验研究来揭示。另外,大型绿藻种类丰富,广泛分布于中国沿海近岸海域,而且不同地域大型绿藻的优势种或关键种种属差异很大,因此,尽可能多地选择不同种属的大型绿藻优势种,研究高浓度CO2对其的影响,对于丰富研究者认知高浓度CO2对不同地域海岸带生态系统的影响及其可能产生的生态演替结果具有重要意义。
[1] Sabine C L,Feely R A,Gruber N,et al.The oceanic sink for anthropogenic CO2[J].Science,2004,305:367-371.
[2] Hoegh-Guldberg O,Bruno JF.The impact of climate change on the world's marine ecosystems[J].Science,2010,328:1523-1528.
[3] Harley C D G,Randall Hughes A,Hultgren K M,et al.The impacts of climate change in coastalmarine systems[J].Ecology Letters,2006,9(2):228-241.
[4] IPCC.Climate Change2007:The Physical Science Basis.Contribution of working group I to the fourth assessment reportof the intergovernmental panel on climate change[R].Cambridge:Cambridge Univ.Press,2007.
[5] Caldeira K,WickettM E.Oceanography:anthropogenic carbon and ocean pH[J].Nature,2003,425:365.
[6] Feely R A,Sabine C L,Lee K,et al.Impact of anthropogenic CO2on the CaCO3system in the oceans[J].Science,2004,305:362-366.
[7] Smith JV.Marine macrophytes as a global carbon sink[J].Science,1981,211:838-840.
[8] Gao K,Aruga Y,Asada K,et al.Enhanced growth of the red algaPorphyra yezoensisUeda in high CO2concentrations[J].Journal of Applied Phycology,1991,3:355-362.
[9] Gao K,Aruga Y,Asada K,et al.Influence of enhanced CO2on growth and photosynthesis of the red algaeGracilariasp.andG. chilensis[J].Journal of Applied Phycology,1993,5:563-571.
[10] Hendriks I E,Duarte C M,Alvarez M.Vulnerability of marine biodiversity to ocean acidification:a meta-analysis[J].Estuarine,Coastal and Shelf Science,2010,86:157-164.
[11] Mercado JM,Javier F,Gordillo L,et al.Effects of different levels of CO2on photosynthesisand cell components of the red algaPorphyra leucosticte[J].Journal of Applied Phycology,1999,11: 455-461.
[12] Gao K,Zheng Y.Combined effectsof ocean acidification and solar UV radiation on photosynthesis,growth,pigmentation and calcification of the coralline algaCorallina sessilis(Rhodophyta)[J]. Global Change Biology,2010,16(8):2388-2398.
[13] Björk M,Haglund K,Ramazanov Z,et al.Inducible mechanismsfor HCO-3utilization and repression of photorespiration in protoplasts and thalliof three species ofUlva(Chlorophyta)[J].Journal of Phycology,1993,29:166-173.
[14] 邹定辉,高坤山.高CO2浓度对石莼光合作用及营养盐吸收的影响[J].青岛海洋大学学报,2001,31(6):877-882.
[15] Andría JR,Vergara J J,Pérez-Lloréns JL.Biochemical responses and photosynthetic performance ofGracilariasp.(Rhodophyta)from Cádiz,Spain,cultured under different inorganic carbon and nitrogen levels[J].European Journal of Phycology,1999, 34:497-504.
[16] García-Sánchez M J,Fernández JA,Niell X.Effect of inorganic carbon supply on the photosynthetic physiology ofGracilaria tenuistipitata[J].Planta,1994,194:55-61.
[17] 徐智广,邹定辉,张鑫,等.CO2和硝氮加富对龙须菜(Gracilaria lemaneiformis)生长、生化组分和营养盐吸收的影响[J].生态学报,2008,28(8):3752-3759.
[18] 王珊,刘瑀,张松.石油烃对孔石莼生长及光合作用的影响[J].大连海洋大学学报,2010,26(5):432-436.
[19] 蔡恒江,唐学玺.孔石莼和赤潮异弯藻相互作用的初步研究[J].大连海洋大学学报,2012,27(3):255-259.
[20] 郑仰桥.CO2浓度和阳光紫外辐射变化对珊瑚藻生理生化的影响[D].汕头:汕头大学,2009.
[21] Mercado JM,Gordillo F JL,Figueroa F L,etal.External carbonic anhydrase and affinity for inorganic carbon in intertidal macroalgae[J].Journal of ExperimentalMarine Biology and Ecology, 1998,221:209-220.
[22] Cook CM,Colman B.Some characteristics of photosynthetic inorganic carbon uptake of amarinemacrophytic red alga[J].Plant, Cell and Environment,1987,10:275-278.
[23] Wu H Y,Zou D H,Gao K S.Impacts of increased atmospheric CO2concentration on photosynthesis and growth of micro-and macro-algae[J].Science in China:Series C,Life Sciences, 2008,51:1144-1150.
Effects of elevated atmospheric CO2 concentration on growth and pigment contents ofmacroalga Ulva pertusa
FU Wan-tao1,2,LIU Jia3,ZHANG Ju-lin1,FENG Tian-wei1,SU Yan-ming4,ZHU Xiang-ling1, LI Yue-yuan1,LIU Jing1,2,LIU Yuan1,2,CAO Shu-qing4,LIU Hong-wen5
(1.College of Marine Science-Technology and Environment,Dalian Ocean University,Dalian 116023,China;2.Key Laboratory of Nearshore Marine Environmental Science and Technology of Liaoning Province's University,Dalian 116023,China;3.College of Economics & Management,Dalian Ocean University,Dalian 116023,China;4.College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China;5.Center of Environment Monitoring of Dalian,Dalian 116023,China)
Effects of rising atmospheric CO2 levels on growth and pigment contents was studied in macroalga Ulva pertusa in a laboratory.The macroalga was cultivated at a biomass of(50.0±0.1)g per tank in six 25 L sands-filtered(0.22μm)seawater culture systems(SCS)subjected to aeration with CO2ata rate of387,500,600 and 800 mg/L(as test system)and subjected to aeration with air(as control system)for 7 days.The results showed that there were no significant effects of rising atmospheric CO2levels on growth of themacroalga(P>0.05).However, the chlorophyll a(Chl.a)and carotenoid levels were found to be decreased,with Chl.a content of(855.9± 31.6),(780.8±6.2),(677.3±22.1),and(585.1±16.9)μg/g(fresh weight)at atmospheric CO2concentration of387,500,600 and 800mg/L at the end of the experiment,respectively,and representing 98.3%,91.8%, 78.4%and 71.7% in the control group,respectively.The average contents of carotenoid were found(185.6± 5.0)μg/g(fresh weight)at the atmospheric CO2concentration of387 mg/L,(167.8±2.4)μg/g(fresh weight)at the atmospheric CO2concentration of 500 mg/L,(150.6±2.3)μg/g(fresh weight)at the atmospheric CO2concentration of 600 mg/L,and(128.3±4.3)μg/g(fresh weight)at the atmospheric CO2concentration of 800 mg/L,accounting for 97.7%,91.5%,80.4%and 69.4%in the control groups,respectively.Nevertheless, there were no significant differences in contents of carotenoid and Chl.a in both the control system and the test system at the beginning and the end of the experiment(P>0.05).
rising atmospheric CO2level;Ulva pertusa;growth;pigment content
P714
A
2095-1388(2013)05-0481-06
2012-01-13
辽宁省博士科研启动基金资助项目 (20091019);辽宁省海洋与渔业厅科技计划项目 (200917,201215);辽宁省教育厅实验室专项 (LS2010024);农业部海洋与河口渔业资源及生态重点开放实验室开放课题 (开-09-13);大连海洋大学2012年校列科研项目 (2012HYDX09);农业部 “948”项目 (2010-G5,2011-G29);国家海洋公益性行业科研专项 (200805030, 200805069)
付晚涛 (1969-),男,博士,教授。E-mail:fuwantao@dlou.edu.cn

