核因子-κB在急性百草枯中毒大鼠肾脏中的表达及其意义
陕西省人民医院西院二病区(西安710068) 时 晔 樊英华 尚 亮 刘延梅 苗 青 高 路
百草枯(Paraquat,PQ)是一种常用的广谱除草剂,在世界范围内广泛使用[1],对人和动物有较强的毒性,其发病机制未完全阐明,也无特效解毒药物,临床治疗效果差,病死率高达60%~80%,严重危害着人们的生命健康[2]。
近年研究发现PQ进入机体后,不仅通过自由基的脂质过氧化机制引起组织损伤,还引起炎症介质和炎性因子的释放,进-步加重组织损伤。核因子-κB(Nuclear factor kappa B,NF-κB)是调节多种细胞因子和炎性介质表达最关键的转录因子,可介导肿瘤坏死因子-α(TNF-α)等炎性因子生成。有研究发现 NF-κB在全身炎症反应综合征(SIRS)、急性呼吸窘迫综合征(ARDS)及多脏器功能衰竭等疾病病理生理方面的重要作用,适当抑制NF-κB的活化,能够下调炎性介质的产生,改善上述疾病过程中引起的机体损伤和器官功能衰竭[3]。NF-κB是否调控炎性因子参与急性PQ中毒肾组织损害,国内目前少见报道。
材料与方法
1 动物分组及模型制备 选择6周龄健康清洁SD大鼠60只,雄雌各半,体重150~200g(172±15g),购于第四军医大学实验动物中心。随机分三组,每组20只。
对照组(A组):1ml生理盐水腹腔内注射;低剂量染毒组(B组):按15mg/kg将PQ稀释后腹腔内注射;高剂量染毒组(C组):按30mg/kg将PQ稀释后腹腔内注射。染毒后12h、24h、72h、120h,各组随机取5只大鼠处死,右肾制备10%的组织匀浆,左肾10%中性甲醛固定行病理观察及免疫组化染色。
2 主要试剂 20%PQ溶液(英国先正达公司),TNF-α检测试剂盒(深圳晶美生物工程公司),EnVision免疫组化检测试剂盒(基因科技上海公司),兔抗鼠NF-κB P50多克隆抗体(美国Santacruz公司 货号sc-114)。
3 TNF-α测定及HE染色 双抗体夹心酶联吸附法测定匀浆中的TNF-α浓度,HE染色病理观察(切片厚5μm)。
4 肾组织NF-κB的免疫组化分析 肾组织切片烤片脱蜡后,浸入柠檬酸缓冲液高压抗原修复(121℃5min),自然冷却至室温。滴加稀释的一抗(Antibody Diluent稀释),4℃过夜。滴加生物素标记二抗(Chem Mate En TMVision+/HRP)工作液,室温30min,以PBS代一抗作阴性对照,DAB显色,肉眼看到棕色立即终止染色,透明及封片,电镜下观察阳性细胞。每只大鼠制片5张,光镜下随机选取4个完整且不重叠高倍视野(×400),以胞浆或胞核出现棕黄色着色颗粒为阳性标记。判断结果采用免疫组织化(Immunohistochemistry score,IHS)标准,分别按阳性细胞百分数及阳性细胞染色强度计分[4]:A为阳性细胞数比例分级0(0~1%)、1(1%~10%)、2(10%~50%)、3(50%~80%)、4(80%~100%),B为阳性细胞显色强度分级0(阴性)、1(浅黄色为弱阳性)、2(浅棕黄色为阳性)、3(棕黄色为强阳性);IHS=A×B。
结 果
1 大鼠染毒后表现:A组大鼠活动灵敏,尿量正常;B组大鼠8~20h出现食欲减退,呼吸急促等;C组大鼠1~3h出现倦怠、嗜睡、烦躁、走路不稳、头颤,食水量明显减少,呼吸急促,血尿、少尿或无尿,还有松毛、易捕捉等症状。
2 肾功能检测结果:PQ染毒后大鼠出现肾功能损害,且随染毒剂量和时间呈正相关,见表1。
3 肾组织匀浆TNF-α动态变化及其意义:大鼠肾组织TNF-α染毒后12h开始逐渐升高,至观察终点仍处于较高水平,C组明显高于B组,提示急性PQ中毒早期肾脏炎性损伤过程中,TNF-α可能起重要作用,见表2。
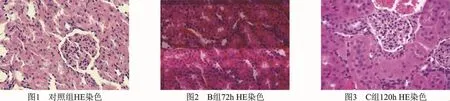
4 肾脏组织病理学观察:A组肾小球及肾小管结构清晰,无炎性细胞浸润,小管内无管型及颗粒(图1);B组肾小静脉及间质毛细血管淤血,小管上皮细胞肿胀及管腔变窄,72h可见水肿渗出、坏死,间质可见炎性细胞浸润(图2);C组早期可见小血管扩张淤血,小管上皮肿胀重,包膜张力增大及出血点、淤血,皮髓质界限模糊,可见大量炎性细胞浸润及部分细胞破坏,管腔内有蛋白管型 (图3)。
5 肾组织NF-κB的表达,见表3。
表1 三组不同时间点血清Cr、BUN水平(±s)
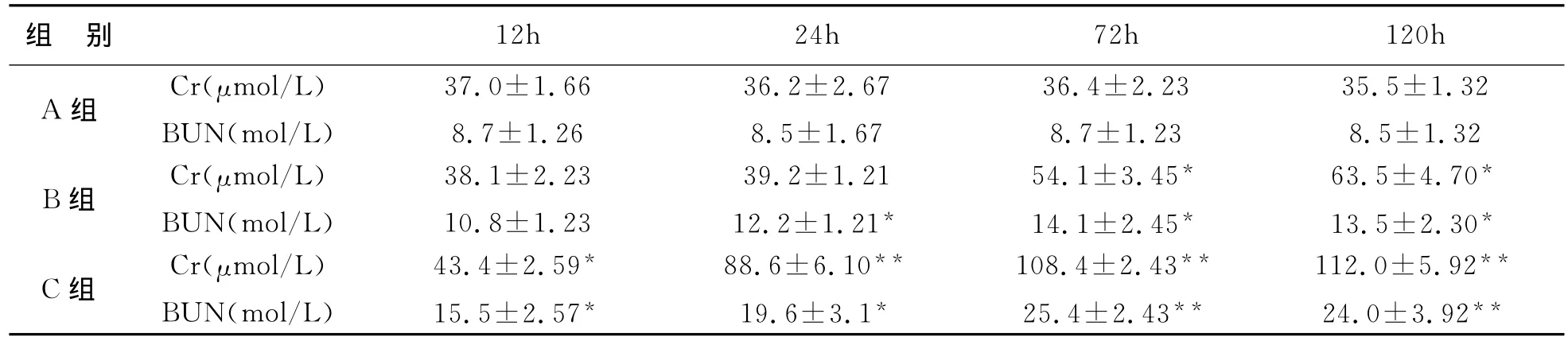
表1 三组不同时间点血清Cr、BUN水平(±s)
注:与A组比较,*P<0.05,**P<0.01
组 别 12h 24h 72h 120h A组 Cr(μmol/L)BUN(mol/L)37.0±1.66 8.7±1.26 36.2±2.67 8.5±1.67 36.4±2.23 8.7±1.23 35.5±1.32 8.5±1.32 B组 Cr(μmol/L)BUN(mol/L)63.5±4.70*13.5±2.30*C组 Cr(μmol/L)BUN(mol/L)38.1±2.23 10.8±1.23 39.2±1.21 12.2±1.21*54.1±3.45*14.1±2.45*43.4±2.59*15.5±2.57*88.6±6.10**19.6±3.1*108.4±2.43**25.4±2.43**112.0±5.92**24.0±3.92**
表2 三组不同时间点肾组织TNF-α水平(μg/L,±s)

表2 三组不同时间点肾组织TNF-α水平(μg/L,±s)
注:与 A组比较,*P<0.05,**P<0.01,***P<0.001;与B组比较,△P<0.05,△△P<0.01
组 别 12h 24h 72h 120h A组 7.34±0.25 6.85±0.64 7.33±0.52 7.40±0.45 B组 10.33±0.48 12.45±0.62* 28.46±1.53** 25.36±1.28**C组 12.40±3.62* 22.41±3.78**△ 39.65±4.02***△△ 36.65±3.27***△△
表3 三组不同时间点肾组织NF-κB的IHS评分(±s)
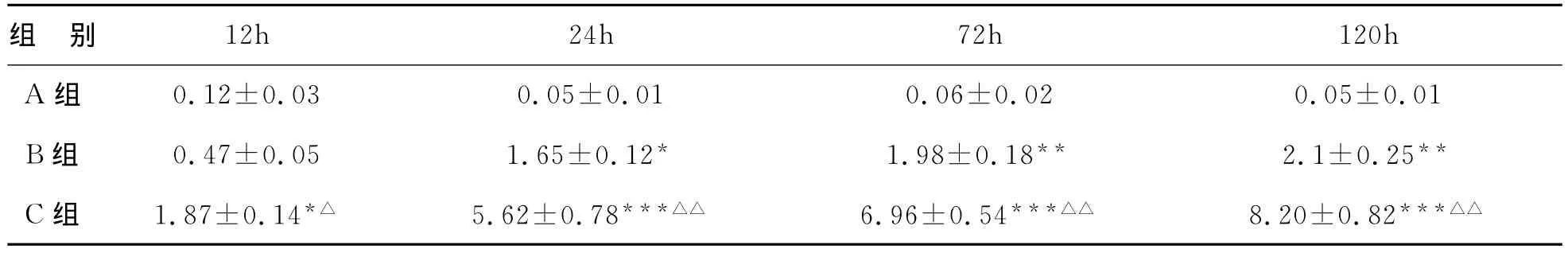
表3 三组不同时间点肾组织NF-κB的IHS评分(±s)
注:与 A组比较,*P<0.05,**P<0.01,***P<0.001;与B组比较,△P<0.05,△△P<0.01
组 别 12h 24h 72h 120h A组 0.12±0.03 0.05±0.01 0.06±0.02 0.05±0.01 B组 0.47±0.05 1.65±0.12* 1.98±0.18** 2.1±0.25**C组 1.87±0.14*△ 5.62±0.78***△△ 6.96±0.54***△△ 8.20±0.82***△△
A组NF-κB不表达或很少表达,仅见极少数肾小管细胞浆棕黄色淡染,各时间点间无差异(图4);B组NF-κB表达在12h与A组大鼠无明显差异,而在24h、72h、120h表达增多,并随时间延长呈线性升高趋势,至观察结束仍保持较高水平,有显著统计学差异(图5);C组NF-κB表达在12h即升高,以后各时间点随时间延长呈线性升高趋势,72h左右达到高峰且见核表达。C组NF-κB表达在12h较A组及B组均有显著性差异;在24h、72h、120h较A组有非常显著的统计学差异,较B组有显著的统计学差异(图6)。

结果提示:急性PQ中毒后肾组织NF-κB表达较早且非常强烈,尤其在C组,结合临床重度中毒者早期发生肾功能损害比例高,可能有较重要的意义。
讨 论
PQ造成机体损伤是多系统、多器官、多水平的,体内的PQ主要以原形从肾脏排出,24h内可排出50%~70%。一项关于PQ中毒荟萃分析[5],检索了1994年至2006年国内期刊数据库公开发表的论文及Medline相关报道1069例患者,肾损伤的发生率高达64.9%,其中死亡466例占到肾损伤的67.1%,可以看出肾损伤是影响预后的重要因素。目前认为氧化应激、炎性损伤、基因异常、细胞凋亡、钙超载等诸多因素参与肾损害的发生与发展。
NF-κB作为一种多效转录因子,在调节多种细胞因子和炎性介质表达中发挥着关键作用,逐渐证实它激活后在感染、中毒等疾病致多脏器功能损害中的重要角色。佟飞等[6]建立大鼠急性肺损伤模型后,采用电泳迁移率法检测大鼠肺组织NF-κB活性,发现染毒组NF-κB活性明显高于对照组和治疗组,提示急性肺损伤时NF-κB活性增强。TNF-α参与机体炎症反应和免疫过程,是介导机体炎症反应的关键因子,可以通过NF-κB诱导表达,也可以通过自分泌和旁分泌调节自身及其它因子的表达,对肾脏产生潜在的损害作用。NF-κB主要由P50和P65两个亚基组成,通常与抑制蛋白IκB形成三聚体,以失活状态存在于细胞质中。氧化应激时,机体活性氧大量增加引起IκB-NF-κB复合体降解,NF-κB活化,在基因水平启动包括TNF-α、IL-8等炎症因子和炎性介质的表达,参与炎症、组织器官纤维化、细胞再生和凋亡等病理生理过程。已有研究提示急性PQ中毒后NF-κB被激活上调TNF-α的转录,使TNF-α等炎性因子生成增多,研究同时发现TNF作为细胞因子家族中最强效的炎症介质,在结合TNF-R以后,可刺激 NF-κB与IKB解离。此时,TNF-α-NF-κB 形成了一个正反馈 信号,促使TNF-α大量表达,这种恶性循环在及 MODS的发生发展中有重要意义。
本研究成功建立PQ腹腔注射染毒大鼠动物模型,染毒后数小时出现不同程度的血尿、少尿或无尿及神经精神症状,血肌酐、尿素氮升高,HE染色见肾小球体积增大,近曲小管上皮细胞肿胀、变性、空泡样变、坏死,肾小管管腔变窄甚至闭锁,间质充血、水肿、炎性细胞浸润,提示PQ中毒早期可致肾损伤,尤其在重度中毒组。
实验发现肾组织TNF-α浓度在B组24h、C组12h时开始升高,以后的时间点呈逐渐增加趋势,尤其在NF-κB表达后显著升高,在时间上与肾组织病理损害程度相关,故认为TNF-α介导的炎症反应参与急性肾损伤的发生与发展过程。本研究显示PQ中毒后12h即出现肾脏组织NF-κB的表达升高,且持续较长时间,提示NF-κB可能参与了肾脏炎性损害及功能衰竭的发生。中毒后24h大鼠肾组织TNF-α水平开始升高,至72h达峰值,各时间点结果与对照组比较均有显著性差异,且肾组织TNF-α明显升高出现在NF-κB高表达之后,提示NF-κB被激活后上调TNF-α的转录,使TNF-α生成增多。NF-κB活化抑制炎症细胞凋亡,导致炎症细胞数量异常增加,炎症细胞过度激活后释出大量细胞因子和炎症介质,造成组织损伤。而组织损伤、大量的促炎细胞因子和炎症介质反过来又促进NF-κB的活化,形成复杂的网络,使机体出现器官损伤或功能障碍。通过以上实验推测,NF-κB参与的炎症反应,也是PQ中毒者多脏器功能障碍或死亡的-个重要因素。
已有研究表明,NF-κB在炎性介质的激活和SIRS的发生、发展中发挥了重要作用,本研究发现在PQ中毒后肾组织NF-κB高表达,提示NF-κB可能参与了PQ中毒早期肾脏损害,如果在疾病早期适度地抑制NF-κB的激活,进而下调炎性介质的产生,将会为治疗急性PQ中毒早期引起的肾脏损伤和器官衰竭提供-种新的治疗办法。
[1] 陈世铭,高连永.急性中毒的诊断与救治[M].北京:人民军医出版社,1996:179-182.
[2] Hwang KY,Lee EY,Hong SY,et al.Paraquat in toxieation in Korea[J].Archives of Environmental Health,2002,57(2):162-166.
[3] 耿东升.NF-κB及其致炎作用和化学抑制剂[J].解放军药学学报,2009,25(3):250-25.
[4] Soslow RA,Dannenberg AJ,Rush D,et al.Cox-2is expressed in human pulmonary,colonic,and mammary tumors[J].Cancer,2000,89(3):2637-2645.
[5] 刘芙蓉,石汉文,扈 琳,等.肾损伤对百草枯中毒患者预后影响的分析[J].临床荟萃,2008,23(2):119-121.
[6] 佟 飞,田英平,霍书花,等.P38MAPK及核因子-κB在百草枯致大鼠肺损伤中的变化[J].中华劳动卫生职业病杂志,2007,25(9):518-522.

