导尿管相关粪肠球菌生物被膜形成的分子机制探讨
薛 婷,吴利先
(云南大理学院基础医学院微生物学教研室,云南大理671000)
肠球菌是人类和动物肠道正常菌群的一部分,但近年研究已证实其为院内感染的重要致病菌[1]。20世纪80年代以来,肠球菌严重感染的发生率和病死率明显升高,已成为伤口和尿路感染最常见的致病菌,导致菌血症的第三大致病菌,其中粪肠球菌是与临床感染相关的最常见肠球菌,还可引起腹腔感染、肺囊性纤维化、心内膜炎和脑膜炎等[2],并且由于其固有耐药和获得性耐药,使肠球菌感染的治疗非常棘手[3]。肠球菌普遍具有形成生物被膜的能力,它可以阻碍或延迟细菌与抗生素接触,则降低肠球菌对药物的敏感性,致使感染难以治愈[4]。细菌生物被膜在细菌致病机制及耐药性形成中均具有重要意义。因此,学者们开始关注肠球菌引起的感染,探讨肠球菌生物被膜形成的分子机制。细菌生物被膜的形成是由某些独特基因所控制的[5],粪肠球菌生物被膜形成也是如此。我们用PCR技术对分离的粪球菌生物被膜菌组和浮游菌组细菌中的ebpA、gelE和fsrB三种与生物被膜形成相关的基因进行检测,探讨粪肠球菌生物被膜形成的分子机制。
1 材料与方法
1.1 菌株来源 无菌操作收集云南省大理学院附属医院泌尿外科2011年10月~2012年5月留置导尿管患者导尿管标本,按卫生部颁布《全国临床检验操作规程》进行培养和生化反应。
1.2 主要试剂及仪器 BHI培养基由北京陆桥技术有限公司提供;PCR试剂,溶菌酶,细菌基因组DNA提取试剂盒以及Ladder Marker均由北京天根生化科技有限公司提供。全自动细菌鉴定及药敏分析仪VITEK2为法国生物梅里埃公司产品,PCR扩增仪为PE公司产品,全自动凝胶图像分析系统为Syngene公司产品。
1.3 细菌的分离培养与鉴定 将收集至医院的导尿管标本,通过刚果红培养基、生物被膜半定量检测以及细菌生理生化反应,可疑菌株用全自动细菌鉴定仪鉴定,筛选生物被膜阳性粪肠球菌及其相应的浮游菌。
1.4 基因扩增 将鉴定过的细菌培养过夜,用DNA提取试剂盒提取DNA作为模板,根据Gene Bank中的序列设计引物。gelE-F:5'-AGT GAA CGC TAC AGA TGG AAC-3',gelE-R:5'-CGT TCC GTG TAA AGC AAT TCC-3',长度 145 bp;ebpA-F:5'-AAA AAT GAT TCG GCT CCA GAA-3',ebpA-R:5'-TGC CAG ATT CGC TCT CAA AG-3',长度 111 bp;fsrB-F:5'-TGG ATC AGG AAG ATC AAT CAG G-3',fsrB-R:5'-GTA CGA CGT ATA CAA TAA AGG TTT CG-3',长度147 bp。取1 μL DNA 为 PCR 模板,浓度为25 μmol/L的上述引物各1 μL为进行 PCR。反应条件为:95℃3 min后,按下列参数循环35次,94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸40 s,最后72℃延伸5 min。凝胶成像仪拍照记录结果。
1.5 统计学方法 采用SPSS11.0软件进行 χ2统计分析。以P<0.05为有统计学差异。
2 结果
2.1 细菌的分离培养与鉴定 通过刚果红培养基、生物被膜半定量检测以及细菌生理生化鉴定得到粪肠球菌生物被膜菌21株及其相应的浮游菌21株。
2.2 gelE、ebpA和fsrB基因的PCR扩增结果 对上述21株生物被膜粪肠球菌及其相应的浮游菌行gelE、ebpA和fsrB基因的PCR扩增后,阳性菌株出现了相应的条带,见图1~3。
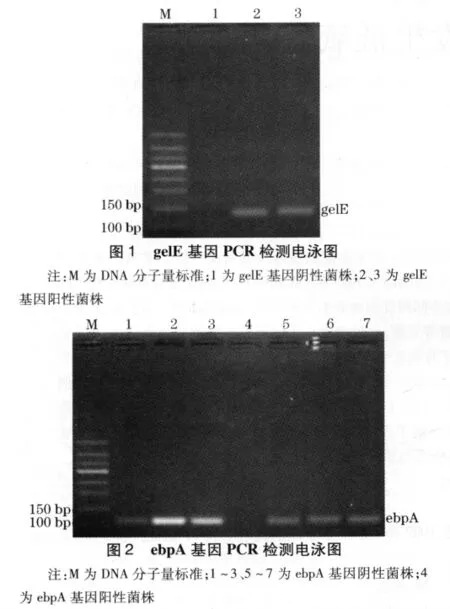
2.3 gelE、ebpA和fsrB基因的检测结果分析 21株生物被膜粪肠球菌gelE、ebpA和fsrB基因的阳性率分别是 9.52%(2/21)、95.24%(20/21)和9.52%(2/21);其相应的21株浮游菌组粪肠球菌检测出的阳性率分别是85.71%(18/21)、9.52%(2/21)和90.48%(19/21),两者比较(χ2值分别为 24.436、9.348、27.524,P 均 <0.05)。
3 讨论
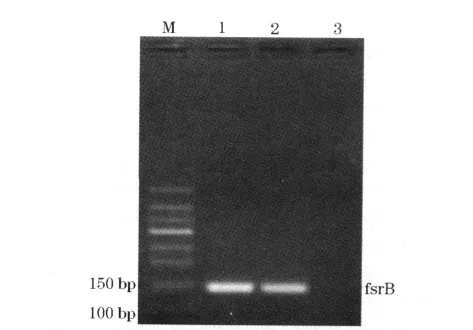
图3 fsrB基因PCR检测电泳图
肠球菌已经成为医院感染常见的条件病原菌,当人体免疫力低下或肠球菌定植部位改变时,可引起泌尿道感染、腹腔感染、伤口感染,甚至菌血症及败血症、心内膜炎等。因此,对肠球菌致病性的研究引起了人们的高度重视。
细菌生物被膜的形成是由某些独特基因所控制的[5]。gelE基因编码的明胶酶,gelE的表达由 fsr编码的密度感应系统调控,与粪肠球菌生物被膜的形成有关。fsr调节基因座由fsrA、fsrB和fsrC三个基因组成,编码粪肠球菌fsr密度感应信号传导系统,该系统可以通过影响明胶酶的生成影响生物膜的形成,fsr缺失突变株减少了聚苯乙烯平板上肠球菌生物膜形成[6,7]。菌毛形成是生物膜形成的必要条件,由多种类型的前体蛋白交联构成。ebp基因座编码菌毛,ebp操纵子包含ebpA、ebpB、ebpC和相关的srtC(编码分选酶C)基因[8]。粪肠球菌菌毛缺失突变株减少了粪肠球菌菌毛操纵子ebpA、B、C的表达,减少了菌毛的产生,导致原发粘附的缺失,不能形成生物膜[9]。本实验采用PCR技术检测所筛选的21株粪肠球菌生物被膜菌及其浮游状态菌的gelE、ebpA和fsrB基因,发现ebpA代表的菌毛操纵子在生物被膜阳性组中表达率高于浮游菌组,而gelE与fsrB基因的结果相反,生物被膜组中表达率均要低于浮游菌组,这与文献相一致[10]。
因此,可推测ebpA基因能促进粪肠球菌生物被膜形成;gelE和fsrB基因可抑制生物被膜形成。这将为进一步研究肠球菌生物被膜形成的分子机制,深入确定可行的药物靶点和小分子物质,以达到抑制生物被膜形成和抑制感染期病原体毒性,来解决实际临床难题提供依据。
[1]De Fátima Silva Lopes M,Ribeiro T,Abrantes M,et al.Antimicrobial resistance profiles of dairy and clinical isolates and type strains of enterococci[J].Food Microbiol,2005,103(2):191-198.
[2]汪仁莉,张玉玲,张成莲.细菌生物膜的研究进展[J].宁夏农学院学报,2003,24(4):77-79.
[3]Wilcks A,Andersen SR,Licht TR.Characterization of transferable tetracycline resistance genes in Enterococcus faecalis isolated from raw food [J].FEMS Microbiol Lett,2005,243(1):15-19.
[4]Moskowitz SM,Foster JM,Emerson J,et al.Clinically feasible biofilm susceptibility assay for isolates of Pseudomonas aeruginose from patients with cystic fibrosis[J].Clinic Microbiol,2004,42(5):1915-1922.
[5]Knobloch JK,Bartschte A.Biofilm formation by Staphylococcus epidermidis depends on functional RsbU,an activator of the sigB operon:differential activation mechanisms due to ethanol and salt stress[J].Bacteriology,2001,183(8):2624-2633.
[6]Mandlik A,Swierczynski A,Das A,et al.Pili in Gram-positive bacteria:assembly,involve-ment in colonization and biofilm development[J].Trends Microbiol,2008,16(1):33-40.
[7]Rice LB,Carias L,Rudin S,et al.A potential virulence gene,hyl-Efm,predominates in Enterococcus faecium of clinical origin[J].Infect Dis,2003,187(3):508-512.
[8]Singh KV,Nallapareddy SR,Murray BE.Importance of the ebp(endocarditis-and biofilm-associated pilus)locus in the pathogenesis of Enterococcus faecalis ascending urinary tract infection[J].Infect Dis,2007,195(11):1671-1677.
[9]Budzik JM,Schneewind O.Pili prove pertinent to enterococcal endocarditis[J].Clin Invest,2006,116(10):2582-2584.
[10]漆涌,邹彬彬,伍勇.粪肠球菌 esp、gelE、ebpA 基因及 QS-fsr系统与生物被膜形成关系的研究[J].中华检验医学杂志,2010,33(10):931-935.

