丝裂霉素水凝胶对兔晶状体摘除术后后囊浑浊的防治作用
吴建峰,毕宏生,刘冬梅,苏卫华,郭俊国
(1山东中医药大学,济南250355;2山东中医药大学第二附属医院;3山东中医药大学眼科研究所)
白内障囊外摘除术后或晶状体外伤后,残留的晶状体皮质或晶状体上皮细胞(LEC)增生所形成的混浊,即后囊膜混浊(PCO),是导致患者术后远期视力下降的最主要原因之一。据Sundelin等[1]统计,白内障摘除术后5年内PCO发生率为43%,术后3~5年内有10% ~50%的患者需进一步手术处理。目前,临床上的主要治疗手段是行YAG激光后囊膜切开,但由于后囊破损干扰了正常的眼内结构,可能会导致一系列的并发症,如人工晶体损伤、眼内压升高、黄斑囊样水肿,甚至视网膜脱离。因此,如能在术中采取必要措施防止PCO发生,降低并发症的风险。2010年4月~2012年3月,我们通过囊外摘除兔眼晶状体后在晶体囊袋内注入丝裂霉素(MMC)水凝胶,观察其对PCO发生的抑制作用,筛选兼具疗效与安全性的MMC水凝胶最佳浓度,并探讨相关作用机理。
1 材料与方法
1.1 材料 自制 MMC水凝胶[2,3];健康成年新西兰大白兔56只,雌雄不限,体质量2~2.5 kg,均排除眼病;超声乳化仪(U2,美国爱尔康)及相关手术器材、耗材和药品等。
1.2 手术方法 将实验动物随机分为7组,每组8只;右眼为手术眼,术前30 min复方托吡卡胺滴眼液散瞳,0.4%盐酸奥布卡因滴眼液点眼表面麻醉,氯胺酮、氯丙嗪25 mg/kg肌注麻醉。做3.2 mm透明角膜切口,前房内注入黏弹剂(1.5%透明质酸钠,上海其胜),连续环行撕囊,直径约 6 mm,吸出晶状体皮质。A组为对照组,术中不注入MMC水凝胶;B~G组为治疗组,晶体皮质吸出后,先将黏弹剂充满前房,保护角膜及虹膜等眼内组织;然后囊袋内注入MMC水凝胶0.1 mL,B组和C组、D组和E 组、F 组和 G 组囊袋内分别注入 0.2、0.4 、0.6 mg/mL的MMC水凝胶,各浓度两组分别作用3、5 min后吸出。用10-0尼龙缝线缝合切口1针,术毕氧氟沙星滴眼液及红霉素眼膏点眼。手术由同一人完成。术后予妥布霉素地塞米松滴眼液点眼,每日4次,连续2周。
1.3 观察方法
1.3.1 眼前节观察 术后第1天、3天、1周、1个月、3个月,行裂隙灯显微镜检查眼前节(结膜充血程度、角膜是否水肿、切口愈合情况等)。
1.3.2 后囊膜混浊观察 术后1天、1周、1个月、3个月,通过裂隙灯观察并记录后囊增殖情况;后囊膜混浊程度分级:0级为透明;1级为轻度混浊,能看清眼底或混浊区面积小于1/2后囊膜面积;2级为中度混浊,能模糊见眼底或混浊面积大于1/2后囊膜面积;3级为完全混浊,无法看见眼底。
1.3.3 房水总蛋白检测 术后第1天、1周、1个月,抽取各组术眼房水0.2 mL,用K5600微量分光光度计(KO,上海)检测房水总蛋白含量。
1.3.4 角膜厚度测量 术后1周、1个月,采用DGH4000角膜测厚仪(JEDMED,美国)进行术眼的角膜厚度测量;每只眼测量3次,取平均值。
1.3.5 角膜内皮细胞计数 术后1周、1个月、3个月,用2000P角膜内皮计(TOPCON,日本)对术眼角膜内皮细胞计数并记录。
1.3.6 组织病理学检查 术后3个月,处死实验动物后摘除眼球,置于10%甲醛溶液固定24 h以上,流水冲洗8 h;经梯度乙醇脱水后,进行浸蜡、包埋、切片,HE染色后显微镜观察。术后3个月,处死实验动物后摘除眼球;用冷生理盐水洗净眼球表面后,立即置于4%的戊二醛溶液中预固定40 min;在显微镜下将晶状体囊膜取出,即刻置于固定液中固定3 h以上;用PBS溶液冲洗3次,1%锇酸固定;环氧树脂包埋,超薄切片,经铀—铅染色后透射电镜观察。
1.4 统计学方法 采用SPSS16.0统计软件。所得数据进行等级资料(有序多分类资料)的Logistic回归分析、方差分析和t检验等。P≤0.05为差异有统计学意义。
2 结果
2.1 各组术后眼前节反应情况 术后第1天各组结膜充血均较明显,第5~7天基本消退;各组角膜均出现中度混浊,并有明显房水混浊发生,术后第7~10天消失。
2.2 各组PCO发生情况 Logistic回归分析显示,MMC水凝胶治疗组低于对照组(P均<0.05);各治疗组间比较P均<0.05,且MMC浓度越高,PCO发生的比例和分级越低。见表1。
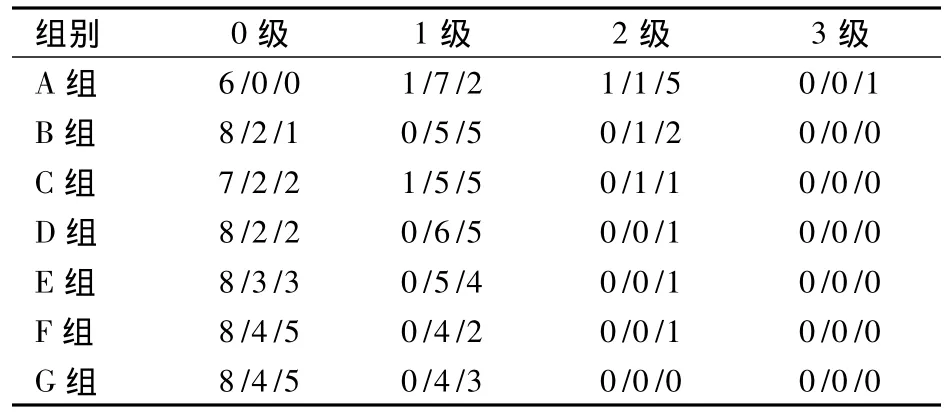
表1 各组术后1周、1个月、3个月PCO发病情况(只)
2.3 各组术后房水蛋白含量比较 术后第1天房水总蛋白含量,治疗组均高于对照组(P均 <0.05);治疗组中,G组房水蛋白含量最高,与 D、F组比较,P均<0.05;F组与G组、D组与E组比较,P均<0.05。术后第1周房水总蛋白含量,治疗组均高于对照组(P均<0.05);D、F组分别与B、E、G组比较,P均 <0.05;术后1个月,对照组、B组、C组均与F组和 G组间有差异(P均 <0.05)。见表2。
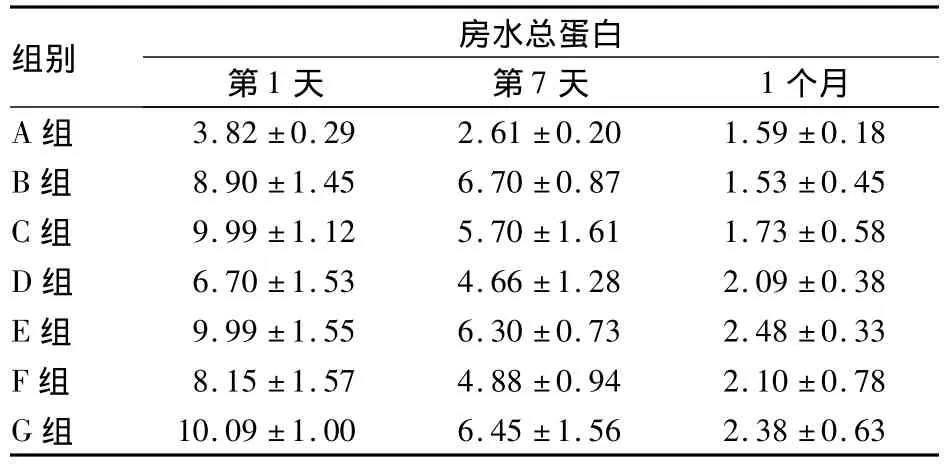
表2 各组术后房水总蛋白含量(mg/mL,¯x±s)
2.4 各组术后角膜厚度比较 术后1周,除B组外,对照组与其余各治疗组间角膜厚度比较,P均<0.05;B组和C组、D组和E组、F组和G组比较,P均<0.05。术后1个月,D、E、F组与对照组、B组、C组比较,P 均 <0.05;C、D、E、F组与 G 组比较,P均 <0.05。见表 3。
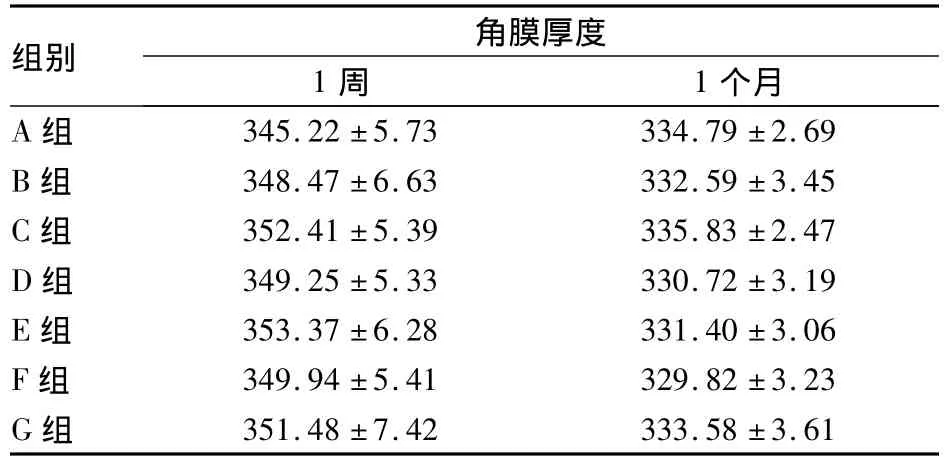
表3 各组术后角膜厚度比较(μm,¯x±s)
2.5 各组角膜内皮细胞计数比较 见表4。
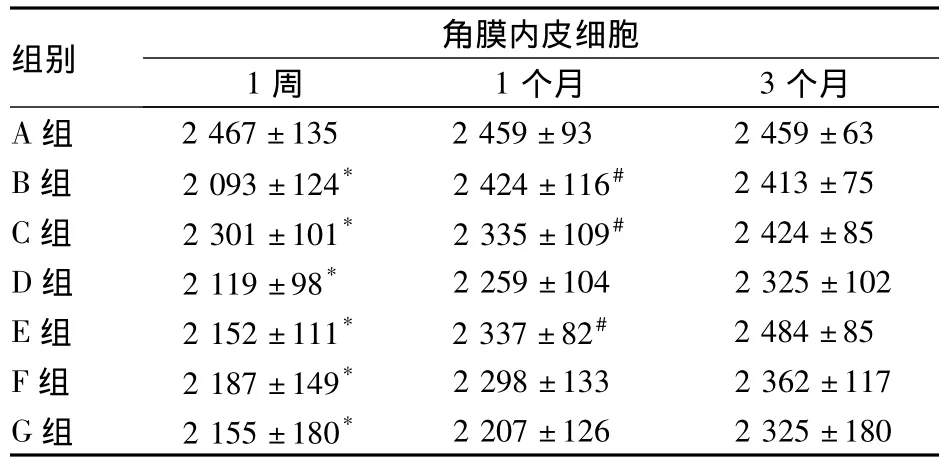
表4 各组术后角膜内皮细胞计数比较(个/mm2,¯x±s)
2.6 各组术后组织病理检查结果 术后3个月,HE染色后角膜基本恢复正常,内皮细胞排列紧密,房角结构正常。透射电镜检查显示,对照组晶状体上皮细胞结构完整,细胞器丰富,染色体分布均匀,呈功能活跃状态;治疗组晶状体上皮细胞不同程度体积变小,细胞表面微绒毛消失,胞质浓缩,内有空泡形成,线粒体肿胀,嵴结构不清,染色体靠边聚集,粗面内质网扩张。
3 讨论
一般认为,PCO的发生是术后残留的晶状体上皮细胞在各种因素作用下发生增殖、分化、移行,使后囊出现白色混浊,阻碍光线通过[4]。也有学者发现[5],赤道部上皮细胞保留了干细胞的特性,分化活跃,具有移行性,也是PCO发生的重要区域。
由于PCO的发生受多种因素影响,随着手术方式的改进、人工晶体材料及设计的提高,都能在一定程度上减少其发生。但因不能彻底清除晶状体上皮细胞,所以不能完全阻止PCO的发生。故针对引起PCO的根本原因,寻求适当的药物防治措施,仍是研究的重要方向。目前,治疗药物主要有抗代谢药、纤维蛋白溶解药等。抗代谢药物的基本原理是抑制晶状体上皮细胞的有丝分裂,避免对非有丝分裂的毒性作用。用于实验研究的药物,有MMC、柔红霉素、三氧化二砷、5-氟尿嘧啶、秋水仙碱等[6~8]。此类药物均可抑制晶状体上皮细胞的增殖,但由于有一定的眼内毒性,临床应用受到限制。其中MMC可使术后角膜内皮明显减少,角膜混浊明显;柔红霉素可在术后早期引起角膜、虹膜、睫状体组织的炎性水肿;三氧化二砷可抑制晶状体上皮细胞的生长并诱导期凋亡。纤维蛋白溶解药肝素是较早被用做研究的药物之一,它在临床上已被较多使用,疗效肯定,但有引起眼内出血的可能[9]。因此,安全性和有效性是PCO防治药物或剂型研制的关键问题。
理想的药物应当能有效抑制晶状体上皮细胞增生,对眼内其他细胞无毒性作用,且临床用药应方便可行。晶状体囊袋内灌注用药,可使药物与晶状体上皮细胞接触而发挥其抑制作用,是最直接的用药途径。MMC可与DNA分子的双螺旋结构形成交联,破坏DNA的结构和功能,抑制增殖期的DNA复制,对增殖各期细胞均有杀伤作用,同时也作用于静止期细胞。本实验发现,随水凝胶制剂中MMC浓度增加,术后PCO发生率呈下降趋势,且级别较低,因此认为MMC水凝胶囊袋内给药对预防PCO的发生是有显著效果的。
MMC眼内用药由于血眼屏障的存在,进入血液循环的量极少,且0.05%的药物质量浓度远小于治疗肿瘤时全身用药剂量,故认为囊袋内用药不会影响全身其他器官。眼前段用药最直接的影响部位是角膜和虹膜,McDermott等[10]认为,MMC对角膜的影响与质量浓度有关。房水中的蛋白浓度是反映血—房水屏障功能的客观指标之一,亦是评价眼前节炎性反应程度的依据,能够反映MMC水凝胶对眼前节系统的毒副作用[11]。本实验发现,即使最低浓度的MMC水凝胶也会对角膜和眼前节的血房水屏障产生影响,但这种影响比较轻微;在角膜内皮计数和房水蛋白含量的变化方面,在数值上差异并不大,这也能够解释为何通过裂隙灯和眼前节照相系统观察到的角膜水肿与眼前节炎症反应,对照组与治疗组并无显著差别。本实验将MMC制成凝胶囊袋内给药,即可使MMC充分与晶状体上皮细胞接触而发挥其抑制作用,又可以减少MMC对眼部组织的损害;另外,注入凝胶前已在前房注入黏弹剂,即能减少药物向囊袋外的渗漏、保护眼前节组织,又能增加MMC与囊袋的接触时间。
本研究也显示,0.6 mg/mL的 MMC在抑制PCO的发生方面有最佳的疗效。在不同作用时间组之间的比较中又发现,较长的MMC水凝胶留置时间,可能导致更明显的角膜和血房水屏障的破坏作用,提示该制剂的眼内留置时间以较短(3 min)为宜;同时也提示随眼内留置时间的增长,有更多的MMC弥散至前房。因此,改进制剂以控制这种弥散也是下一步研究的重要课题。
[1]Sundelin K,Sjostrand J.Posterior capsule opacification 5 years after extracapsular cataract extraction [J].J Cataract Refract Surg,1999,25(2):246-250.
[2]毕宏生,苏卫华,郭俊国,等.丝裂霉素C眼用凝胶的制备及质量控制[J].生物医学工程研究,2011,30(3):181-183.
[3]毕宏生,郭俊国,解孝锋,等.清开灵眼用凝胶的制备与质量控制[J].生物医学工程研究,2010,29(1):62-64.
[4]Apple DJ,Solomon KD,Tetz MR,et al.Posterior capsular opacification[J].Surv Ophthalmal,1992,37(2):73-116.
[5]Peng Q,Apple DJ,Visessook N,et al.Surgical prevention of posterior capsule opacification.Part2:enhancement of cortical cleanup by focusing on hydrodissection[J].J Cataract Refract Surg,2000,26(2):188-197.
[6]王洪涛,施玉瑛,董喆.丝裂霉素C眼内应用抑制后囊膜混浊的实验研究[J].中国实用眼科杂志,2004,22(5):382-386.
[7]任晓冰.柔红霉素抑制家兔后发性白内障的形态学研究[J].眼视光学杂志,2003,5(1):4-7.
[8]关立南,刘平,李志坚.水分离时应用三氧化二砷抑制兔眼后囊膜混浊及其眼内毒性的实验研究[J].眼科新进展,2007,27(3):179-183.
[9]夏小平,陆道炎,王丽天,等.肝素抑制后发性白内障形成的临床研究[J].中华眼科杂志,1994,30(6):405-407.
[10]McDermott ML,Wang J,Shin DH.Mitomycin and the human corneal endothelium [J].Arch Ophthalmal,1994,112(4):533.
[11]罗莉霞,刘奕志,张新愉,等.超声乳化白内障吸除术对血—房水屏障功能的影响[J].中华眼科杂志,2004,40(1):26-29.

