铜绿微囊藻对培养液氮转化及微生物功能群的影响
童昊雅, 王爱丽, 余康华, 李 骐, 李文龙, 肖 琳,3
(1.南京大学环境学院,江苏 南京 210023;2.南京大学匡亚明学院,江苏 南京 210093;3.污染控制与资源化研究国家重点实验室,江苏 南京 210023)
水华是湖泊富营养化的典型表征之一,蓝藻水华的形成影响了水生态系统的健康发展。蓝藻大量生长改变了水体的理化环境,使水体透明度降低,散发腥臭味,溶解氧减少,并造成鱼虾等水生物的死亡。因此,蓝藻水华被认为是影响水质的重要因素之一,此外,它产生的以微囊藻毒素为代表的有毒代谢物,能够严重危害人类身体健康和生命安全。当水体中的营养素被蓝藻耗尽时,蓝藻大量死亡。死亡的藻体,在被细菌分解过程中还会产生并释放蓝藻毒素,最终导致水生态系统的迅速崩溃[1]。所以,国内外学者对暴发水华的蓝藻进行了大量研究,其中,对蓝藻优势种——铜绿微囊藻(Microcystis aeruginosa)研究最多。
蓝藻水华的暴发首先与外源性营养元素有关,而氮正是蓝藻生长所需的最重要的营养元素之一,因此,探究铜绿微囊藻生长周期内各形态氮含量的变化,对于研究蓝藻水华的生态影响,控制蓝藻水华具有重要意义。而水体氮元素的生物转化,主要是在微生物驱动下进行的,其主要过程包括氨化、吸收同化作用、硝化和反硝化作用等。对于生物脱氮,除了受溶解氧、pH等因素影响外,参与氮循环过程的几种微生物种群是制约氮素去除效率的主要因素,例如硝化和亚硝化细菌,它们的世代时间一般为15 h,而一些异养的微生物,它们的世代时间一般为20~40 min,生长缓慢的硝化微生物经常由于对氧气和营养物质的弱竞争力导致生长不良或被冲刷掉[2-4]。因此研究在蓝藻水华暴发过程中,氮转化微生物功能群群落结构的变化,对寻求有效的生物修复方法具有重要的指导作用。
国内对湖泊生态的研究是比较全面的,但是就蓝藻对氮循环的影响研究还不多。湖泊中氮循环相关微生物的群落结构以及遗传学特性受蓝藻水华影响的研究国内现在还未见报道[5]。
1 材料与方法
1.1 试验材料
试验使用的铜绿微囊藻(Microcystis aeruginosa)采用中国科学院武汉水生生物研究所提供的铜绿微囊藻7806,使用培养基BG-11,培养条件为25℃,光暗比12 h/12 h,光照度为 2 200 lx。
1.2 试验方法
1.2.1 试验设计 试验地点设在南京大学环境学院实验室。根据预试验结果,设置处理组如下,取处于对数生长期的铜绿微囊藻,经离心(4 000 r/min,15 min),洗涤后接种在BG-11培养基中,使体系藻密度达到106CFU/ml,置于光照培养箱中培养。除了处理组之外,另设一组对照组,每组均为3个平行。试验在2 000 ml大烧杯中进行,初始体系为1 600 ml,时间从2011年10月15日到12月14日,每天测定各体系的pH、氧化还原电位,每周测定所有体系中总氮、硝酸盐氮、亚硝酸盐氮、氨氮含量及处理体系中藻密度的变化,在试验开始、中间及结束时用最大可能数法测定水体中反硝化细菌的数量,在试验开始及结束时用T-RFLP技术对各体系中微生物群落结构进行分析。
1.2.2 pH、氧化还原电位及铜绿微囊藻生长曲线的测定 用便携式氧化还原电位仪(雷磁PHBJ-260)测定各体系氧化还原电位,用精密 pH计(DENVER UB-7)测定各体系pH,用细胞计数器(Beckman coulter)对处理组藻液进行细胞计数,根据每周藻液藻密度变化,绘制生长曲线。
1.2.3 各形态氮含量的测定 每次取各体系内培养液1 ml,121℃下用碱性过硫酸钾消解后,用紫外分光光度法测定水体总氮含量。每次取各体系内培养液3 ml,用0.45 μm滤器进行过滤,弃去初滤液1 ml,取剩下的滤液1 ml,用紫外分光光度法测定硝酸盐氮含量。亚硝酸盐氮及氨氮含量测定预处理方法同硝酸盐氮,测试方法分别为N-(1-萘基)-乙二胺分光光度法及纳氏试剂光度法。
1.2.4 反硝化细菌数量的测定 用MPN法测定水样中的细菌数[6]。配制反硝化细菌液体培养基,每根培养试管(长度150 mm×直径15 mm)中装入9 ml培养基,并将小指管(长度30 mm×直径15 mm)分别倒置在装有反硝化培养基的每支试管中,加塞,在121℃下灭菌30 min 备用。每个水样作10-3、10-4、10-53 个10倍系列稀释,每支试管中接种水样和稀释水样各1 ml,每个稀释度做5个平行。在(28±1)℃条件下,反硝化细菌培养15 d,定期观测发酵管内发酵、产气情况,15 d后以格里斯试剂、二苯胺试剂、硫酸亚铁试剂等检测各种形态氮的产生消失情况,查MPN表,用下式计算样品中细菌数:1 ml(g)样品中菌数=菌近似值×数量指标第1位数的稀释倍数,结果取细菌数的常用对数作图分析[4]。
1.2.5 水体细菌群落结构的测定 在试验开始后一周及试验结束时,共2次分别对6个体系进行取样测定。每个体系取样200 ml。平行体系在提取DNA后,合并提取物进行分析。
提取总DNA:将200 ml培养藻液过0.45 μm的灭菌滤膜,在液氮中反复冻融3次,用玻璃匀浆器捣碎,样品加入1.35 ml提取缓冲液[0.1 mol/L PBS(pH 8.0),0.1 mol/L EDTA,0.1 mol/L Tris base(pH 8.0),1.5 mol/L NaCl,1.0%CTAB]和 5 μl蛋白酶 K(10 mg/L),在37℃、225 r/min振荡30 min后,加入0.15 ml 20%的SDS,然后65℃水浴加热2 h(每隔15 min轻轻摇动1次)。将上述样品处理液以10 000 r/min离心10 min后收集上清液,加入等体积的酚/氯仿/异戊醇(25∶24∶1,体积比),混匀,离心5 min,将上清液转入另一只离心管中,加入1∶1(体积比)的氯仿/异戊醇(24∶1,体积比)抽提上清液,9 000 r/min离心5 min后,在上清液中加入0.6倍体积异丙醇,-20℃沉淀 30 min,12 000 r/min离心15 min,弃上清液,70%冰乙醇清洗两次,无菌风吹干,用35 μl TE缓冲液溶解沉淀得到总DNA的提取液,0.8%琼脂糖凝胶电泳,溴化乙锭染色,结果在 20 000 bp处有条带,说明提取到总DNA。将提取到的基因组置于-20℃保存备用。
PCR扩增:参考Leser等于2000年发表的细菌16S rDNA通用序列(8-27F:5'-AGAGTTTGATCCTG GCTCAG-3';SD-BACT-0926:5'-CCGTCAATTCCTTT RAGTTT-3')设计引物。引物的5'末端用6-FAM荧光标记。PCR反应体系:利用DNA提取物作为模板,PCR 反应总体系为 20.0 μl,内含 5.0 μl 10 × PCR Buffer,4.0 μl dNTPs,上下游引物各 0.2 μl,0.5 μl模板DNA,0.25 μl rTaq酶(TaKaRa公司)。反应条件:95 ℃ 3 min;94 ℃ 30 s,57 ℃ 45 s,72 ℃ 2 min,30 个循环;最终72℃延伸4 min。反应后,均置于-20℃保存。
PCR反应结果检测:取5 μl PCR扩增产物进行0.8%琼脂糖凝电泳,溴化乙锭染色,紫外灯下观察拍照。
16S rDNA扩增产物的酶切:利用限制性内切酶HaeⅢ酶切PCR扩增得到的16S rDNA产物,反应总体系为10.0 μl,内含 10 倍缓冲液 1.0 μl,PCR 产物8.5 μl,内切酶 HaeⅢ0.5 μl。在 37 ℃水浴酶切 5 h后置于65℃水浴30 min,酶切产物置于4℃保存。
CEQ-8000遗传分析仪测定分析:每个反应孔中加入 0.5 μl酶切产物、30 μl上样缓冲液及 0.5 μl标准分子量,上机检测。检测完毕后,通过仪器软件自动分析数据。
1.3 数据处理及作图
采用Excel 2010处理数据及作图,SPSS 17.0进行ANOVA统计分析。
2 结果与分析
2.1 铜绿微囊藻水华对水体理化性质的影响
2.1.1 对水体pH值及氧化还原电位的影响 通过测定体系中铜绿微囊藻密度,得到铜绿微囊藻生长状况大致如下:1~3周铜绿微囊藻处于稳定期,第4周开始进入快速增长期,5~6周增殖速度减缓,6~7周处于稳定期,7~8周进入衰亡期。
在整个生长过程中,空白水体pH值始终低于藻处理。空白水体中pH值,基本维持在最初的水平(7.1左右);而接种铜绿微囊藻的体系中,pH值先升高后下降。这是由于藻类在对数生长期光合作用较强烈,不断消耗水体中的CO2及HCO3-,导致水体的酸性下降,pH值升高,最初会升高至10左右,进入稳定期和衰亡期后,铜绿微囊藻光合作用减弱而呼吸作用加强,产生的CO2溶于水中,pH值有所下降,最终维持在8左右。有研究表明,水体pH值高有利于铜绿微囊藻的生长[7-8],而微囊藻的生长又使水体pH值进一步上升,水体pH的变化与微囊藻藻密度的变化是它们交互作用的结果,互为因果关系[9]。
试验周期中,空白水体氧化还原电位始终高于藻处理。大量的铜绿微囊藻会使水体中溶解氧含量降低,氧化还原电位随之降低,从而改变藻类的生长环境[10]。有研究表明,低氧化还原条件有利于铜绿微囊藻体内多聚磷的积累,增强其对不适条件的抵抗能力[11],并且低氧化还原条件可以提高铜绿微囊藻的细胞分裂速度,提高其生长速率[12]。
2.1.2 对水体氮转化的影响
2.1.2.1 对水体总氮含量的影响 在试验周期中,空白水体总氮含量大致守恒,始终保持在初始值250 mg/L左右(图1)。在开始3周,藻处理总氮含量略高于空白水体,但差异不显著,微小的差异可能是由加入体系中的铜绿微囊藻带来的。在第4周,铜绿微囊藻进入快速增长期,藻处理的总氮含量在一周内有了非常明显的下降,与空白处理出现了极显著性差异(P<0.01),这种差异一直持续到试验周期结束,可能是由于铜绿微囊藻的大量增殖为反硝化细菌的生长提供了有利条件,反硝化作用有了较大程度的增长。在之后几周,藻处理的总氮含量略有下降但是下降不再明显,这可能是由于此时硝化反硝化作用以及藻的同化作用处于一个相对平衡的状态,反硝化作用略强于硝化作用及藻同化作用的总和。最终含藻培养液的总氮含量从最初的261 mg/L下降到了166 mg/L,减少了36.40%,说明试验过程中,一部分NOx通过反硝化作用转化为氮气排出体系外,一定程度上削减了体系中的氮营养盐含量。

图1 水体中总氮含量变化Fig.1 Variation of total nitrogen content in different water bodies
2.1.2.2 对水体NOx含量的影响 所有体系中,氮均以NOx为主要存在形式,自始至终占体系总氮量的50%以上。在空白水体中,NOx量始终占总氮量的80%以上。而在藻处理中,由于藻团的微环境为氮转化细菌尤其是反硝化细菌提供了有利的生长环境,所以出现了如下的变化:1~3周,NOx含量占总氮含量的80%以上;在铜绿微囊藻进入快速增长期即第4周后,NOx比例下降(图2),这可能是由铜绿微囊藻的同化作用及水体中微生物的反硝化作用增强所导致的,在增长速度最快的第4周,NOx含量占总氮含量<70%,此时藻处理的NOx含量与空白出现极显著性差异(P<0.01),这种差异一直持续到试验周期结束;在铜绿微囊藻增长速度放缓及之后的稳定期、衰亡期中,NOx含量比例有所上升,这可能是因为藻细胞出现衰亡,细胞破裂释放出一定量的氮元素所导致,最终NOx含量稳定在75%左右。在整个试验周期中,所有体系中的NO3-与总氮变化趋势均类似,说明总氮的去除主要是由于硝态氮的反硝化作用引起的。而NO2-含量在空白水体中变化不大;但是在藻处理中,NO2-含量先快速上升,而后下降,这是由于培养液中存在反硝化作用,铜绿微囊藻在光照条件下进行光合作用产生氧气,在黑暗条件下进行呼吸作用消耗氧气造成藻处理氧化还原电位较低,有利于反硝化作用的进行。

图2 水体中NOx含量变化Fig.2 Variation of NOxcontent in different water bodies
2.1.2.3 对水体氨态氮含量的影响 空白水体与藻处理的氨态氮含量及变化趋势都较为相近,随时间的推移缓慢升高(图3)。有研究表明,总氮的降解有一部分是通过氨态氮的迁移转化进行的[13]。氨态氮含量随时间不断升高,空白水体中可能来源于总氮的降解;藻处理中可能一部分来源于总氮的降解,另一部分来源于藻类残骸的分解释放,导致藻处理的氨态氮含量在后期略高于空白水体。

图3 水体中氨态氮含量变化Fig.3 Variation of ammonia nitrogen content in different water bodies
2.2 铜绿微囊藻对水体氮转化微生物功能群的影响
2.2.1 对反硝化细菌数量的影响 用MPN法测定水体中反硝化细菌数量,结果表明,空白水体中反硝化细菌数生长缓慢,试验结束时不超过5×104CFU/ml;而藻处理中反硝化细菌数生长很快,试验结束时约为1.5×105CFU/ml。说明接入铜绿微囊藻后,铜绿微囊藻为反硝化细菌的生长提供了有利的生长环境,反硝化细菌数量较空白对照明显增多,能够加快水体氮素的释放,从而改善水体的富营养化及水体的生态状况。
2.2.2 对微生物群落结构的影响 由于试验所用培养水体为灭菌培养基,且采用密闭培养,所以即使在试验开始1周后进行测定,空白水体中细菌仍非常少,未能扩增到有效结果,因此仅讨论试验开始时的藻处理、试验结束时的空白水体及藻处理3个样品结果。根据HaeⅢ酶切T-RFLP图谱(图4)末端限制性片段数目及相对峰高值,分别计算物种丰度、多样性指数及物种均度(表1)[14]。
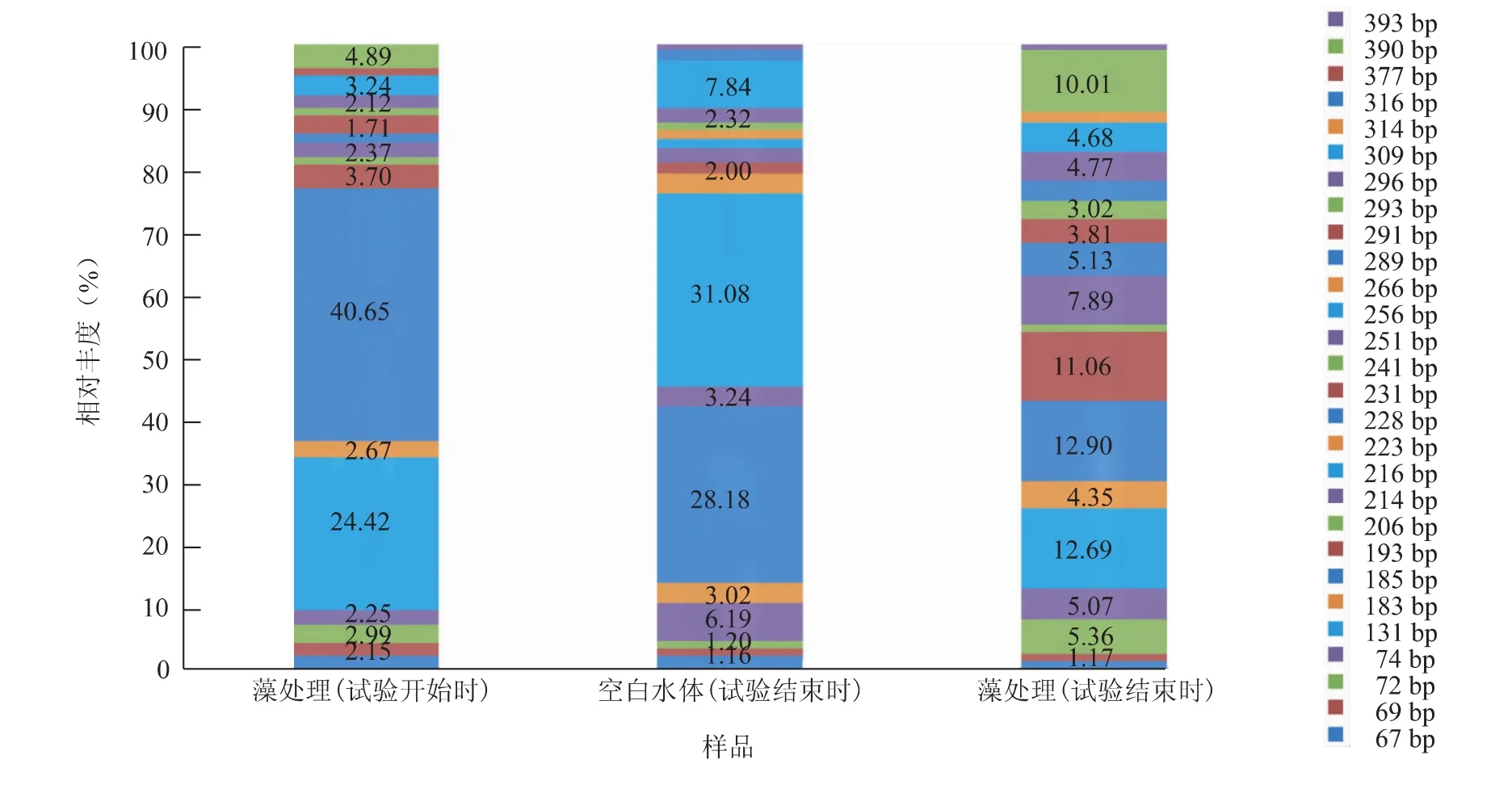
图4 不同水体中微生物的相对丰度Fig.4 Relative richness of microbe in different water bodies
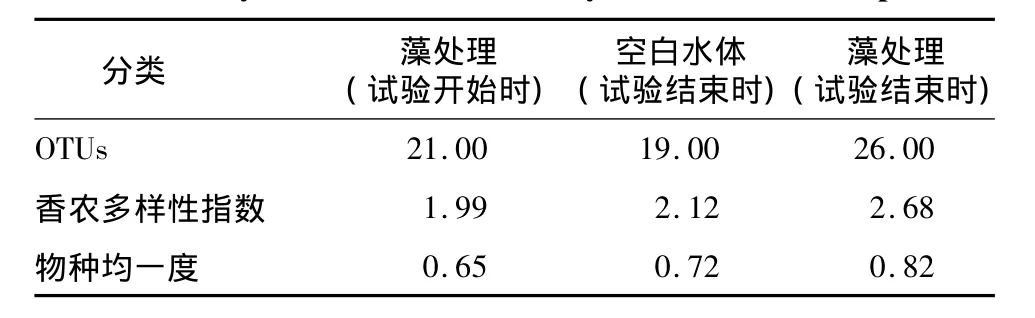
表1 基于T-RFLP图谱的微生物多样性分析Table 1 Analysis of microbial diversity based on T-RFLP profiles
根据T-RFLP图谱(图4),空白水体中的限制性片段主要是131 bp和185 bp,大约占65%;藻处理在试验开始时185 bp和216 bp占大多数,大约占60%,而在试验结束时则主要是131 bp、185 bp、193 bp、390 bp,大约占46%。其中216 bp在空白培养液中未出现,说明它为藻团本身携带的细菌,藻团可以为其生长提供有利条件。
根据表1,从不同样品的微生物多样性指数来看,经过一个试验周期,空白水体及藻处理的物种多样性都有上升,但是藻处理的物种多样性仍然更丰富。从样品的物种均一度来看,相比空白水体,藻处理的物种丰度相差不明显,较少存在占据绝对优势地位的微生物物种;而在空白培养液中,存在一定数量的占据相对优势的物种。以上结果说明铜绿微囊藻的存在能够为多种细菌提供更有利的生长环境,进一步提高生态系统物种的丰度及物种的均一性,从而提高生态系统的稳定性,为生态系统的自我修复创造有利条件。
对3个样品中的主要限制性片段进行定性分析:主要有 185 bp、131 bp、193 bp、216 bp、228 bp、231 bp、390 bp、293 bp 及 296 bp。这些片段代表了样品中的优势微生物。查询文库,结果如表2所示。
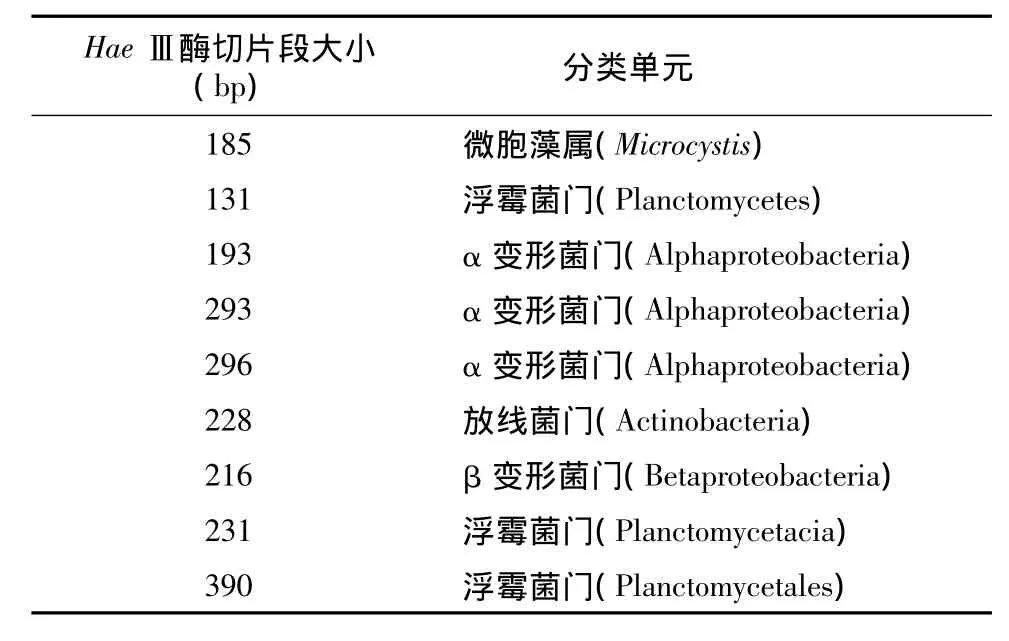
表2 限制性片段的定性分析Table 2 Qualitative analysis of terminal restriction fragment
185 bp代表的为微胞藻属(Microcystis),在本次试验中,即为铜绿微囊藻;131 bp、231 bp、390 bp代表的均为浮霉菌门(Planctomycetes)下的微生物;228 bp代表的为放线菌门(Actinobacteria)下的微生物;193 bp、293 bp、296 bp代表的为α变形菌门(Alphaproteobacteria)下的微生物,216 bp则代表β变形菌门(Betaproteobacteria)下的微生物。可以看出,藻处理组较空白水体而言,有更多的放线菌门、α变形菌门及β变形菌门微生物。有研究表明,α变形菌及β变形菌能够附着在有机聚合物上,通过连续的群落演替释放氨基酸[15]。另外,在研究水华暴发的过程中也发现,一些α变形菌能够附生在颗粒物上,并具有较快的生长速率和较高的酶活性[16]。所以,藻处理与空白水体的差异,可能是由于铜绿微囊藻造成体系氧化还原电位下降从而形成厌氧环境、聚集的藻体为细菌提供有利的附生场所造成的。
3 结论
试验结果表明,铜绿微囊藻的存在能够极大地提高水体细菌种类的丰度,同时加快水体中的反硝化作用,促进水体中氮素的释放,从而稳定水体生态系统,加快水体生态的自我修复。从各形态氮含量来看,处理的总氮含量、硝酸盐氮含量较之空白而言均有所降低,而亚硝酸盐氮处理中则有所增高。反硝化细菌数量在处理中较空白中有明显增多,铜绿微囊藻藻团有利于创造厌氧-需氧的环境,使得反硝化细菌更易在其中繁殖生长。
本试验处理时间相对较短,而研究富营养化水体中各种氮循环菌分布的长期变化是必要的,这可以有助于了解它们对氮循环所起作用的规律性。并且本次试验所用水体为实验室配制培养基,所用藻种也为实验室培养藻种,将实验室结论推广到自然生态系统中还需要进行进一步的取样论证或实地考察,才能为实际应用提供更加直接的理论依据。
致谢: 本研究得到了肖琳教授的精心指导和帮助,特此致谢!
[1]李 谷,吴振斌,侯燕松,等.养殖水体氮的生物转化及其相关微生物研究进展[J].中国生态农业学报,2006,14(1):11-15.
[2]FIGUEROA L A,SILVERSTEIN J.The effect of particulate organic matter on biofilm nitrification[J].Water Environment Research,1992,64:728-733.
[3]WIJFFELS R H,TRAMPER J.Possibilities of nitrification with immobilized cells in waste-water treatment:model or practical system[J].Wat Sci Tech,1993,27:233-240.
[4]常会庆,丁学峰,蔡景波.伊乐藻和固定化细菌对富营养化水体中氮循环菌的影响[J].河南农业科学,2008(2):52-56.
[5]曾 巾,杨柳燕,肖 琳,等.湖泊氮素生物地球化学循环及微生物作用[J].2007,19(4):382-389.
[6]陈绍铭,郑福寿.水生生物学实验法[M].北京:海洋出版社,1985.
[7]KYONG H A,EUN-AH C,KIM H W,et al.Microcystis bloom formation in the lower Nakdong River,South Korea:importance of hydrodynamics and nutrient loading[J].Marine and Freshwater Research,1999,50(1):89-94.
[8]TUCKER D L,SHERMAN L A.Analysis of chlorophyll-protein complexes from the cyanobacterium Cyanothece sp.ATCC 51142 by non-denaturing gel electrophoresis[J].Biochimica et Biophysica Acta,2000,1468(1-2):150-160.
[9]吴 剑,孔 倩,杨柳燕,等.铜绿微囊藻生长对培养液pH值和氮转化的影响[J].湖泊科学,2009,21(1):123-127.
[10]MOZELAAR R,STAL L J.Fermentation in the unicellular cyanobacterium Microcystis PCC7806[J].Archiv Fur Hydrobiologie,1994,50:491-509.
[11]SHI X,YANG L,NIU X,et al.Intracellular phosphorus metabolism of Microcystis aeruginosa under various redox potential in darkness[J].Microbiological Research,2003,158:345-352.
[12]张 民,孔繁翔,史小丽,等.铜绿微囊藻在竞争生长条件下对氧化还原电位降低的响应[J].湖泊科学,2007,19(2):118-124.
[13]黄翔峰,闻 岳,何少林,等.高效藻类塘对农村生活污水的处理及氮的迁移转化[J].环境科学,2008,29(8):2219-2226.
[14]余素林,吴晓磊,钱 易.环境微生物群落分析的T-RFLP技术及其优化措施[J].应用与环境生物学报,2006,12(6):861-868.
[15]SCHWEITZER B,HUBER I,AMANN R,et al.A-and B-Proteobacteria control the consumption and release of amino acids on lake snowaggregates[J].Applied and Environmental Microbiology,2001,67(2):632-645.
[16]金相灿,李兆春,郑朔方,等.铜绿微囊藻生长特性研究[J].环境科学研究,2004,17(6):52-54.

