DEA复配水溶液二氧化碳溶解度的测定实验
李小康,刘应书,张 辉,魏广飞,李 虎,张四宗
(北京科技大学机械工程学院,北京100083)
近年来,在温室气体排放的负面影响逐渐显著和气候变暖的背景下,减少温室气体排放已经成为一个国际社会重点关注的全球性问题[1]。而在所有的温室气体中,CO2由于其排放量巨大,其减排方法和技术的研究开发逐渐成为世界各国重点研究的课题[2-3]。在碱性溶液吸收脱碳方面,各种脱碳剂相继出现[4-5],其中,新型有机胺溶剂是最为优秀的一种。
CO2的平衡溶解度是衡量一种脱碳剂脱除CO2能力的一项重要指标,也是工程上设计脱碳装置所必须的数据,因此,各国学者对CO2在新型有机胺中的平衡溶解度有了大量的研究。Saeed Mazinani等[6]研究了低压下乙醇胺(MEA)和甘氨酸钠(SG)复配溶液中CO2溶解度规律,测定了SG 摩尔比在0.2~0.8 之间、总浓度为2.5 mol/L 的混合溶液中温度为298 K、303 K、313 K 条件下CO2分压在0~35 kPa 的CO2溶解度,发现SG 和MEA 中CO2的溶解度顺序为1 mol/L MEA+ 1.5 mol/L SG >1.5 mol/L MEA+1 mol/L SG >2 mol/L MEA+0.5 mol/L SG >0.5 mol/L MEA+2 mol/L SG >MEA。他们的研究展示了伯胺和SG 复配溶液中浓度的影响,但是只局限于单纯的SG对于MEA和组分浓度对溶解度的影响,所研究的CO2分压很低,对实际应用没有多少参考价值。Khalid Osman 等[7]研究了不同质量分数下N-甲基二乙醇胺(MDEA)和二乙醇胺(DEA)复配溶液中CO2溶解度的规律并进行了建模,同时与其它文献作了比较,但是研究内容都局限于MDEA 和DEA 中浓度对于溶解度的影响。Danielle Bonenfant 等[8]研究了N-(2-羟乙基)乙二胺(AEE)和MDEA 复配溶液的吸收和解吸能力,得到了MDEA 和AEE 复配溶液中CO2的动态吸收负荷,但是没有得到其中CO2的平衡溶解度数据。陆诗建等[9]研究了二乙烯三胺(DETA)对于MEA 吸收CO2的影响规律,文中有涉及CO2的动态吸收负荷,但没有测得DETA 对于醇胺溶液中CO2平衡溶解度影响规律的数据。综上所述,以上学者分别对DETA、SG、AEE 和MDEA 与另外一种伯(仲)胺的溶解度影响规律有了研究,但是都没有纵向的研究比较,没办法直观地比较烯胺、叔胺、氨基酸盐等对伯(仲)胺中CO2平衡溶解度的影响,对工程上选取合适的脱碳剂没有给出实用直观的参考。因此,本文作者选取DEA 为基础吸收剂,研究在DEA 溶液中分别添加DETA、AEE、SG 和MEDA 后,对溶液中CO2的溶解度影响,探寻DETA、AEE、SG和MEDA 对CO2平衡溶解度的影响规律,为工程选用适当的吸收剂提供参考。
1 实验部分
1.1 实验原理
有机胺水溶液是广泛用于分离CO2等酸性气体的吸收剂,以其可再生、反复利用、除尽率高的特点逐渐成为了天然气、合成气进化过程中的首选脱碳剂。其原理是利用气相组分在液相溶液中溶解度的不同从而将气体混合物分离。虽然不同有机胺溶液吸收CO2的原理相似,但是不同有机胺溶剂与CO2的反应却有着各自的特点。DEA 与CO2的反应过程较为复杂,目前公认的是DEA 与CO2的两性离子机制,生成稳定的氨基甲酸盐,其反应过程简述如式(1)[10]。

上述总反应其实可以分为如式(2)~式(4)3个步骤。
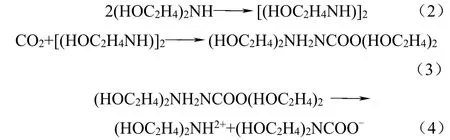
DEA 与CO2的反应速率虽然没有MEA 高,但是其腐蚀性较MEA 小[11],而且蒸气压低,对于设备的损耗较小。将添加剂加入DEA 水溶液之后,由于会产生复杂的交互作用,目前学者们对复合溶液中所进行的复杂反应还没有统一的结论。
1.2 实验装置
为测定多元复配醇胺溶液中CO2的溶解度,设计了如图1 所示的装置,其中反应器外包有加热套并与温控装置相连,温度传感器采用Pt100 热电阻,反应罐内液体温度变化±0.1 ℃。电子天平采用赛多利斯科学仪器(北京)有限公司,精度0.001 g。

图1 实验装置示意图
硫酸、MDEA、DETA、AEE、SG,分析纯,国药集团化学试剂有限公司; MEA、DEA,分析纯,西陇化工有限公司。所有溶液配制都采用去离子水。
1.3 实验概述
在实验过程中,首先将配制好的溶液装入反应罐,关闭所有阀门,将温度控制到实验所需的温度,记录此时的压力P0。其次,将高纯CO2通入反应罐,等待3~4 h,使反应罐中气液达到平衡,记录此时的反应罐压力P1。然后,测量硫酸瓶的质量,记作m0,打开出液阀放出2~3 g 液体至硫酸瓶,关闭出液阀,同时用皂泡流量计测量释放出的CO2体积,记作V。最后,待硫酸瓶中反应不再进行,没有气体释放出来时,称量硫酸瓶的质量,记作m1。重复上述操作,直至得到所需的压力范围内的数据为止。
实验对液样分析的方式采用酸解法。其原理是采用过量2.5 mol/L 硫酸与液样反应,解吸出液样中的CO2,然后测定解吸出的全部CO2体积,推知已知质量的液样中CO2的含有量。为了使CO2完全解吸,用磁力搅拌器对盛有稀硫酸的硫酸瓶进行搅拌以减少误差。
从实验中得到反应时CO2分压力为P1-P0,取得的液样质量为m1-m0,由已知的初始溶液浓度和所测得的CO2体积V,得到溶液中用mol CO2(mol醇胺)所表示的溶解度。
为检验实验装置的可靠性,特测定了质量分数为15.3%的MEA 水溶液在40 ℃时的溶解度数据,并与文献[12-13]中的数据作比较,其结果如图2 所示。
对实验得到的数据进行拟合,得到lnP 与溶解度a 的关系式,如式(5)。

式(5)中P 是CO2分压,a 是mol CO2(mol MEA)形式下的溶解度。从图2 中通过比较发现,数据与文献当中的数据能够良好地符合,证明本文的实验装置所测得的实验数据是可信的。
2 实验结果与讨论
2.1 温度对水溶液中二氧化碳溶解度的影响
为了能够对添加剂的影响有个直观的对比,首先测定了浓度为2 mol/L 的DEA 水溶液中CO2溶解度作为参照数据,实验温度分别为308 K、318 K、328 K、358 K,其结果如图3 示。

图2 15.3%MEA 溶解度曲线
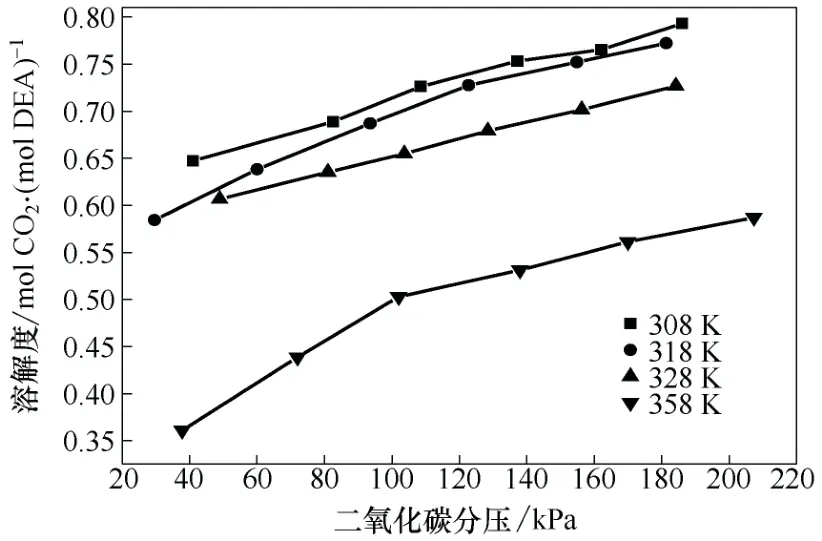
图3 2 mol/L DEA 溶液中二氧化碳的溶解度曲线
从图3 中可知,一方面CO2分压对其溶解度有着影响。CO2在DEA 水溶液中的溶解度随着CO2分压的增大而增大,其变化规律接近线性变化,几条曲线的变化趋势基本一致。可以看出,在相同的温度条件以及实验进行的压力段下,分压力的增大对CO2在DEA 水溶液中溶解度的影响较小,这是因为反应是在溶液中进行,虽然CO2分压力的增大可以相对地提高溶液中反应物的浓度,但是,对于在溶液中进行的反应,气体分压力的变化显然影响有限,无法较大程度地改变反应的进程。另一方面,温度变化对其溶解度也存在着影响。从图3 中可以看出,随着温度的增大,溶解度逐渐减小。在温度较低,即温度达到308 K 和318 K 的时候,CO2的溶解度相差不大,都在0.7 mol/mol 左右,这是因为DEA 吸收CO2的方式是化学反应,在此温度段,温度虽然对溶液中进行的可逆反应进程有影响,使得正逆反应速率都改变,但是总体效果不能使溶解度特性表现出很显著的变化。当温度达到358 K 时,低CO2分压的水溶液中,CO2的溶解度已经很小。这是因为在这个温度段,逆反应速率的增大已经明显超过生成氨基甲酸盐的正反应,大到足够影响反应整体偏向逆反应的方向进行,使得溶解度减小,因此,温度对实验CO2分压力下溶解度的影响变得十分显著。此外,在设计脱碳工艺的时候,主要考虑的应该是解吸温度,而吸收温度的降低,对溶解度的影响相对不太明显。
2.2 添加剂对DEA 水溶液影响实验
本组实验选择了DETA、AEE、SG 以及MDEA作为添加剂,用以验证添加剂的对CO2溶解度特性影响的规律。其中,添加剂与DEA 的物质的量之比都为1∶3,并且将有机胺的总浓度控制在2 mol/L,从而能够与2 mol/L 的DEA 水溶液得到的结果进行对比,得到具有说服力的结论。同样,实验选取的实验温度也分别为308 K、318 K、328 K、358 K,其结果如图4~图7 所示。
从图4、图6、图7 中可以看出,添加了几种添加剂后,溶解度曲线位置虽然不同,但是总体趋势相似,这与DEA 水溶液的表现一致。添加剂的加入产生的交互作用并没有改变CO2在水溶液中溶解度的基本规律,都是溶解度随CO2分压的升高而逐渐增大,即压力可以在一定程度上影响吸收反应的进行。纵观图4、图6、图7 可知,溶解度的值随温度的升高逐渐减小,并且,其减小趋势明显,在达到358 K 的时候,各种溶液的溶解度都已经相对很小,说明温度是另一个对吸收反应有着显著影响的条件。
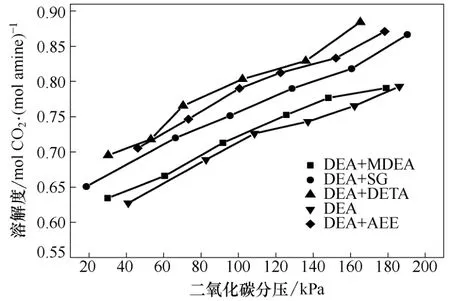
图4 35 ℃时各溶液的CO2 溶解度曲线

图5 45 ℃时二氧化碳在各溶液中的溶解度曲线

图6 55 ℃时二氧化碳在各溶液中的溶解度曲线

图7 85 ℃时二氧化碳在各溶液中的溶解度曲线
在添加了DETA 之后,相比于纯DEA 水溶液,溶解度提高幅度明显,在各种添加剂中改变量最大,可见DETA 对DEA 的溶解度影响最大。这是由于DETA 是烯胺,其分子结构中含有两个伯胺基和一个仲胺基,而DEA 结构中只含有一个仲胺基,DETA含有碱性更强一些的伯氨基并且含有更多的胺基氮原子,碱性强于DEA,其反应比MEA 都要迅速。所以,CO2首先与DETA 完成反应,然后才与DEA进行反应,由于DETA 分子中所含有的胺基数多,相比于单纯的DEA,其理论上的吸收容量就会高出很多,理论上1 mol DETA 会吸收1.5 mol 的CO2,理论上是DEA 的3 倍,虽然二者的混合会产生一定的交互作用[14-15],但是无法改变使得溶解度增大的总体效果。从结果来看,DETA 相比于其它添加剂,对DEA 水溶液的影响最为显著。DETA 吸收CO2的溶解度曲线是一簇随着分压力增大逐渐增高的曲线,分压力对整个复杂的吸收反应有影响,随着CO2分压的增大,溶解于水中的CO2浓度也增大,增加了溶液中反应的反应物浓度,促进了反应向着生成氨基甲酸盐的方向进行,使单位溶液吸收了相对更多的CO2,得到了随着分压逐渐增大的溶解度曲线。由于DETA 的碱性明显强于DEA,溶液中CO2首先与DETA 反应,然后再与DEA 反应,溶解度曲线并不是一条随着压力增大的线性曲线,有着明显的弧度。同时,对于温度的影响,DETA 也有着与其它几种溶液相似的表现,随着温度的升高,溶解度减小,但是可以比较发现,相对于其它几种吸收剂,添加了DETA 的溶液的溶解度变化相对较小,也就是说,DETA 与CO2的反应在实验所进行的温度范围内,其逆向反应的变化相对于生成氨基甲酸盐的正向反应来说不如其它几种溶液显著。
相比于DETA 而言,AEE 对于DEA 水溶液CO2溶解度的影响稍弱一些,但是可以从图中看出,AEE相比于SG 和MDEA 来说,作用是非常明显的。相比于纯的DEA 水溶液,其溶解度更是明显增大。AEE 分子结构中含有一个伯胺氮原子和一个叔胺氮原子,其碱性强于DEA,其CO2负荷也远远高于MEA、MDEA 以及三乙醇胺。与单纯DEA 水溶液相比,添加AEE 对其溶解度的影响很大,但是,很显然的是,每个AEE 中比DETA 少一个胺基,其对CO2的溶解度理论上要少于DETA,而实验结果很好地符合了理论的推理。另外,图5 显示了318K 时DEA+AEE 和DEA+MDEA 以及DEA 水溶液的溶解度结果比较,图中明显地显示了AEE 对DEA 水溶液CO2溶解度的影响远远大于相同实验压力条件下,同温度、同物质的量浓度的MDEA 对DEA 溶液的影响,这是因为虽然AEE 与MDEA 都含有叔胺氮原子,但是AEE 与CO2的反应不是单纯地依靠促进CO2的水解反应而实现的,其中还有一定的直接化学反应;而MDEA 则不同,它只是单纯的水解作用促进了碳酸的水解,从而实现了CO2的吸收。因此,可以得到结论,在低压阶段,压力对双水解反应的影响比生成氨基甲酸盐的反应更大。
在本研究中所涉及的几种添加剂中,SG 对DEA 水溶液CO2溶解度的改变效果相对不太显著,在实验条件下,只比MDEA 效果稍微好一点,远不如DETA 和AEE。这是因为SG 分子结构中只含有一个伯氨基氮原子,无法与DETA 和AEE 相比,理论上就比上述两种物质所能吸收的CO2量少,因此,只能对溶液中CO2的溶解度有较小的影响。而相比与MDEA,其影响作用又稍微强一些,因为其与CO2的反应并不是单纯的水解双促进,压力对其的影响相对于MDEA 来说稍微弱一些。
MDEA 是所选择的几种添加剂唯一的叔胺,也是表现最特殊的一组,虽然有高的CO2负荷,但是,在低压时无法表现出来,甚至其溶解度不如纯DEA水溶液,随着温度的升高更是如此,如图6、图7所示。但是,随着分压力的增大,其对CO2溶解度的影响也会加强,逐渐变得比DEA 水溶液大。这是由于MDEA 结构中只有叔胺基氮原子,吸收CO2主要是靠CO2(碳酸)的水解作用,MDEA 和CO2并不直接反应,只是MDEA 作为弱碱水解,促进了CO2(碳酸)的水解反应,从而增大了CO2在水中的溶解度;而DEA 吸收CO2主要是化学吸收,与CO2有着直接反应,并且其反应是在溶液中进行的,CO2分压力对DEA 水溶液的反应影响有限。然而,CO2分压力对CO2与水的反应影响巨大,较大的分压可以使水中CO2的浓度增大,增加反应物浓度,更有利于反应向着水解的方向进行,因此在相同的条件下,CO2分压力对于MDEA 吸收CO2的进程影响更加深远。在本实验所进行的条件下,体系无论总压力还是CO2分压力都较低,对CO2的水解反应影响不是很大,从而使得温度成为了主导因素,而随着温度的升高,水解反应的逆反应速率增大的更为显著,进而导致了CO2溶解度的降低。
也就是说,MDEA 优良的吸收负荷性能无法表现出来。综上所述,只有对整个体系施加较高的CO2分压力,才会表现出MDEA 高吸收负荷的特性;同时,温度对其影响是很大的,MDEA 的吸收性能在高温区相对减弱得更多,需要对MDEA 溶液有着较高的CO2分压力和较低温度,才能发挥其溶解度优势。
3 结 论
(1)虽然压力和温度对DEA 水溶液中CO2的溶解度都有影响,但在实验条件范围内,温度能够不同程度地影响正逆反应速率,其影响更为显著,CO2分压力影响较弱。
(2)在DEA 溶液中分别添加DETA、AEE、SG 和MDEA 后,各种添加物对CO2的溶解度的影响顺序是:DETA>AEE>SG>MDEA。
(3)在实验条件下,对DEA 水溶液来说,CO2溶解度随着添加剂中胺基数量的增加而增加。
(4)依靠CO2水解反应吸收的MDEA 对溶液溶解度的影响最小,其吸收负荷大的优势无法发挥,需要对其施加较大的压力。同时,温度的变化对低压时水解反应的影响巨大,要使类似MDEA 的吸收剂更好地发挥溶解度优势,需要提供较低的吸收温度。
[1] 顾和军,曹杰. 人类活动影响二氧化碳排放研究进展[J]. 阅江学刊,2010,2(1):48-54.
[2] 魏伟,孙予罕,闻霞,等. 二氧化碳资源化利用的机遇与挑战[J]. 化工进展,2011,30(1):216-224.
[3] 沈满洪,吴文博,魏楚,等. 近二十年低碳经济研究进展及未来趋势[J]. 浙江大学学报:人文社会科学版,2011,41(3):28-39.
[4] 陆文龙. 二氧化碳的捕集技术研究进展[C]//第十届中国科协年会——二氧化碳减排和绿色化利用与发展研讨会论文集,2008:288-291.
[5] 李培源,苏炜,霍丽妮,等. 二氧化碳分离捕集技术研究进展[C]//2009 全国功能材料科技与产业高层论坛论文集,2009:775-777.
[6] Saeed Mazinani,Aria Samsami,Abdolhossein Jahanmiri.Solubility(at low partial pressures),density,viscosity,and corrosion rate of carbon dioxide in blend solutions of monoethanolamine(MEA) and sodium glycinate (SG)[J]. J. Chem. Eng. Data,2011,56(7):3163-3168
[7] Khalid Osman ,Christophe Coquelet ,Deresh Ramjugernath.Absorption data and modeling of carbon dioxide in aqueous blends of bis(2-hydroxyethyl)methylamine (MDEA) and 2,2-iminodiethanol(DEA):25%MDEA+25%DEA and 30%MDEA+20%DEA[J].J.Chem.Eng.Data,2012,57(5):1607-1620.
[8] Danielle Bonenfant,Murielle Mimeault,Robert Hausler.Comparative analysis of the carbon dioxide absorption and recuperation capacities in aqueous 2-(2-aminoethylamino)ethanol(AEE)and blends of aqueous AEE and N-methyldiethanolamine solutions[J]. J. Ind. Eng.Chem.Res.,2005,44(10):3720-3725
[9] 陆诗建,刘晓东,李清方,等.MEA-DETA 混合胺溶液吸收烟气中二氧化碳的研究[J]. 武汉工程大学学报,2010,32(9):1-5.
[10] 陆诗建,李清方,张建,等. 醇胺溶液吸收二氧化碳方法及反应原理概述[J]. 科技创新导报,2009(13):4-5,7.
[11] 张小刚,张向涛,华锦贵,等. 燃煤电厂烟气CO2捕集系统腐蚀原因及防护措施[J]. 热力发电,2011,40(12):98-100.
[12] Shen Keh-Peng,Li Meng-Hui. Solubility of carbon dioxide in aqueous mixtures of monoethanolamine with methyldiethanolamine[J].J.Chem.Eng.Data,1992,37,100-104.
[13] Jones J H,Froning H R,Claytor E R Jr.Solubility of acidic gases in agueous monoethanolamine[J].J.Chem.Eng.Data,1959,4:85-92.
[14] 刘晓东,陆诗建,袁琴,等.MEA-TETA 二元复配溶液吸收烟气中CO2的实验研究[J]. 化学与生物工程,2010,27(8):28-32.
[15] 费祥,王婷芳,蔡晓彤,等.MEA-TETA 复配醇胺水溶液吸收二氧化碳的实验研究[J]. 广州化工,2011,39(10):88-90.

