大鼠骨髓间质干细胞多向分化研究
王宾,沈来根,葛敦钧,程云霄,朱越锋,李鲁滨,胡邓迪,金晔
(1.东阳市人民医院 肝胆外科,浙江 金华 322100;2.浙江大学医学院附属邵逸夫医院 普外科,浙江 杭州 310016)
骨髓间质干细胞(bone marrow mesenchymal stem cells,BMSCs)是成体干细胞中最易获得的干细胞之一,具有多向分化潜能,并且采集方便,容易培养,增殖能力强,性质稳定,是目前较为理想的基础研究和临床治疗靶细胞。特别是近年来发现间质干细胞(marrow mesenchymal stem cells,MSCs)具有“跨胚层”分化的潜能,掀起了MSCs研究和应用的高潮[1]。本研究探讨体外不同方法诱导MSCs向多个胚层细胞分化的能力,证实MSCs多向分化潜能特性,为细胞治疗及组织工程的研究奠定基础。
1 材料和方法
1.1 材料 清洁级SD大鼠10只,体质量80~100 g,平均(130±20)g(上海斯莱克实验动物中心),兔抗大鼠CD44(白细胞共同抗原)抗体、兔抗大鼠CD45(白细胞共同抗原)抗体、兔抗大鼠CD90(白细胞共同抗原)抗体(sigma公司),荧光倒置相差显微镜(PUSIX-70型,Olympus公司),Beckmancounter Epics XL流式细胞仪(美国BD公司)。
1.2 大鼠BMSCs的分离和培养 通过机构的动物实验伦理委员会的批准,4周龄SD大鼠被安置在医院的实验动物中心接受标准的饮食,健康SD大鼠麻醉处死后提取股骨和胫骨骨髓腔中的DMEM(dubellco modified eagle medium)LG冲洗液,细胞重悬液被转移到75 cm2的组织培养瓶在含10% FCS(fetal calf serum)DMEM培养基中进行MSCs的体外贴壁培养增殖,培养在37 ℃、5% CO2的环境中。培养4 d后半数换液,继续培养3 d后全部换液。5~7 d后传代。7代以内的MSCs应用于实验研究。
1.3 BMSCs的分子表面标记 细胞表面标记的流式细胞仪鉴定:收集培养的第3代MSCs,PBS洗涤3次,分别加入CD44、CD45和CD90单克隆抗体,工作浓度为1:100,4 ℃孵育30 min后,再用PBS洗涤3次,加异硫氰酸荧光素(FITC)标记的二抗,工作浓度1:100,4 ℃孵育30 min,PBS洗涤3次,用流式细胞仪进行检测。同时用PBS代替一抗作空白对照。
1.4 BMSCs的诱导分化 我们采用不同诱导条件,分别进行了向成骨细胞、成软骨细胞、脂肪细胞及肝脏细胞分化,各组均设对照组:单用FBS培养MSCs。
1.4.1 向成骨细胞诱导分化:第4代BMSCs用成骨诱导培养基(含10-7mol/L地塞米松、50 mg/L VitC、DMEM-F12、10 mmol/Lβ-甘油磷酸钠、体积分数10%的胎牛血清)培养4周,以茜素红染色方法检测钙结节。
1.4.2 向成软骨细胞诱导分化:第4代BMSCs用成软骨诱导培养基(含10-7mol/L地塞米松、50 mg/L VitC、IMDM-F12、110μg/L TGF-β、体积分数10%的胎牛血清)培养4周,以甲苯胺蓝染色法检测的糖胺表达。
1.4.3 向脂肪细胞诱导分化:第4代BMSCs用成脂肪诱导培养基(含10-6mol/L地塞米松、10 mg/L胰岛素、DMEM-HG、0.5μmol/L异丁基甲基嘌呤、体积分数10%的胎牛血清)培养4周,以油红O染色法检测脂质空泡。
1.4.4 向肝细胞诱导分化:第4代BMSCs用成肝诱导培养基(体积分数10%的胎牛血清、20 ng/mL HGF、20 ng/mL a-FGF)培养4周,以过碘酸-雪夫反应检测糖原。
2 结果
2.1 BMSCs的形态学观察 贴壁的BMSCs呈集落生长,呈现梭形的贴壁细胞特征,见图1。
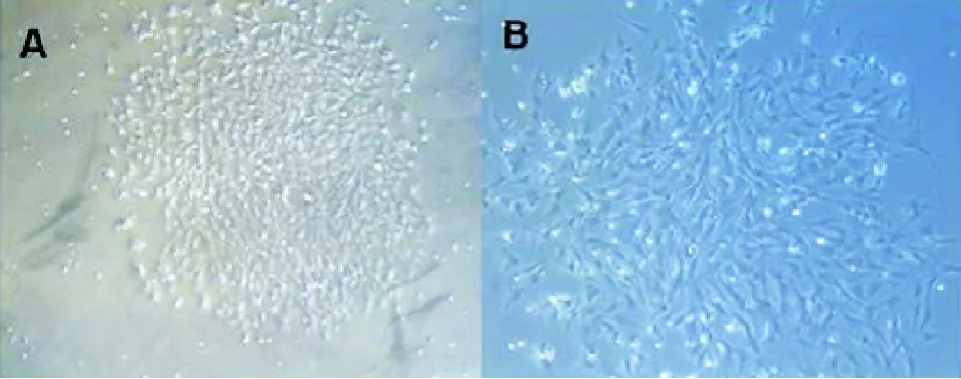
图1 贴壁培养的大鼠BMSCs克隆(A:×50;B:×100)
2.2 MSCs的分子表面标记和分化鉴定 流式细胞仪检测结果显示:CD44染色的阳性率为84.63%,CD90染色的阳性率为75.48%,CD45染色的阳性率为0.25%。CD44和CD90染色均为阳性,而CD45染色为阴性,符合文献报道MSCs的分子表面标记结果。
2.3 BMSCs的定向诱导分化 BMSCs向成骨细胞、成软骨细胞、脂肪细胞及肝细胞诱导分化成功,4周后各组均呈现特异性异型细胞,对照组细胞未见异型细胞,见图2。
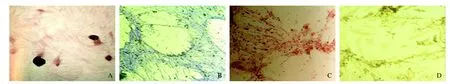
图2 BMSCs多向诱导分化
3 讨论
MSCs不仅有向中胚层细胞定向分化的能力,而且在特定的诱导条件下,还可以向外胚层细胞分化。已经有研究表明人BMSCs可以在体外向肝样细胞诱导分化[2],MSCs移植在大鼠心梗模型中能有效促进新生血管的生成[3]。目前分离MSCs的方法有全骨髓直接培养法、密度梯度离心法、流式细胞仪分选法、免疫磁珠分离法等[4-5]。我们通过贴壁细胞分离法,反复换液和传代,逐渐纯化细胞,获得了细胞形态趋于一致、胞体饱满、以梭形为主、增殖迅速的干细胞作为实验细胞。我们认为贴壁细胞分离法相对于其他MSCs的分离方法来说更加经济简单,有较高的应用价值。
MSCs表面标志物具有非单一性的特性,它表达间质细胞、内皮细胞和表皮细胞的表面标志物,不表达造血细胞表面抗原,如造血前体细胞标志抗原CD34,泛白细胞标志抗原CD45等。本实验采用目前国际、国内常用的鉴别MSCs的表面标志CD44、CD45和CD90进行流式细胞仪检测,结果显示CD44和CD90染色均为阳性,而CD45染色为阴性。
本实验成功地将大鼠BMSCs向成骨细胞、成软骨细胞、脂肪细胞及肝细胞诱导分化成功,表明MSCs具有多向分化潜能,这种潜能需要在特定诱导培养基诱导下才能实现。MSCs本身就存在着具有不同分化潜能的细胞群,它们在适合的条件下将向自身的潜能分化。MSCs取材方便,扩增迅速,具有多向分化潜能,易于自体获得,回植后无免疫排斥反应,并易于在体外分离培养和扩增,已在细胞移植、组织工程、基因治疗等方面广泛应用[6]。
[1] Trivedi HL, Vanikar AV, Thakker U, et al. Human adipose tissue-derived mesenchymal stem cells combined with hematopoietic stem cell transplantation synthesize insulin[J].Transplant Proc, 2008, 40(4):1135-1139.
[2] 马兆文, 吴炜, 陈瑜. 人骨髓间充质干细胞体外向肝样细胞的诱导分化[J]. 温州医学院学报, 2009, 39(50):418-425.
[3] 吴原波, 尹琪, 金培峰, 等. SDF-1α在体内对骨髓间充质干细胞的保护作用及其对缺血心脏修复的影响化[J]. 温州医学院学报, 2011, 41(2):136-145.
[4] de Mattos Carvalho A, Aires AL, Golim MA,et al.Isolation and immunophenotypic characterization of mesenchymal stem cells derived from equine species adipose tissue[J]. Vet Immunol Immunopathol, 2009, 132(2-4):303-306.
[5] Kode JA, Mukheqee S, Joglekar MV, et a1. Mesenchymal stem cells: immunobielogy and role in immunomodulation and tissue regeneration[J]. Cytotherapy, 2009, 11(4):377-391.
[6] Baksh D, Yao R, Tuan RS. comparison of proliferative and multilineage differentiation potential of human mesenchymal stem cells derived from umbilical cord and bone marrow[J]. Stem Cells, 2007, 25(6):1384-1392.

