系统性红斑狼疮患者外周血B淋巴细胞中狼疮活动相关miRNA的筛选
陈芳,陈朝生,章慧娣,薛向阳,丁晓凯,孙莉,陈丹,黄朝兴
(温州医学院,浙江 温州 325000,1.附属第一医院 肾内科;2.微生物学与免疫学教研室;3.附属第一医院 风湿科)
microRNA(miRNA)是一类广泛存在于生物体内由约22个碱基组成的内源性非编码RNA分子,在转录后水平通过与mRNA上靶基因的互补配对而对其表达进行负调控,导致靶基因翻译抑制或降解[1],最终影响分子信息通路及细胞表面膜分子的表达等生物学作用。已有文献[2-4]报道miRNA在免疫细胞的分化发育、免疫应答调控、免疫系统疾病的发生发展等过程中发挥重要作用。而系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种较为常见的自身免疫性疾病,异常B淋巴细胞产生自身抗体为该病发病的关键,但尚鲜有文献直接关注到miRNA与SLE患者外周血B淋巴细胞异常相关的研究。本研究首次在重度活动期狼疮患者外周血B淋巴细胞中筛选与狼疮活动相关的miRNA,从miRNA角度对B淋巴细胞参与SLE发病的机制进行探索。
1 材料和方法
1.1 一般资料 选取2011年2-12月本院门诊及住院的SLE患者66例,均符合1997年美国风湿病学会修定的SLE诊断标准,按SLE疾病活动指数(SLEDAI评分)分为:稳定期组(SLEDAI≤4分)20例,男1例,女19例,年龄28~52岁,平均(39.75±10)岁,其中曾用激素(甲强龙500 mg,连用3 d)冲击治疗2例,甲强龙80~160 mg 4例,40~79 mg 10例,<40 mg 4例;重度活动期组(SLEDAI≥15分)46例,男3例,女43例,年龄23~50岁,平均(36.8±13)岁,其中曾用激素(甲强龙500 mg,连用3 d)冲击治疗4例,甲强龙80~160 mg 6例,40~79 mg 25例,<40 mg 11例;合用免疫抑制剂或雷公藤治疗29例;健康对照组10例,男1例,女9例,年龄26~50岁,平均(38±12)岁。所有研究对象均对相关研究知情同意。
1.2 主要仪器和试剂 抗体(Biotinylated Human B Lymphocyte Enrichment Cocktail,5.0 mL)、磁珠(Streptavidin Particles Plus-DM,5.0 mL)、10×buffer 100 mL(BD公司),磁体(BD IMagnetTM),分选管(BD FalconTM),流式细胞仪(FC500 Beckman);trizol(Invitrogen公司),全自动酶标仪(ELX800,宝特公司),电泳仪(biorad美国);逆转录试剂盒ReverTra Ace qPCR RT Kit、实时荧光定量PCR试剂盒SYBR Green Realtime PCR Master Mix Plus(TOYOBO公司),miRNA引物(Invitrogen公司),7500 Realtime PCR仪(美国ABI公司)。
1.3 方法
1.3.1 分离外周血中B淋巴细胞:采集所有研究对象外周静脉血5 mL,EDTA抗凝,1500 r/min离心10 min,去上清后加入1640培养基稀释至10 mL混匀,采用密度梯度离心分离法,分离外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),收集的PBMCs用2 mL红细胞裂解液裂解残留红细胞,再用0.9%氯化钠溶液洗涤两次。按磁珠法阴性分选CD19+B细胞:用无菌蒸馏水将10×buffer稀释为1×;在所得PBMCs中加入1×buffer 0.1 mL,用细胞计数板在光学显微镜下计数,用1×buffer将细胞浓度调至10×106个/mL,按BD公司产品说明书步骤操作,所得的B细胞经流式细胞仪验证纯度。
1.3.2 提取B细胞总RNA:收集的B淋巴细胞,1000 r/min离心7 min,弃去上清液,再在离心管中加入1 mL trizol。根据trizol Regent的操作步骤提取单个样本总RNA。将每组中单个样本所提的RNA均混成一份组总RNA,应用全自动酶标仪测定其浓度及纯度,电泳仪检测其完整性。将各组剩余总RNA分成两部分,一部分用于芯片分析,另一部分用于验证芯片分析结果。
1.3.3 芯片分析:选用Affymetrix microRNA 2.0 Array芯片,该芯片采用了Sanger miRBase 15.0版序列,探针长度25个碱基,设计覆盖了20162条miRNA。利用Poly(A)聚合酶给miRNA样品加Poly(A)尾,按Flash Tag Biotin HSR Ligation标记试剂盒的说明进行miRNA荧光标记和纯化。按照说明配置杂交液,将孵育好的杂交液注入芯片中,加样口用贴纸封住;然后将芯片放在杂交炉里,48 ℃60 r/min杂交16 h。杂交结束后,用枪头吸掉杂交液,洗脱后扫描,将图像转化为基于荧光强度的数字信号(Affymetrix 7G/TG Scanner),随后进行数据分析和处理。
1.3.4 Realtime PCR法验证芯片结果:从芯片结果中随机挑出差异有统计学意义的2条miRNA(hasmiR-181a、hsa-miR-103),运用Realtime PCR技术检测其在芯片分析各组样本中的表达情况,验证芯片分析结果的可靠性。
1.3.4.1 miRNA特异性茎环引物逆转录反应:dNTP(2.5 mmol/L)1μL,5×RT Buffer 4μL,miRNART茎环引物(1μmmol/L,序列见表1)2μL,总miRNA 4μg,Reverse transcriptase MMLV反转录酶(10 U/μL)0.5μL,RNase Inhibitor RNA酶抑制剂(40 U/μL)0.5μL,Nuclease-free Water无RNA酶水补齐20μL。16 ℃ 30 min,42 ℃ 30 min,70 ℃ 10 min在PCR扩增仪进行RT反应。
1.3.4.2 Realtime PCR:按TOYOBO SYBR Green Realtime PCR Master Mix Plus说明书,将 miRNA特异性上下游引物特异性正、反向引物(见表1)加入反应体系。将上述PCR反应溶液置于7500 Realtime PCR仪上两步法[95 ℃,10 min;40个PCR循环(95 ℃,15 s;60 ℃,1 min)]进行相对定量PCR反应。
1.4 统计学处理方法 采用SPSS15.0软件进行统计学分析,数据比较采用单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 流式细胞仪分析磁珠分选的B细胞 分离前PBMC中B细胞所占比例为3.47%~9.12%,经磁珠法阴性分选得到的B细胞,平均纯度约为96%(见图1)。
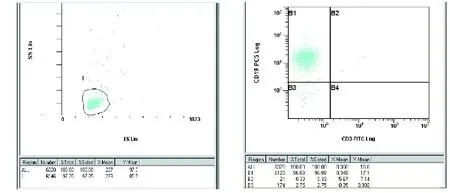
图1 流式细胞仪示磁珠分选后细胞(左:分离后的淋巴细胞;右:B细胞在分选后淋巴细胞的比例)
2.2 每组所提总RNA的浓度、纯度及完整性 分光光度计测定每组总RNA的浓度符合要求,OD260/280值在1.9~2.1之间。从每组总RNA各吸取约500 ng的RNA,用1.5%的甲醛变性凝胶电泳(120 V)15 min,在凝胶成像仪(JS-380A)上可检测到每组总RNA中完整的5 s、28 s和18 s条带。
2.3 miRNA在SLE重度活动期组、SLE稳定期组及正常对照组中的差异表达 对比SLE重度活动期组和SLE稳定期组患者外周血B细胞中miRNA芯片表达谱,发现SLE重度活动组中存在70条差异有统计学意义的miRNA。从上述70条差异miRNA中挑出文献报道与B细胞增殖分化相关或满足以下两个条件者为最终实验结果:①其在SLE重度活动期组中表达与正常对照组相比,差异亦有统计学意义,且上调、下调趋势与上述结果平行(见表2);②其在SLE稳定期组与正常对照组间表达差异无统计学意义(见表2)。最终实验结果见表3。

图2 Realtime PCR溶解曲线(a)及扩增曲线(b)
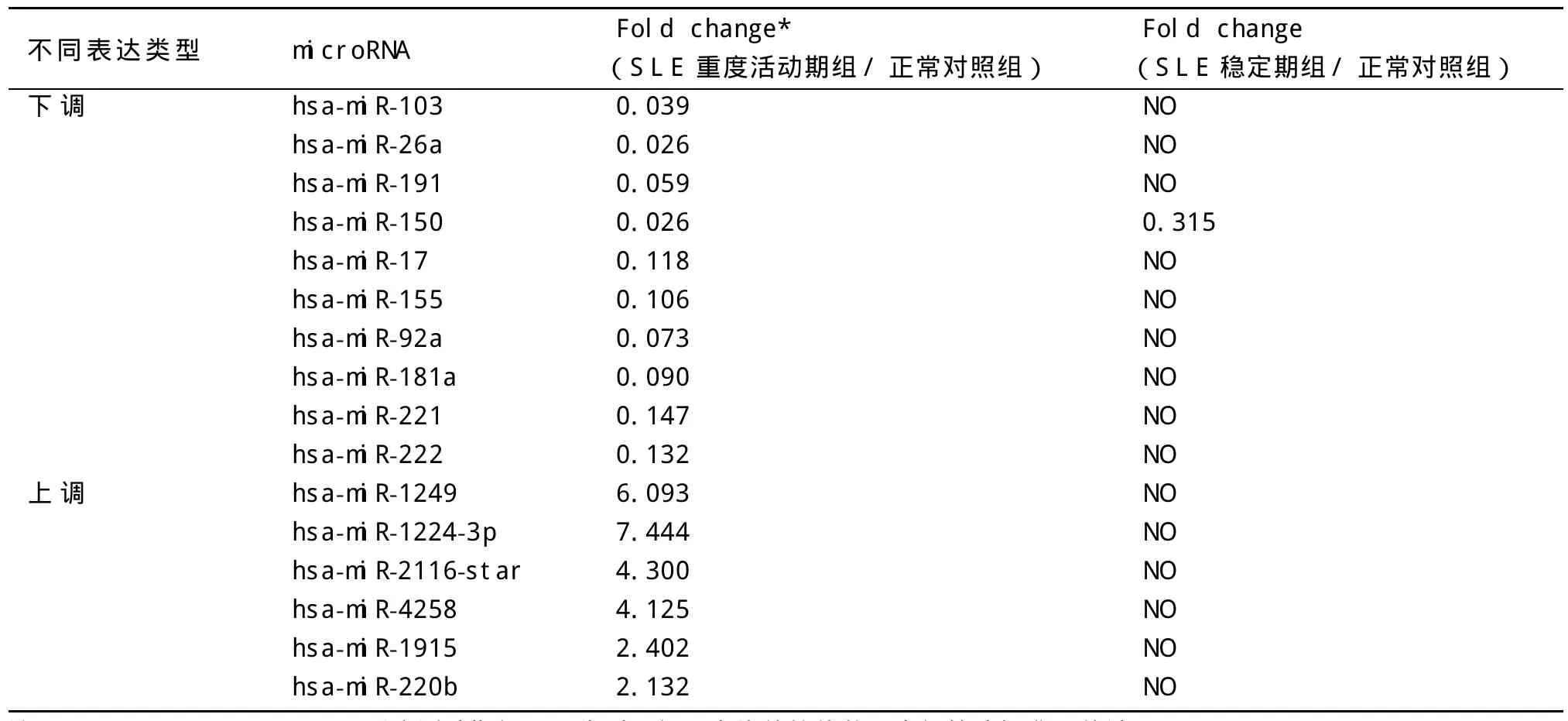
表2 SLE重度活动期组及稳定期组的外周血B淋巴细胞中miRNA较正常对照组的差异表达倍数
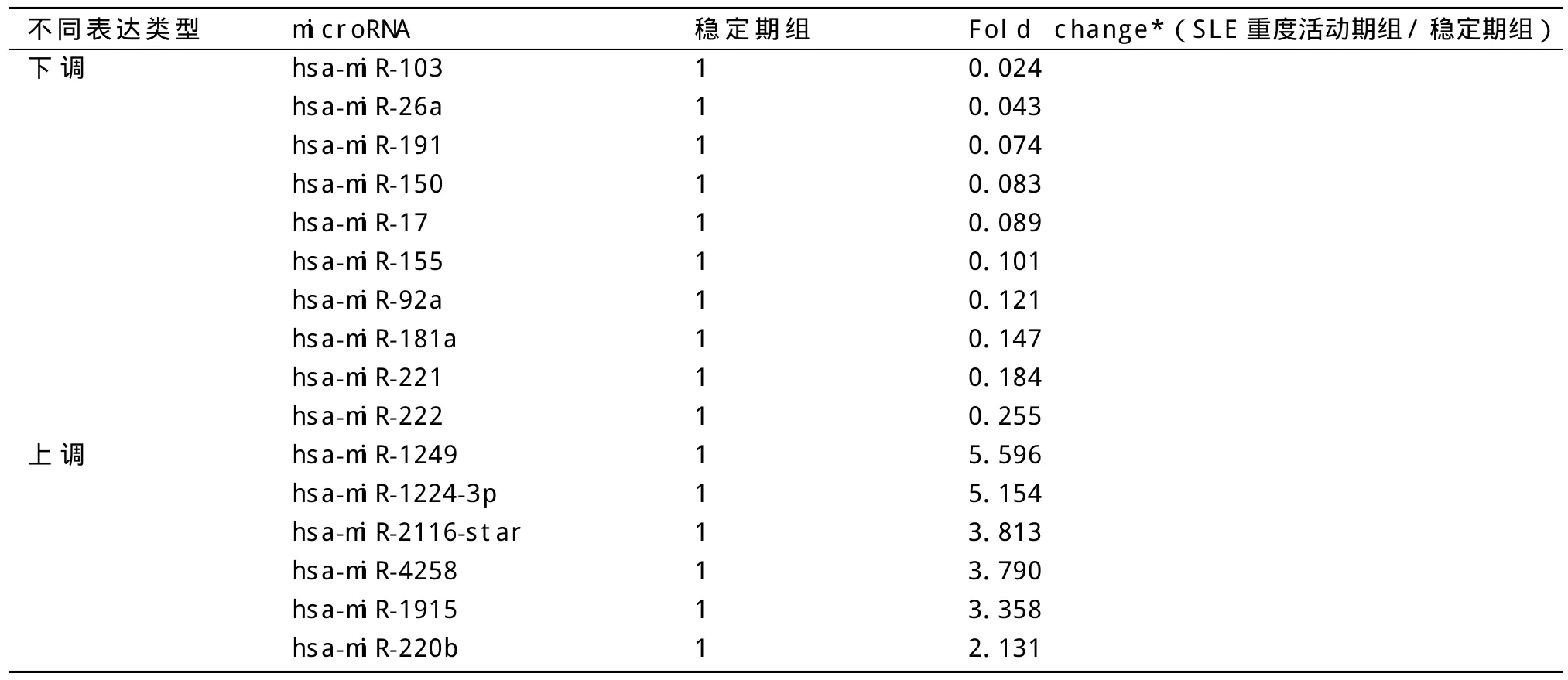
表3 SLE重度活动期组较稳定期组外周血B淋巴细胞中差异表达的miRNA
2.4 Realtime PCR结果 图2a示3条引物的熔解曲线呈单峰状,证实所用miRNA引物特异性高,无非特异性条带扩出;使用RNU6为内参,将扩增曲线(见图2b)转化成Ct值后用2-△△Ct法计算出相对定量结果,对两组进行统计分析。同样发现在SLE重度活动期组患者中has-miR-181a、hsa-miR-103表达水平明显低于SLE稳定期患者(P<0.05),与芯片分析结果近似。具体结果见图3。

图3 Realtime PCR示差异miRNA在SLE重度活动期组及SLE稳定期组的表达情况
3 讨论
SLE是一种以产生多种自身抗体为特征的自身免疫性疾病,临床表现多样,常涉及多种组织器官损害。病因仍不十分清楚,普遍认为由遗传、环境等多因素共同作用所致[5]。目前文献[6-10]报道miRNA与SLE的发病密切相关。Dai等[6]发现在SLE患者外周血中有7种miRNA表达水平较正常对照组明显降低,9种miRNA表达升高;对比II型狼疮肾炎(LN)组和正常对照组肾组织miRNA表达水平,发现在LN患者肾组织中30个miRNA表达明显下调,36个miRNAs表达显著上调[7]。Tang等[8]进一步研究证实SLE患者miR-146a表达水平下降,活动期患者下降更明显。miR-146a通过抑制I型IFN传导通路的关键蛋白以阻断该通路,表达下调将导致抑制作用减弱,且SLE亚洲患者miRNA-146a低表达与编码miRNA-146a的基因序列rs57095329上G等位点有关,该点与转录因子Ets-1亲和力下降,而Lfgren发现欧洲患者与单核多态(the single-nucleotide polymorphisms,SNPs)中rs2431697有关[9-10]。可见miRNA作为免疫系统精细的调节工具[11],SLE患者较正常对照组相比不同组织所表达的差异miRNA不同,不同人种患者所表达miRNA亦有差异。另有研究表明miRNA-21和miRNA-148a在CD4+ T细胞中高表达,直接或间接结合靶基因抑制甲基转移酶1表达,导致细胞低甲基化[12]。
本研究选取SLE重度活动期患者外周血B淋巴细胞为研究对象,SLE稳定期患者为对照,首次在SLE重度活动期狼疮患者外周血B淋巴细胞中筛选与狼疮活动相关的miRNA。实验通过将每组单个样本外周血B淋巴细胞中所提RNA混总进行组间芯片分析,以减少个体差异的影响;通过挑选的差异miRNA满足以下条件:在SLE重度活动期组与正常对照组间表达差异亦有统计学意义,而在SLE稳定期组与正常对照组间表达差异无统计学意义,以尽量减少激素及免疫抑制剂对结果的影响。实验最终筛选出16条与狼疮活动相关差异表达的miRNA,其中下调10条(miR-103、miR-26a、miR-191、miR-150、miR-17、miR-155、miR-92a、miR-181a、miR-221、miR-222),上调6条(miR-1249、miR-1224-3p、miR-2116-star、miR-4258、miR-1915、miR-220b)。对这些miRNA进一步的研究和分析,不仅将加深对其狼疮活动相关表达谱特征的认识,也将促进其在SLE活动及发病机制研究中应有价值的发挥。
在文献报道中上述16条差异表达miRNA除miR-181a、miR-1224-3P外,余14条在其与SLE相关性研究中尚少有涉及,而且下调的miR-181a和上调的miR-1224-3P在Te等[13]研究的EB病毒转染SLE患者与非SLE对照组B细胞株miRNA表达谱对比中,却分别表现为下调和上调,与本实验结果相反。分析原因可能为:①研究对象不同;②SLE患者外周血B淋巴细胞为多细胞因子等共同作用结果,不能等同于EB病毒转染的SLE患者B细胞;③部分实际存在差异表达的miRNA在尽量减少药物影响的前提下被剔除。
但本实验筛选出的差异miRNA(如miR-181a、miR-150、miR-155)在其他研究[14-18]中特别是B淋巴细胞增殖活化中起着重要的作用。miR-181a是最先发现具有调节免疫细胞发育功能的miRNA,在造血干细胞及祖细胞中过表达可导致B细胞数量显著上升而T细胞下降,提示miR-181a主要调节淋巴细胞的分化[14-15]。miR-155在T细胞及B细胞的活化中起着重要的调节作用,过表达将会产生淋巴系白血病或高度分化的淋巴瘤[16],基因敲除实验发现小鼠体内原始B细胞数目减少而成熟B细胞数量正常,但产生抗体能力明显降低。正常情况下,miR-150在祖细胞中不表达而仅存在于成熟淋巴细胞中[17],其通过靶向作用于转录因子c-Myb显著减少成熟淋巴细胞生成及增殖分化,敲除miR-150小鼠的B细胞拥有更高的抗体分泌能力,与本实验中miR-150在SLE重度活动期患者中低表达相一致。同时动物实验证实miR-150异常表达仅影响到B细胞,对T细胞没有影响[18]。提示SLE患者活动期B细胞异常分化产生自身免疫反应抗体,可能与这些miRNA下调有关。
综上所述,SLE患者病情活动性与B淋巴细胞中miRNA异常表达密切相关,我们将对芯片初筛结果进行单个样本验证,同时进一步研究相关差异miRNA的靶基因功能,从miRNA角度阐明B淋巴细胞参与SLE活动及发病的机制,为今后从miRNA角度寻找到治疗SLE特异性强而不良反应少的新型靶向药物奠定基础。
[1] Guarnieria DJ, DiLeone RJ. MicroRNAs: a new class of gene regulators[J]. Ann Med, 2008, 40(3):197-208.
[2] Xiao C, Calado DP, Galler G, et al. MiR-150 controls B cell differentiation by targeting the transcription factor c-Myb[J]. Cell, 2007, 131(1):146-159.
[3] Turner M, Vigorito E. Regulation of B-and T-cell differentiation by a single microRNA[J]. Biochem Soc Trans, 2008,36(Pt3):531-533.
[4] Tili E, Croce CM, Michaille JJ. miR-155: on the crosstalk between inflammation and cancer[J]. Int Rev Immunol,2009, 28(5):264-284.
[5] Alarcon-Segovia D. The pathogenesis of immune dysregulation in systemic lupus erythematosus. A troika[J]. J Rheumatol, 1984, 11(5):588-590.
[6] Dai Y, Huang YS, Tang M, et al. Microarray analysis of microRNA expression in peripheral blood cells of systemic upus erythematosus patients[J]. Lupus, 2007, 16(12):939-946.
[7] Dai Y, Sui W, Lan H, et al. Comprehensive analysis of microRNA expression patterns in renal biopsies of lupus nephritis patients[J]. Rheumatol Int, 2009, 29(7):749-754.
[8] Tang Y, Luo X, Cui H, et al. Micro-RNA-146A Contributes to Abnormal Activation of the Type I Interferon Pathway in Human Lupus by Targeting the Key Signaling Proteins[J].Arthritis Rheum, 2009, 60(4):1065-1075.
[9] Luo X, Yang W, Ye DQ, et al. A Functional variant in microRNA-146a promoter modulates its expression and confers disease risk for systemic lupus erythematosus[J].PLoS Genet, 2011, 7(6):e1002128.
[10]Lfgren SE, Frostegrd J, Truedsson L, et al. Genetic association of miRNA-146a with systemic lupus erythematosus in Europeans through decreased expression of the gene[J].Genes Immun, 2012, 13(3):268-274.
[11]Carissimi C, Fulci V, Macino G, et al. MicroRNAs: novel regulators of immunity[J]. Autoimmun Rev, 2009, 8(6):520-524.
[12]Pan W, Zhu S, Yuan M, et al. MicroRNA-21and microRNA-148a contribute to DNA hypomethylation in lupus CD4+ T cells by directly and indirectly targeting DNA methyltransferase 1[J]. J Immunol, 2010, 184(12):6773-6781.
[13]Te JL, Dozmorov IM, Guthridge JM, et al. Identification of unique microRNA signature associated with lupus nephritis[J]. PLoS One, 2010, 5(5):e10344.
[14]Chen CZ, Li L, Lodish HF, et al. MicroRNAs modulate hematopoietic lineage differentiation[J]. Science, 2004, 303(5654):83-86.
[15]Li QJ, chau J, Ebert PJ, et al. miR-181a is an intrinsic modulator of T cell sensitivity and selection[J]. Cell, 2007, 129(1):147-161.
[16]Costinean S, Zanesi N, Pekarsky Y, et al. Pre-B cell proliferation and lymphoblastic leukemia/high-grade lymphoma in E(mu)-miR155 transgenic mice[J]. Proc Natl Acad Sci USA, 2006, 103(18):7024-7029.
[17]Zhou X, Jeker LT, Fife BT, et al. Selective mRNA disruption in T reg cells leads to uncontrolled autoimmunity[J]. J Exp Med, 2008, 205(9):1983-1991.
[18]Lin YC, Kuo MW, Yu J, et al. cMyb is an evolutionary conserved miR150 target and miR150/cMyb in teraction is important for embryonic development[J]. Mol Biol Evol,2008, 25(10):2189-2198.

