双酚A对大鼠未成熟Leydig细胞类固醇代谢关键酶基因表达的影响
姬秀焕,鲍方,尹晓娜,陈玲,苏志涛,王蓉蓉,董磊,陈国荣,陈三妹
(1.温州医学院附属第一医院 病理科,浙江 温州 325000;2.绍兴文理学院 医学院,浙江 绍兴312000)
双酚A(bisphenol A,BPA)又称双酚基丙烷,为脂溶性小分子物质,其分子结构与自然界的雌二醇相似,是塑料工业生产碳酸聚酯、环氧树脂、聚苯乙烯树脂的前体物质,广泛用于食品包装材料、婴儿用品、牙科填充剂等塑料制品以及杀真菌剂、抗氧化剂、染料等高分子材料的生产过程中[1]。在职业生产和日常生活中,BPA可通过消化道、呼吸道、皮肤等多种途径与人体接触而进入体内,干扰机体的内分泌,产生不良影响。长期接触BPA可能导致与生殖和发育有关的病变,如生殖道损害、女性反复流产、早产儿增多[2]、前列腺增生、精子生成减少[3]等。
睾丸Leydig细胞是位于生精小管周围的睾丸间质细胞,合成和分泌重要的雄激素—睾酮。睾酮有影响胚胎分化、维持精子生成和正常性欲、刺激附属性器官生长发育等重要作用。大鼠出生21~35 d期间生殖管道开始发育、性腺开始分化,此时期具有合成类固醇的细胞器和相关酶功能的Leydig细胞称为未成熟Leydig细胞。BPA对未成熟Leydig细胞的毒性作用较成年大鼠睾丸更大,更加敏感[4]。本研究探讨BPA对大鼠未成年Leydig细胞睾酮合成及类固醇激素代谢关键酶基因表达的影响。
1 材料和方法
1.1 主要材料及试剂 BPA(CAS 80-05-7)购于Sigma公司;大鼠睾酮酶联免疫分析试剂盒(CatalogNo.E0458r)购于美国PANPACIFIC TECH COMPANY;RT-PCR试剂盒(Catalog No.A126)购于Promega公司;Taq PCR MasterMix(Catalog No.KT201)及DNA Marker(Catalog No.MD109)购于天根公司。
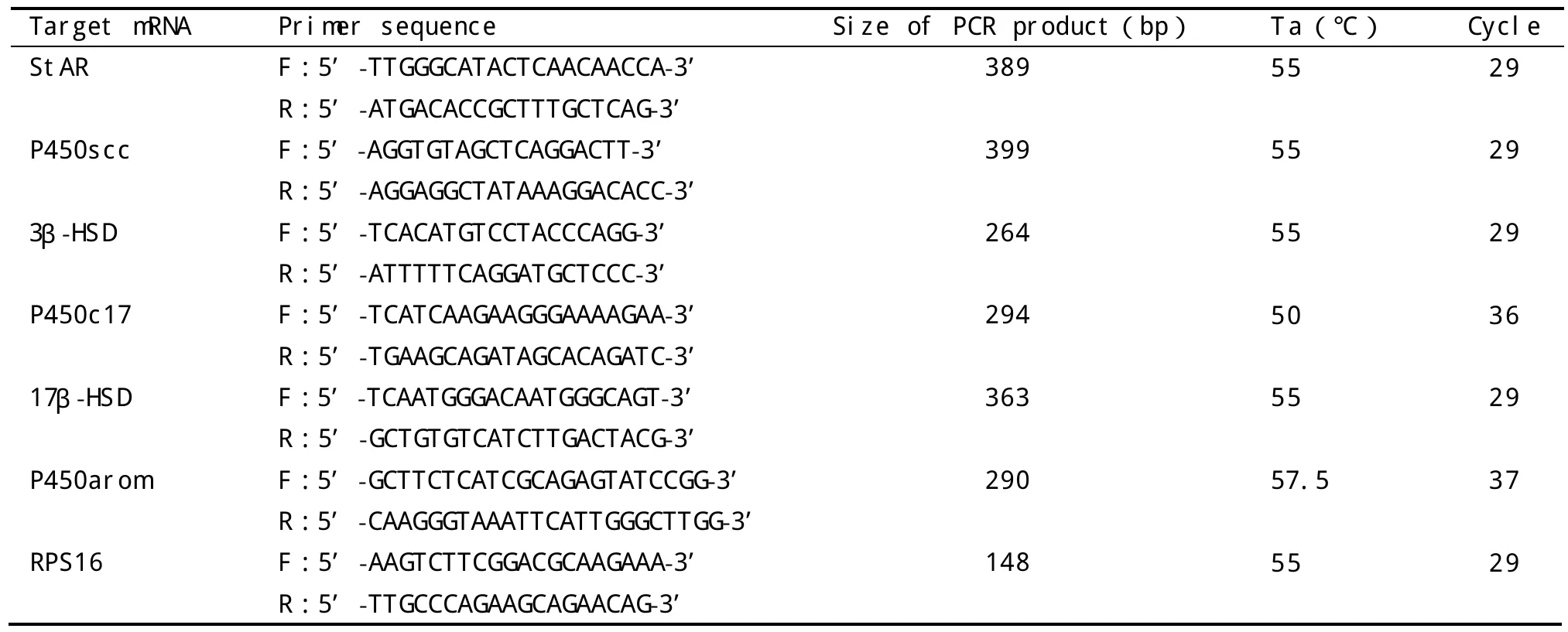
表1 PCR引物序列及扩增条件
1.2 动物分组及给药方案 雄性SD大鼠24只,SPF级刚断奶(出生后21 d),由温州医学院实验动物中心提供。随机均分成4组:对照组、低剂量组(2.4μg/kg)、中剂量组(1 mg/kg)、高剂量组(200 mg/kg)。大鼠饲养于屏障环境中,每天8:00-10:00按上述剂量的BPA分别给大鼠灌胃(对照组以玉米油灌胃),各组每次灌胃体积为5 mL/kg。出生后第35天染毒结束时腹主动脉取血处死大鼠。
1.3 大鼠血清睾酮水平的测定 腹主动脉取大鼠血,室温静置30 min充分凝固,离心(2500 r/min)25 min,取上清,-80 ℃保存。ELISA试剂盒测定血清睾酮,实验步骤严格按试剂盒说明操作。
1.4 大鼠睾丸组织病理学检查
1.4.1 HE染色标本制备:取新鲜睾丸组织1块(约10 mm×10 mm×2 mm),置于10%中性甲醛液中固定,经梯度乙醇脱水,二甲苯透明,浸蜡,石蜡包埋,制成厚度为3μm切片,行苏木素-伊红染色,中性树胶封固。
1.4.2 超微结构检查:取新鲜睾丸组织1小块,约1 mm×1 mm×1 mm,置于2.5%戊二醛4 ℃固定1 h,锇酸后固定,常规PBS漂洗,丙酮梯度脱水。Epon 812包埋,半薄切片定位后,RMC-XL型超薄切片机切片,铅铀双重染色,H-7500型透射电镜下观察Leydig细胞超微结构。
1.5 半定量RT-PCR 取右侧睾丸新鲜组织100 mg加1 mL Triol(美国Invitrogen公司提供),提取各组大鼠睾丸组织的总RNA。取2μg总RNA,用Promega逆转录试剂盒合成cDNA。取1μL cDNA为模板,在Taq DNA 聚合酶(ProbeGene公司提供)催化下应用特异性引物行PCR扩增。引物设计参造Gene Bank中StAR、P450scc、3β-HSD、P450c17、17β-HSD、P450arom及RPSl6 mRNA(作为内参照)序列,由美国Invitrogen公司杭州办事处合成。所有PCR反应条件均标准化使PCR产物位于线形扩增区。PCR引物序列及扩增条件见表1。PCR产物经2%琼脂糖凝胶电泳(含0.5μg/mL Goldview),Gel-pro凝胶分析系统进行分析,以目的基因与RPS16的PCR产物条带累积光密度(IOD)之比作为反映目的基因mRNA水平的相对指标。
1.6 统计学处理方法 用SPSS 13.0统计软件进行统计分析,数据以±s表示,计量资料多组比较采用单因素方差分析LSD法,取α=0.05作为检验水准。
2 结果
2.1 大鼠血清睾酮水平 与对照组比,低剂量组大鼠血清睾酮浓度下降(P<0.05),中、高剂量组大鼠血清睾酮浓度与对照组比差异无统计学意义,见表2。
表2 不同BPA剂量组大鼠血清睾酮浓度的比较(±s,pg/mL)
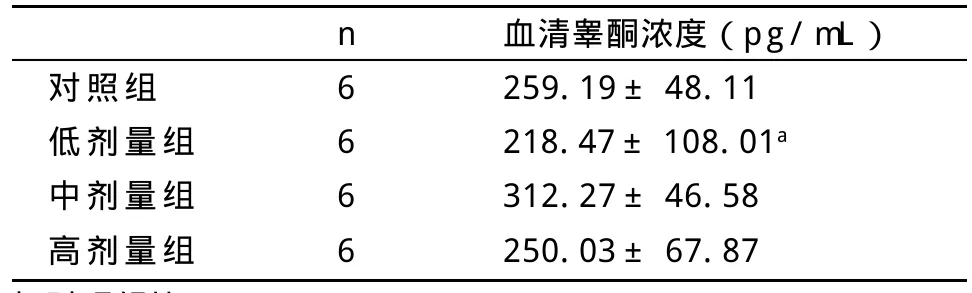
表2 不同BPA剂量组大鼠血清睾酮浓度的比较(±s,pg/mL)
与对照组比:aP<0.05
对照组低剂量组中剂量组高剂量组n6666血清睾酮浓度(pg/mL)259.19±48.11 218.47±108.01a 312.27±46.58 250.03±67.87
2.2 大鼠睾丸Leydig细胞光镜下改变 对照组及BPA不同剂量组大鼠睾丸Leydig细胞形态均未见明显异常。Leydig细胞较大,呈棱形、三角形或不规则形,核多椭圆或短梭形,位于曲细精管之间,常围绕血管成群或成簇排列,见图1。
2.3 大鼠睾丸Leydig细胞超微结构改变 低、中剂量组Leydig细胞超微结构与对照组比无明显差异。高剂量组示线粒体明显肿胀,线粒体嵴变短、排列紊乱,模糊不清,见图2。
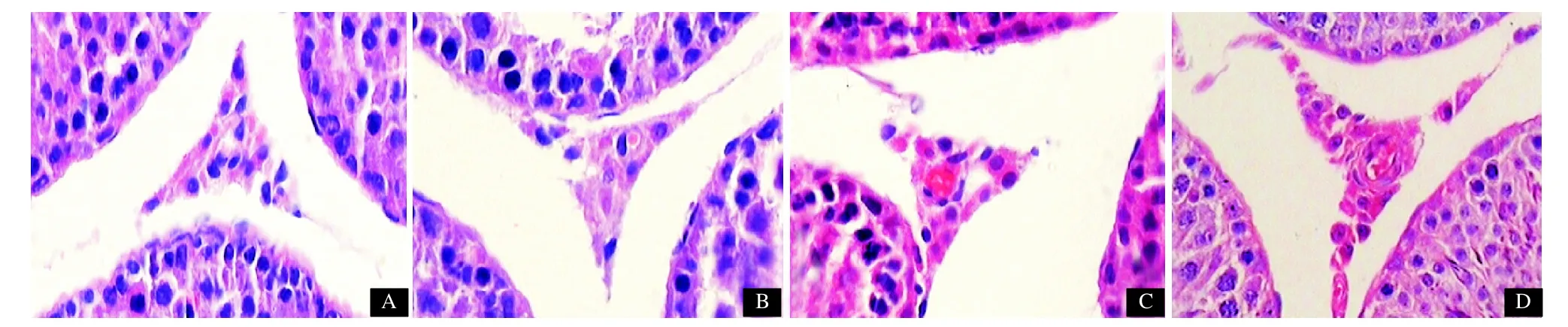
图1 不同BPA剂量组大鼠睾丸组织病理变化(HE,×400)

图2 不同BPA剂量组大鼠睾丸Leydig细胞超微结构变化(TEM,×25000)
表3 不同BPA剂量组大鼠Leydig细胞类固醇代谢酶的比较(n=6±s)

表3 不同BPA剂量组大鼠Leydig细胞类固醇代谢酶的比较(n=6±s)
与对照组比:aP<0.05
StAR 1.00±0.20 0.97±0.18 0.94±0.10 0.79±0.11a对照组低剂量组中剂量组高剂量组P450scc 0.35±0.08 0.25±0.06a 0.37±0.08 0.39±0.06 3β-HSD 0.78±0.08 0.58±0.16a 0.80±0.18 0.96±0.10a P450c17 0.40±0.04 0.38±0.05 0.37±0.06 0.35±0.03 17β-HSD 0.24±0.04 0.21±0.05 0.20±0.02 0.18±0.03a P450arom 0.71±0.12 0.73±0.11 0.65±0.10 0.74±0.11
2.4 大鼠睾丸类固醇激素代谢关键酶的基因转录水平 低剂量组P450scc及3β-HSD基因转录水平下降(P<0.05)。中剂量组各关键酶转录水平未见明显改变。高剂量组StAR及17β-HSD转录水平下降(P<0.05),而3β-HSD转录水平升高(P<0.05),见表3及图3。
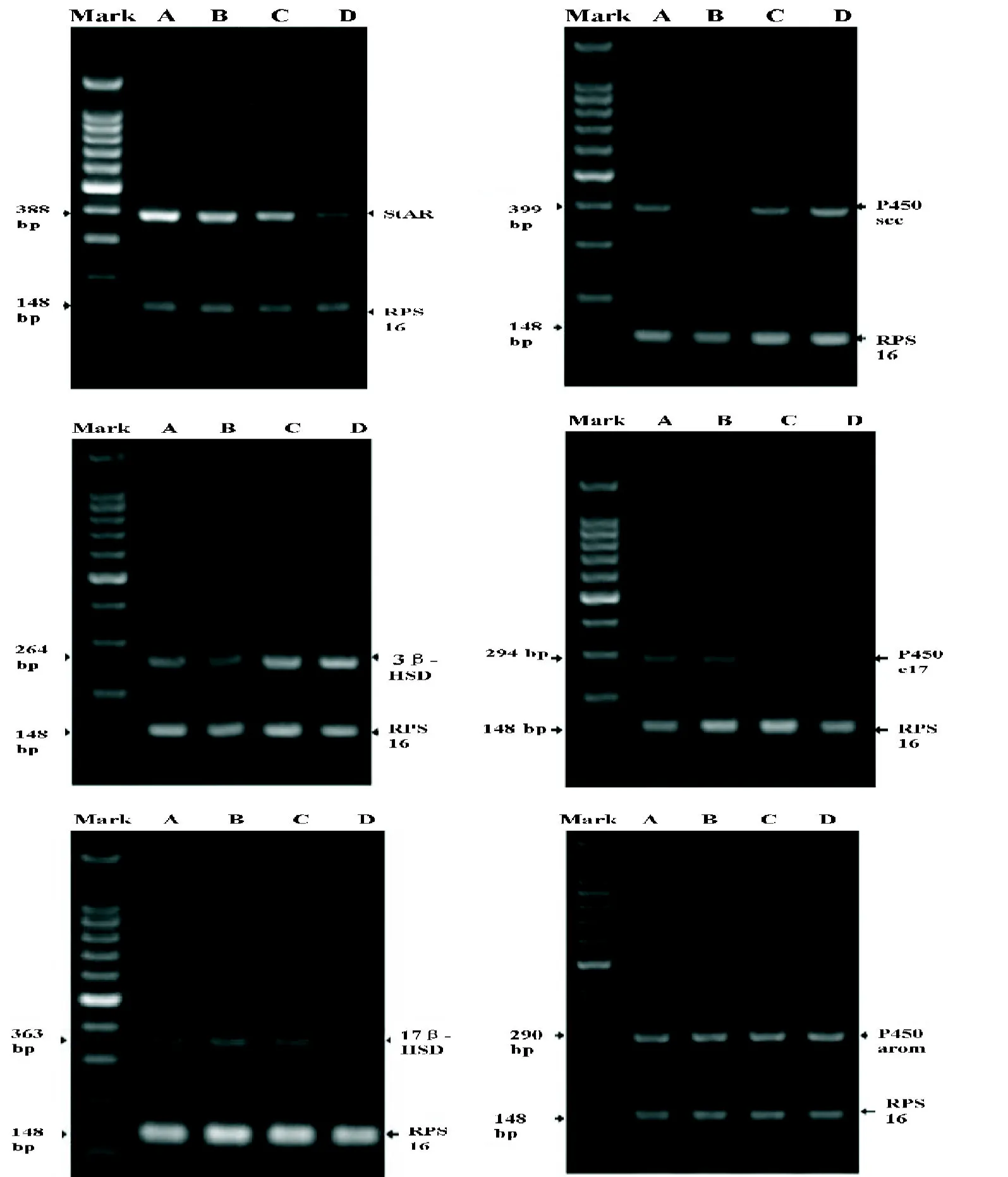
图3 不同BPA剂量组大鼠Leydig细胞类固醇代谢酶StAR、P450scc、3β-HSD、P450c17、17β-HSD和P450arom的变化
3 讨论
研究表明, BPA结构与天然雌激素17β-雌激素及人工合成的雌激素相似,不仅是雌激素受体的激动剂,还是雄激素受体的拮抗剂[3]。体外实验发现BPA不但可通过激活雌激素受体表现出雌激素效应,还可以干扰类固醇代谢酶的功能和表达,进而影响类固醇激素的水平[4]。在啮齿类动物中,BPA可模仿雌激素效应导致阴道上皮的角化,乳腺的生长和分化,大鼠生殖道c-fos基因的表达[5],并且可以延长雌激素周期,改变生殖系统的形态和功能[6]。
睾酮是哺乳动物中主要的雄激素,几乎全部由睾丸Leydig细胞分泌。Leydig细胞的睾酮分泌有基础分泌和促性腺激素诱导分泌两种形式, 后者受下丘脑-垂体-性腺轴调节。最近研究表明肾上腺皮质分泌的糖皮质激素可通过糖皮质激素受体(GR)介导抑制睾丸Leydig细胞睾酮的合成[3],我们前期研究也证实了这一点[7]。同时,Leydig细胞合成睾酮是一系列以胆固醇为原料的酶促反应, 其中包括细胞色素P450家族(P450scc及P450c17)和羟基固醇脱氢酶(3β-HSD及17β-HSD)。StAR主要负责将睾酮的前体-胆固醇从线粒体外膜转移到内膜,近年研究多认为StAR是真正的限速酶[8]。另外研究证实,BPA可以升高卵巢泡膜细胞睾酮水平,这与StAR、P450scc、P450c17和P450arom mRNA的表达水平升高有关[9]。
本研究发现低剂量组大鼠血清睾酮浓度明显下降,并进一步发现P450scc和3β-HSD mRNA的表达水平下降,提示低剂量BPA可能通过抑制P450scc及3β-HSD mRNA的表达水平,导致胆固醇转变为孕烯醇酮和孕烯醇酮转变为孕酮的过程受阻,因此大鼠血清睾酮浓度明显下降。中剂量组大鼠血清睾酮浓度和对照组比,有升高趋势,但无统计学意义,各关键酶表达水平与对照组比也无明显差异,其具体原因尚待进一步分析研究。上述低、中剂量组结果也可从光镜、电镜下得到验证,两组大鼠睾丸形态和超微结构与对照组比均无明显差异。
高剂量组大鼠血清睾酮浓度和对照组比,有降低趋势,但无统计学意义。电镜下观察显示Leydig细胞线粒体肿胀明显,嵴消失;StAR及17β-HSD mRNA的表达水平下降。从电镜和基因表达水平两方面,证明了高剂量BPA可能通过抑制睾丸StAR及17β-HSD mRNA的表达水平,从而影响胆固醇从线粒体膜外转运到膜内以及雄烯二酮转变为睾酮的过程,使睾酮合成减少,导致睾酮水平降低。同时,3β-HSD mRNA的表达水平升高,即睾丸Leydig细胞中3β-HSD mRNA表达的上调可促进孕烯醇酮转变为孕酮,这可能是机体针对睾酮合成减少的另一种代偿机制。由上述可知,StAR、17β-HSD和3β-HSD mRNA表达水平的共同调节,使高剂量组大鼠体内睾酮水平维持在一个相对正常的水平。
Hyoung等[10]以375 mg/kg的BPA作用于SD大鼠,宋清坤等[11]以5、50、500 mg/kg的BPA作用于SD大鼠,大鼠睾丸Leydig细胞光镜下均未见任何病理改变。Akingbemi等[4]在Long-Evans大鼠出生后21~35 d给予2.4μg/kg的BPA后,发现血清睾酮浓度明显降低,而10、100和200 mg/kg的BPA均未影响血清睾酮浓度。Seta等[12]对出生后21~30 d的SD雄性大鼠每天给40μg/kg的BPA灌胃,发现在出生后37 d血清睾酮均明显降低。以上研究均与我们的研究结果相符,因此我们推测,影响睾丸类固醇合成也许是BPA干扰机体的一个靶目标,其影响机制可能不仅与BPA不同暴露剂量和终止监测时点有关,可能还与体内关键酶转录水平激活从而发挥代偿作用有关。因为我们实验中、高剂量组Leydig细胞生物合成的变化并没有反映在血清睾酮水平上。
综上所述,低剂量BPA通过抑制P450scc及3β-HSD mRNA的表达来抑制睾酮合成。中剂量BPA并没有明显抑制StAR、17β-HSD等类固醇激素代谢关键酶的表达。而高剂量BPA可通过损害睾丸Leydig细胞线粒体的结构与功能,抑制StAR及17β-HSD mRNA表达来抑制睾酮的合成,而睾丸3β-HSD mRNA的表达上调,可能是大鼠对影响睾酮合成而形成的代偿性机制从而使睾酮浓度维持在一个正常的水平。
[1] Oehlmann J, Schulte-Oehlmann U, Tillmann M, et al. Effects of endocrine disruptors on prosobranch snails (Mollusca:Gastropoda) in the laboratory. Part I: BisphenolA and octylphenol as xeno-estrogens[J]. Ecotoxicology, 2000, 9(6):383-397.
[2] Rubin BS. Bisphenol A: an endocrine disruptor with widespread exposure and multiple effects[J]. J Steroid Biochem Mol Biol, 2011, 127(1-2):27-34.
[3] Prasanth GK, Divya LM, Sadasivan C. Bisphenol-A can bind to human glucocorticoid receptor as an agonist: an in silico study[J]. J Appl Toxicol, 2010, 30(8):769-774.
[4] Akingbemi BT, Sottas CM, Koulova AI, et al. Inhibition of testicular steroidogenesis by the xenoestrogen bisphenol A is associated with reduced pituitary luteinizing hormone secretion and decreased steroidogenic enzyme gene expression in rat Leydig cells[J]. Endocrinology, 2004, 145(2):592-603.
[5] Dairkee SH, Seok J, Champion S, et a1. Bisphenol A induces a profile of tumor aggressiveness in high-risk cells from breast cancer patients[J]. Cancer Res, 2008, 68(7):2076-2080.
[6] Mlynarcikova A, Kolena J, Fickova M, et a1. Alterations in steroid hormone production by porcine ovarian granulosa cells caused by bisphenol A and bisphenol A dimethacrylate[J]. Mol Cell Endocrinol, 2005, 244(1-2):57-62.
[7] 张虎祥, 张海燕, 陈祥义, 等. 双酚A对大鼠未成年Leydig细胞睾酮合成的影响及机制[J]. 医学研究杂志, 2011, 40(1):35-39.
[8] 孙佳音, 应锋, 韩晓冬. 睾丸间质细胞中睾酮合成酶及蛋白表达的调控因子[J]. 生殖与避孕, 2009, 29(1):42-47.
[9] Zhou W, Liu J, Liao, et al. Effect of bisphenol A on steroid hormone production in rat ovarian theca-interstitial and granulosa cells[J]. Mol Cell Endocrinol, 2008, 283(1-2):12-18.
[10]Hyoung UJ, Yang YJ, Kwon SK, et al. Developmental toxicity by exposure to bisphenol A diglycidyl ether during gestation and lactation period in Sprague-Dawley male rats[J]. J Prev Med Public Health, 2007, 40(2):155-161.
[11] 宋清坤, 郝卫东, 尚兰琴, 等. 双酚A对青春期雄性大鼠生殖发育的影响[J]. 中国男科学杂志, 2008, 20(4):267-271.
[12]Della Seta D, Minder I, Bellioni V, et al. Pubertal exposure to estrogenic chemicals affects behavior in juvenile and adult male rats[J]. Horm Behav, 2006, 50(2):301-307.

