40例肺结核患者病情进展中白细胞介素-8表达变化的初步研究
车南颖 李雪莲 张旭霞 高孟秋 李传友
·论 著 ·
40例肺结核患者病情进展中白细胞介素-8表达变化的初步研究
车南颖 李雪莲 张旭霞 高孟秋 李传友
目的 初步探索40例结核病患者外周血IL-8表达变化及其在肺结核病情进展中的表达变化。方法纳入对象为2011年5月至2013年2月首都医科大学附属北京胸科医院的40例初治肺结核患者,以同期本院15名健康体检者作为健康对照,并根据临床诊断信息对肺结核患者进行分组,将其中从诊断、治疗及治愈后复查阶段都拿到血液样品的8例肺结核患者,作治疗前后比较分析,纳入为跟踪调查组;按照细菌学及影像学检查结果,将另外32例分为病情缓和组(痰菌阴性、肺部无空洞,17例)与病情严重组(痰菌阳性、肺部有空洞,15例)。采集8例跟踪调查组患者治疗前、治疗中(治疗开始后2~3个月之间)和治疗结束后(停药后1~3个月之间)抗凝外周血;另外32例病情缓和组与病情严重组患者只收集治疗前抗凝外周血。加入结核分枝杆菌总蛋白刺激培养,再用酶联免疫吸附法检测血浆中的IL-8表达量。用SPSS 17.0统计软件进行Mann-Whitney U检验以分析健康对照组、病情缓和组及病情严重组患者之间IL-8表达是否存在差异,另外用Wilcoxon检验分析肺结核患者治疗前、治疗中及治疗后IL-8表达是否存在差异。IL-8检测数值用±s)表示,以P<0.05为差异有统计学意义。结果 经刺激诱导过的外周血IL-8表达量在病情严重组[(176.7±133.2)ng/ml]及病情缓和组[(39.6±52.2)ng/ml]均显著高于健康对照组[(7.1±6.3)ng/ml](U=5,P=0.000 008;U=62,P=0.013)。并且病情严重组IL-8表达水平也显著高于病情缓和组(U=37,P=0.001)。另外,肺结核患者治愈后IL-8表达水平[(5.9±3.6)ng/ml]与治疗前[(34.9±33.7)ng/ml]和治疗中[(51.7±34.2)ng/ml]相比有显著的降低(Z=-2.240,P=0.025;Z= -2.521,P=0.012)。结论 IL-8表达水平与肺结核患者病情转归相关。
结核,肺/血液; 白细胞介素8; 疾病严重程度指数
肺结核是严重危害人类健康的重要传染性疾病,在中国的疫情非常严重[1-2]。肺结核治疗周期长,药物常出现不良反应,快速准确判断化疗效果是治疗肺结核的重要环节。目前评估肺结核转归情况
主要靠以下3个方面的信息:(1)影像学检查结果;(2)细菌学检查结果;(3)临床症状观察结果。但这些指标存在主观影响大、阳性率低、耗时长或者症状不典型等缺点,不能满足临床判断肺结核转归的客观、快速、准确的要求。白细胞介素-8(interleukin-8,IL-8)作为重要的炎症因子在感染控制及病理损伤形成中均起着非常重要的作用。研究表明,IL-8很可能与结核病发病和病理现象相关。肺结核患者和潜伏感染者外周血单核细胞(peripheral blood monouclear cells,PBMC)在结核分枝杆菌(Mycobacterium tuberculosis,Mtb)特异性蛋白的刺激下,IL-8转录水平差异有统计学意义[3]。动物模型中,IL-8与肉芽肿形成密切相关[4]。本研究通过比较健康人与不同临床背景的肺结核患者之间的IL-8表达差异,以及肺结核患者不同病程中IL-8表达特点,探索了IL-8作为肺结核转归评估指标的可行性。
材料和方法
一、临床资料
1.基本情况:搜集从2011年5月至2013年2月在首都医科大学附属北京胸科医院就诊的初治肺结核患者。根据《肺结核诊断和治疗指南》制定了肺结核患者纳入条件[5]。满足(1)、(2)中任意一项,并同时满足(3)、(4)两项即可纳入:(1)痰检(涂片或培养)呈阳性;(2)痰检阴性,但是影像学检测及经化学治疗好转证实为肺结核;(3)初治肺结核患者;(4)无糖尿病。对于痰菌阳性的确诊患者直接纳入。对于痰菌阴性的疑似患者,先按照疑似患者纳入,采集和处理好血液样品之后,待后续化学治疗有效,能确诊为肺结核后再进行正式纳入。如果临床上无法提供确诊信息,则进行排除。最终符合纳入标准的初治肺结核患者共40例,其中32例按照细菌学及影像学检查结果大致分为病情严重(痰菌阳性、肺部有空洞,15例)和病情缓和(痰菌阴性、肺部无空洞,17例)两组进行比较(表1);8例肺结核患者从诊断、治疗及治愈后复查阶段都拿到血液样品,进行治疗前后比较分析,8例肺结核患者中男6例,女2例;年龄范围(22~49)岁,平均年龄(32.6±10.4)岁;细菌学检测阳性3例,阴性5例;3例有空洞,治疗时间6~12个月。
同期选择本院健康体检者作为健康对照。健康对照纳入标准为:影像学检测正常,并且无任何结核病相关临床症状。根据纳入肺结核患者按病情程度分组后的数量,一次性纳入15名健康对照者。患者及健康对照者的纳入均通过了首都医科大学附属北京胸科医院伦理委员会审核及批准,并取得了本人或家属的知情同意。
2.治愈标准:本研究治愈标准设定为满足以下3条:(1)连续2次痰涂片结果阴性,其中1次是治疗末;(2)完成规定的疗程;(3)肺部病灶吸收、稳定或者消失。作治疗前后比较的8例患者均治愈。
二、试剂、耗材和仪器
人IL-8 ELISA试剂盒购自RayBiotech公司(Norcross,USA);0.1 mm silica FastPrep beads及FastPrep-24组织破碎仪购自MP Biochemicals(Eschwege,Germany);0.22μm一次性无菌滤器购自Millipore公司(Billerica,USA);BCA蛋白定量试剂盒购自上海捷瑞生物工程有限公司。24孔细胞板购自上海康宁生物公司,其他耗材均为国产普通耗材。高速冷冻离心机购自Sigma公司,型号为3-30K;CO2培养箱购自湖北湘仪公司,型号为YCP-200A;酶标仪购自北京普朗医疗器械公司,型号为9602。
三、方法
1.Mtb总蛋白制备:将H37Rv菌接种到7H9液体培养基,37℃振荡培养至吸光度A值达到1.0以上,离心收集菌体。p H值为7.4、0.01 mol/L磷酸盐缓冲液(phosphate buffer,PBS)洗2次,再用PBS重悬菌体,转移至装有FastPrep beads的管中,并通过FastPrep-24组织破碎仪振荡破碎细菌。4℃,10 000×g离心10 min,取上清。用0.22μm一次性无菌滤器过滤除菌。用二喹啉甲酸(bicinchoninic acid,BCA)法检测蛋白质浓度,稀释到1 mg/ml后分装,-80℃保存。

表1 纳入对象各组基本信息
2.外周血采集及Mtb总蛋白刺激培养:治疗前血液样品在化疗前采集,治疗中血液样品在治疗开始后2~3个月之间采集,治疗结束后血液样品在停药后1~3个月之间采集。全部在肺结核患者进行化学治疗前进行。空腹状态下,每位纳入者用真空EDTA抗凝采血管一次性抽取2 ml外周血。将抗凝血转移至24孔板,每孔1 ml外周血,加2孔。第一孔加入10μl PBS(p H=7.4),第二孔加入10μl Mtb总蛋白。在37℃,5%CO2培养24 h。4℃,3500×g离心10 min,取上清,-80℃保存。
3.IL-8表达水平检测:用双抗夹心ELISA方法测定血浆IL-8浓度,试剂盒采用RayBiotech公司人IL-8检测ELISA试剂盒,并按照说明书进行实验。根据标准品的读取数值建立标准曲线,计算待测样品中IL-8浓度。
4.统计学方法:用SPSS 17.0统计软件进行Mann-Whitney U检验以分析健康对照组、病情缓和组及病情严重组之间IL-8表达是否存在差异,另外用Wilcoxon检验分析肺结核患者治疗前、治疗中以及治疗后IL-8表达是否存在差异。IL-8检测数值用(±s)表示,以P<0.05为差异有统计学意义。
结 果
1.不同临床背景肺结核患者IL-8表达分析:检测结果显示,PBS作为对照处理后,健康对照组、病情缓和组及病情严重组血液中IL-8表达量分别为(0.7±0.5)ng/ml、(1.3±1.1)ng/ml和(9.9± 17.5)ng/ml,而用Mtb总蛋白刺激后,健康对照组、病情缓和组及病情严重组血液中IL-8表达量分别为(7.1±6.3)ng/ml、(39.6±52.2)ng/ml和(176.7±133.2)ng/ml。Mann-Whitney U检验分析显示,用PBS处理时健康对照组与病情缓和组之间的差异无统计学意义(U=89,P=0.146),而病情缓和组与病情严重组患者之间,健康对照组与病情严重组患者之间差异具有统计学意义(U=67, P=0.022,U=40,P=0.003)(图1A)。Mtb总蛋白刺激样品中,两组肺结核患者的IL-8表达均比健康对照组有显著提高(U=5,P=0.000 008;U= 62,P=0.013)。另外,病情严重组比病情缓和组的表达显著提高(U=37,P=0.001)(图1B)。这些结果表明,IL-8本底表达与肺结核病情严重程度有一定的相关性,而经过Mtb抗原诱导后的IL-8表达水平的差异更加显著,与结核病病情严重程度呈正相关。
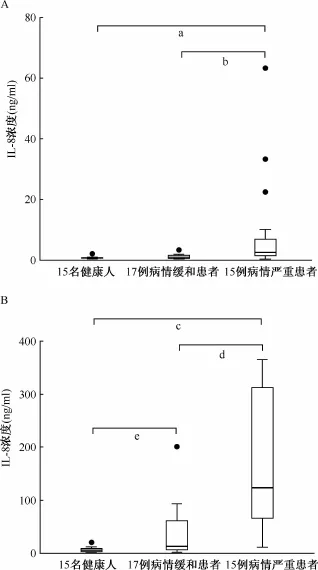
图1 健康人与不同临床背景肺结核患者外周血IL-8表达量的比较
2.不同时期肺结核患者血液样品中的IL-8表达分析:为进一步探索IL-8表达与肺结核转归的相关性,比较从诊断、治疗以及治愈后复查阶段都拿到血液样品的8例肺结核患者治疗前、治疗中及治疗结束后的IL-8表达量分别为(34.9±33.7)ng/ml、(51.7±34.2)ng/ml和(5.9±3.6)ng/ml。经Wilcoxon检验,治疗结束后IL-8表达水平显著低于治疗前及治疗中的IL-8表达水平,患者在肺结核活动期IL-8表达与治愈后IL-8表达水平差异有统计学意义(Z=-2.240,P=0.025;Z=-2.521,P=0.012)(图2)。治疗中IL-8表达高于治疗前(Z=-1.260,P=0.208)。这些结果提示IL-8的诱导表达水平可能成为评估肺结核转归的一个指标。
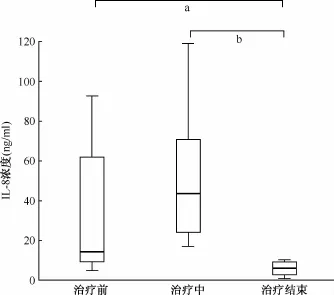
图2 8例肺结核患者不同时期外周血IL-8表达量分析
讨 论
IL-8是CXC细胞因子家族成员,是介导炎症反应的主要细胞因子。IL-8主要功能是趋化多种免疫细胞至感染部位吞噬并杀伤病原菌。同时,在感染部位也会进一步导致细胞脱粒,通过活化NADPH氧化酶促进超氧化物和H2O2的形成,并引发呼吸爆发。肺结核是一种由 Mtb引起的传染性疾病,因此发病期间病原菌感染及组织病理损伤都会引起感染部位IL-8的高表达。在体外培养实验中,多种免疫细胞只有在Mtb刺激时才会产生大量的IL-8,而没有刺激时IL-8表达量很低[6-8]。免疫组化结果表明,肺结核患者淋巴结及肉芽肿组织中均有IL-8表达[6]。在临床样本检测中,结核病患者支气管灌洗液、外周血B细胞、外周血单核细胞等样品中IL-8表达量均高于正常人的样品[3,9-10]。此外,因结核病死亡的患者血浆中IL-8比存活的患者有显著提高[10]。这些结果提示,IL-8表达与Mtb感染、结核病发病以及结核病严重程度相关。但是,IL-8表达与肺结核转归及治愈之间是否存在相关性,能否成为评估指标还需要进一步研究。因此,本研究纳入了不同临床背景肺结核患者、健康人、不同病程肺结核患者,探讨了IL-8表达变化与肺结核转归及治愈之间的相关性。
在比较健康人、病情缓和的肺结核患者以及病情严重的肺结核患者外周血IL-8表达水平时,笔者发现用PBS处理的血液样品中IL-8表达在三组中没有显著变化(P>0.05),而用Mtb总蛋白刺激后的血液样品三组之间呈现显著的不同(P<0.05),且IL-8表达水平与病情严重程度正相关(图1)。这个结果表明,结核病患者外周血IL-8本底表达与病情严重程度没有相关性,但是针对 Mtb抗原刺激后的IL-8表达水平是有相关性的。一般认为,外周血细胞中对IL-8表达起主要贡献作用的是单核细胞。笔者在前期工作中分析了769名健康人及547例结核病患者的外周血细胞中的单核细胞数量。结果显示,肺结核患者平均值为(4.5±1.7)×105个/ml,健康人平均值为(3.8±1.1)×105个/ml。在本研究中两组肺结核患者IL-8表达量平均值为(39.6± 52.2)ng/ml和(176.7±133.2)ng/ml,而健康人IL-8表达量平均值为(7.1±6.3)ng/ml。虽然肺结核患者相比健康人单核细胞数量提高1.2倍,但是IL-8表达量却升高5倍以上。因此,笔者认为肺结核患者外周血单核细胞对于Mtb抗原刺激更敏感,IL-8诱导表达量更高。
笔者还对8个肺结核患者就治疗前、治疗中以及治愈后外周血IL-8表达水平变化进行比较。结果显示,肺结核患者在发病期IL-8表达量均处于高位,而治愈后IL-8表达显著降低,回到健康人的表达水平(图2)。其中,值得注意的是治疗开始后2~3个月的IL-8的表达与治疗前相比差异没有统计学意义(Z=-1.260,P=0.208),治疗中IL-8表达量均值为(51.7±34.2)ng/ml,高于治疗前的(34.9± 33.7)ng/ml。但是3例痰菌阳性的患者经过2~3个月治疗后痰菌已转阴,同时大部分患者肺部病灶都出现不同程度的好转迹象。笔者分析出现这种情况可能是由于免疫应答的变化需要时间。机体启动免疫应答需要一定时间,同样病情好转后消除相应的免疫应答也需要时间。因此,IL-8诱导表达水平的变化相比临床指标的改善有一定时间的滞后。因此,笔者认为IL-8表达与肺结核转归相关,但其表达变化相比临床症状的改善可能出现一定的延迟。
综上所述,本研究结果表明Mtb抗原刺激后的外周血IL-8表达水平与肺结核转归相关,但是由于本研究纳入研究对象数量有限,IL-8表达水平能否成为评估肺结核转归新指标还需要用更大量的临床样本做进一步的验证。同时IL-8表达与各临床指标之间相互影响的分子机制以及它们之间是否存在时间差也需要更深入的研究。
[1]全国第五次结核病流行病学抽样调查技术指导组,全国第五次结核病流行病学抽样调查办公室.2010年全国第五次结核病流行病学抽样调查报告.中国防痨杂志,2012,34(8):485-508.
[2]陈伟,夏愔愔,成诗明.结核病疫情及对策.中国防痨杂志,2012,34(9):611-613.
[3]Wu B,Huang C,Kato-Maeda M,et al.Messenger RNA expression of IL-8,FOXP3,and IL-12beta differentiates latent tuberculosis infection from disease.J Immunol,2007,178 (6):3688-3694.
[4]Larsen CG,Thomsen MK,Gesser B,et al.The delayed-type hypersensitivity reaction is dependent on IL-8.Inhibition of a tuberculin skin reaction by an anti-IL-8 monoclonal antibody.J Immunol,1995,155(4):2151-2157.
[5]中华医学会结核病学分会.肺结核诊断和治疗指南.中华结核和呼吸杂志,2001,24(2):70-74.
[6]Ferrero E,Biswas P,Vettoretto K,et al.Macrophages exposed to Mycobacterium tuberculosis release chemokines able to recruit selected leucocyte subpopulations:focus on gammadelta cells.Immunology,2003,108(3):365-374.
[7]Sawant KV,Mc Murray DN.Guinea pig neutrophils infected with Mycobacterium tuberculosis produce cytokines which activate alveolar macrophages in noncontact cultures.Infect Immun,2007,75(4):1870-1877.
[8]Sadik CD,Hunfeld KP,Bachmann M,et al.Systematic analysis highlights the key role of TLR2/NF-kappaB/MAP kinase signaling for IL-8 induction by macrophage-like THP-1 cells under influence of Borrelia burgdorferi lysates.Int J Biochem Cell Biol,2008,40(11):2508-2521.
[9]Algood HM,Chan J,Flynn JL.Chemokines and tuberculosis. Cytokine Growth Factor Rev,2003,14(6):467-477.
[10]Vani J,Shaila MS,Rao MK,et al.B lymphocytes from patients with tuberculosis exhibit hampered antigen-specific responses with concomitant overexpression of interleukin-8.J Infect Dis,2009,200(3):481-482.
Expression patterns of interleukin-8 during the progress of disease in 40 pulmonary tuberculosis patients
CHE Nanying,LI Xue-lian,ZHANG Xu-xia,GAO Meng-qiu,LI Chuan-you. Department of Bacteriology and Immunology,Beijing Tuberculosis and Thoracic Tumor Research Institute,Beijing Chest Hospital,Capital Medical University,Beijing 101149,China
LI Chuan-you,Email:lichuanyou6688@hotmail.com
Objective To study the expression patterns of interleukin-8(IL-8)in peripheral blood samples from 40 pulmonary tuberculosis(PTB)patients during progress of PTB.Methods Fifteen healthy donors and 40 newly diagnosed PTB patients were recruited from May 2011 to February 2013 in Beijing Chest Hospital.The PTB patients were divided into 3 groups:8 patients for tracking studies;17 patiens with mild symptoms(negative sputum bacteria,the lung without cavity);15 patients with severe symptoms(positive sputum bacteria,the lung with cavity).Anticoagulant peripheral blood samples from 8 patients for tracking studies were collected before treatment,during treatment(2 to 3 months after treatment started),and after treatment(1 to 3 months after treatment ended),while that from the other 32 patients were collected only before treatment.Then the blood samples were incubated with Mycobacterium tuberculosis whole cell proteins.Plasma IL-8 expression levels were detected by enzyme linked immunosorbent assay.Statistical analysis was performed using SPSS 17.0 software.Mann-Whitney U test was used for analyzing IL-8 expression differences among healthy donors,mild PTB patients,and severe PTB patients.Wilcoxon test was used for comparing IL-8 expression levels before,during,and after treatment.IL-8 value was shown as±s),P value<0.05 was considered as statistically significant.Results Induced expression level of IL-8 in severe PTB patients was(176.7±133.2)ng/ml,while that in mild PTB patients was(39.6±52.2)ng/ml. Both expression levels were significantly higher than that in healthy donors[(7.1±6.3)ng/ml](U=5,P=0.000 008;U=62,P=0.013).Also,expression level of IL-8 in severe PTB patients was significantly higher than that in mild PTB patients(U=37,P=0.001).Additionally,IL-8 expression level in patients after treatment[(5.9±3.6)ng/ml]was significantly decreased than those before treatment[(34.9±33.7)ng/ml]and during treatment[(51.7±34.2)ng/ml](Z=-2.240,P=0.025;Z=-2.521,P=0.012).Conclusion IL-8 expression level is associated with progress of PTB.
Tuberculosis,pulmonary/blood; Interleukin-8; Severity of illness index
2013-04-26)
(本文编辑:张晓进)
国家自然科学基金(81101332);北京市优秀人才培养资助项目(2010D003034000002)
101149北京市结核病胸部肿瘤研究所 首都医科大学附属北京胸科医院 细菌免疫学研究室(车南颖、张旭霞、李传友),结核内科(李雪莲、高孟秋)
李传友,Email:lichuanyou6688@hotmail.com

