生物样品的扫描电镜制样干燥方法
肖 媛,刘 伟,汪 艳,左艳霞,胡 锐,李婷婷,崔宗斌
(中国科学院 水生生物研究所,湖北 武汉430072)
0 引 言
应用扫描电镜观察生物样品表面的微小形态特征,以获得较光学显微镜观察结果更为详尽、细微的结构特征,是生物学研究的重要手段之一。而能否获得真实、清晰、理想的扫描电镜观察结果,样品的制备过程是关键。
对于常规的扫描电镜(Scanning Electron Microscope,SEM)而言,用于观察的样品必须是经过彻底干燥处理的。含水量高的样品在扫描电镜真空的镜筒中将造成诸多不良后果[1]:①样品受电子束轰击后蒸发的水蒸气遭遇高能电子流,产生电离而放电,引起束流大幅度波动,使图像模糊,出现雾状,或者根本不能成像;②大多数样品在高真空中容易发生形态损伤,使研究特征皱缩、变形;③造成物镜、镜头、光阑等的污染;④灯丝碰到水蒸气而氧化变质乃至熔断。虽然近年来出现了环境扫描电镜(Environment Scanning Electron Microscope,ESEM)和冷冻扫描电镜(Cryo-Scanning Electron Microscope,Cryo-SEM)等可观察含水样品的扫描电镜,但上述观察方法的分辨率较低,因此目前使用较多的还是只能观察不含水样品的SEM。
生物样品的含水量一般为70% ~80%,仅有少数样品如毛发、牙齿、角质以及含水量极低的昆虫等可以直接喷镀观察,绝大多数的生物样品均要求经过干燥处理才能镀金和进行扫描电镜观察[2]。干燥是扫描电镜生物样品制备中的关键环节,如果处理不好,会直接影响到观察的清晰度与准确度,甚至直接导致试验失败[3]。要想制备出好的扫描电镜生物样品,要求在干燥过程中尽可能减少由于水分蒸发而引起的样品表面形貌的变形(体积变化、结构皱缩或干裂等),且必须确保干燥彻底[1]。大多数动植物,特别是柔软的细胞和组织,在干燥时由于体积应力和表面张力的作用,容易发生明显的塌陷和变形[2]。因此,需要针对不同的生物样品来选择合适的干燥方法,在样品不受或少受表面张力等因素的影响下,不变地将液体溶剂去掉,达到干燥的目的。
干燥的方法很多,比如临界点干燥法、自然干燥法、冷冻干燥法、叔丁醇真空干燥法、六甲基二硅胺烷干燥法、乙腈干燥法、烘干干燥法、氮气干燥法和微波干燥法等[1]。这些方法各有利弊,且适用样品种类不同。因此,根据生物样品的特性选择一种适宜的干燥方法十分重要。孙京田等也认为干燥方法的选择是生物医学扫描样品制备中难度最大的一关,他们比较了4 种干燥方法,并分析了各种方法适合的样品类型[4]。还有一些研究使用某一种或某一类生物材料进行了几种干燥方法的比较,并指出应根据样品的性质选择相应的干燥方法[3,5-7]。但近年来,没有任何文献针对不同种类生物样品的扫描电镜样品干燥方法的选择进行系统的归纳总结。本文使用维普期刊和中国知网等数据库,搜索了生物样品扫描电镜制样和观察的相关文章,共计找到了2001 年以来的122 篇中文文献,重点比较分析了不同生物样品所采用的不同干燥方法,并对微生物、植物或动物样品干燥方法的一般性选择原则进行归纳和总结,以期为研究人员选择扫描电镜制样方法提供帮助。
1 扫描电镜生物样品制备常用干燥方法
1.1 自然干燥法
自然干燥法是指样品中的水分在大气中自然蒸发,或样品经脱水处理后脱水剂自然挥发而干燥的方法。样品从含脱水剂状态下进行自然干燥与样品从含水状态下进行自然干燥相比,由于脱水剂的表面张力系数小于水,所以前者样品变形较小[1]。自然干燥法对于含水量较多的动植物组织、游离细胞等的干燥是不适用的,因为干燥过程中表面张力将使样品变形。自然干燥法对干种子、果壳、某些干花粉、长期保存的昆虫针插标本和70%乙醇浸泡的昆虫标本以及蛋壳和蛋膜等样品是一个简易实用有效的方法,虽然在自然干燥过程中,样品体积有所收缩,但却保留了样品的基本形态[1]。
1.2 烘干干燥法
此方法将要研究的样品用烘干箱烘干,一般温度控制在80℃以下,烘干程度以含水量在5%以下为好。此方法的干燥速度较快,但水分蒸发时可能造成样品变形或微小断裂。适用于不易变形且耐热的样品,比如淀粉粒、孢子粉等[1]。
1.3 临界点干燥法
此方法是根据物质处在临界点时的特殊物理状态设计的一种干燥方法。在临界状态下,液体和气体的密度相等,气液界面完全消失,液体的表面张力系数为零[1]。临界点干燥法之所以一直被视为制作生物医学扫描样品最可靠的干燥方法,是因为此法能消除液体表面张力的作用,干燥出的样品能最大程度地保存其自然形态[4]。临界点干燥法适合多种生物样品的干燥。
1.4 冷冻干燥法
冷冻干燥法是利用低温和真空,使样品中的水分直接由冰升华,或经过某种升华介质由固相升华,以达到干燥样品的目的[1]。冷冻干燥过程使水分从固态直接转化为气态,不经过液态阶段,因而避免了气相和液相之间表面张力对样品的损伤[2]。根据选用的冷冻介质的不同,冷冻干燥法又可以分为从水中直接冷冻干燥和从有机溶剂中干燥。与水相比,有机溶剂在冰冻后形成非晶体固态,不会产生冰晶损伤样品,且能以最快的速度从固态升华,大为缩短了干燥时间[2]。
1.5 真空干燥法
真空干燥法指的是将经脱水的样品置于真空容器中进行干燥的方法。真空干燥法选用高熔点的有机材料(叔丁醇、乙腈、六甲基二硅胺烷、正丁醇等)作升华介质,既保留了冷冻干燥法的优点,又不用对样品进行冷冻处理,无冷冻损伤,且操作简单[1]。最常用的真空干燥法是以叔丁醇为升华介质的叔丁醇干燥法,乙腈干燥法、六甲基二硅胺烷干燥法、正丁醇干燥法等用的相对较少(下文将叔丁醇真空干燥简称为叔丁醇干燥)。
总之,如表1 所示,上述5 种干燥方法各有优缺点,且适合于不同的生物样品种类。一般认为目前在用的最好的干燥方法是临界点干燥法;其次是冷冻干燥法、真空干燥法和自然干燥法[2]。虽然干燥方法在不断改进,但还是只能把由干燥引起的样品变形控制在一定的范围内。临界点干燥法被认为是一种最理想的干燥方法,但仍存在大约5%的变形[1]。有研究结果表明,叔丁醇干燥法对有些材料来说可与临界点干燥相媲美,而且前者具有操作简便,叔丁醇可代替酒精做脱水剂,可同时干燥较大量的样品,样品不易被污染、安全可靠、所需仪器常规实验室均有配备等优点[8]。孙京田等发现采用叔丁醇干燥法干燥的各种动、植物样品各项指标均较理想,与临界点干燥法的效果基本相同,因此认为叔丁醇干燥法也是制作生物、医学扫描样品时首选的干燥方法[4]。郭素枝等考虑到叔丁醇干燥法的诸多优点,建议在没有临界点干燥仪的情况下采用叔丁醇干燥法[8]。在实际应用中,应该根据不同的样品和实验目的来选择不同的干燥方法,最好参照文献选择针对特异样品的干燥方法。

表1 5 种常用生物样品干燥方法的比较
2 微生物、植物和动物的SEM 样品干燥方法
2.1 微生物
如表2、3 所示,在数据库中共搜索到2005 年以来的11 篇相关文献。对于微生物样品,使用各种干燥方法均取得过满意的观察结果,各方法的选择没有明显的偏向性。总的来说临界点干燥法和叔丁醇干燥法应用得较多,但细菌、霉菌和真菌都可以选用操作较为简单的自然干燥法或烘干干燥法。孔祥林等在制备贵阳腐霉的扫描电镜样品时,采用了自然干燥的方法,同时他们也指出低温天气时可用鼓风干燥箱30 ℃干燥,即使用烘干干燥法[9]。表明对于贵阳腐霉来说,自然干燥和烘干干燥的效果没有明显区别。钱天乐等比较了经室内晾干、烘箱干燥和叔丁醇真空干燥处理后的大肠杆菌的形态和制样处理效果,发现叔丁醇真空干燥对样品脱水最充分、造成的破坏和变形最小,而且干燥越充分样品的扫描电镜图像越清晰,由此认为对单细胞生物采用叔丁醇干燥法要比自然晾干和烘干脱水更彻底、成像更理想[7]。对于细菌、细胞一类微小的样品,采用临界点和冷冻干燥法较难操作,但若采用固定、脱水之后将样品点于盖玻片上再真空干燥的方法,效果还是比较理想的,而且方便操作[1]。总之,对于微生物等微小的生物样品,如果想要操作简便,可以选用自然干燥法或烘干干燥法;如果想要获得较好的效果,建议选用临界点干燥法或真空干燥法。

表2 微生物样品的扫描电镜制样干燥方法与研究时间的关系
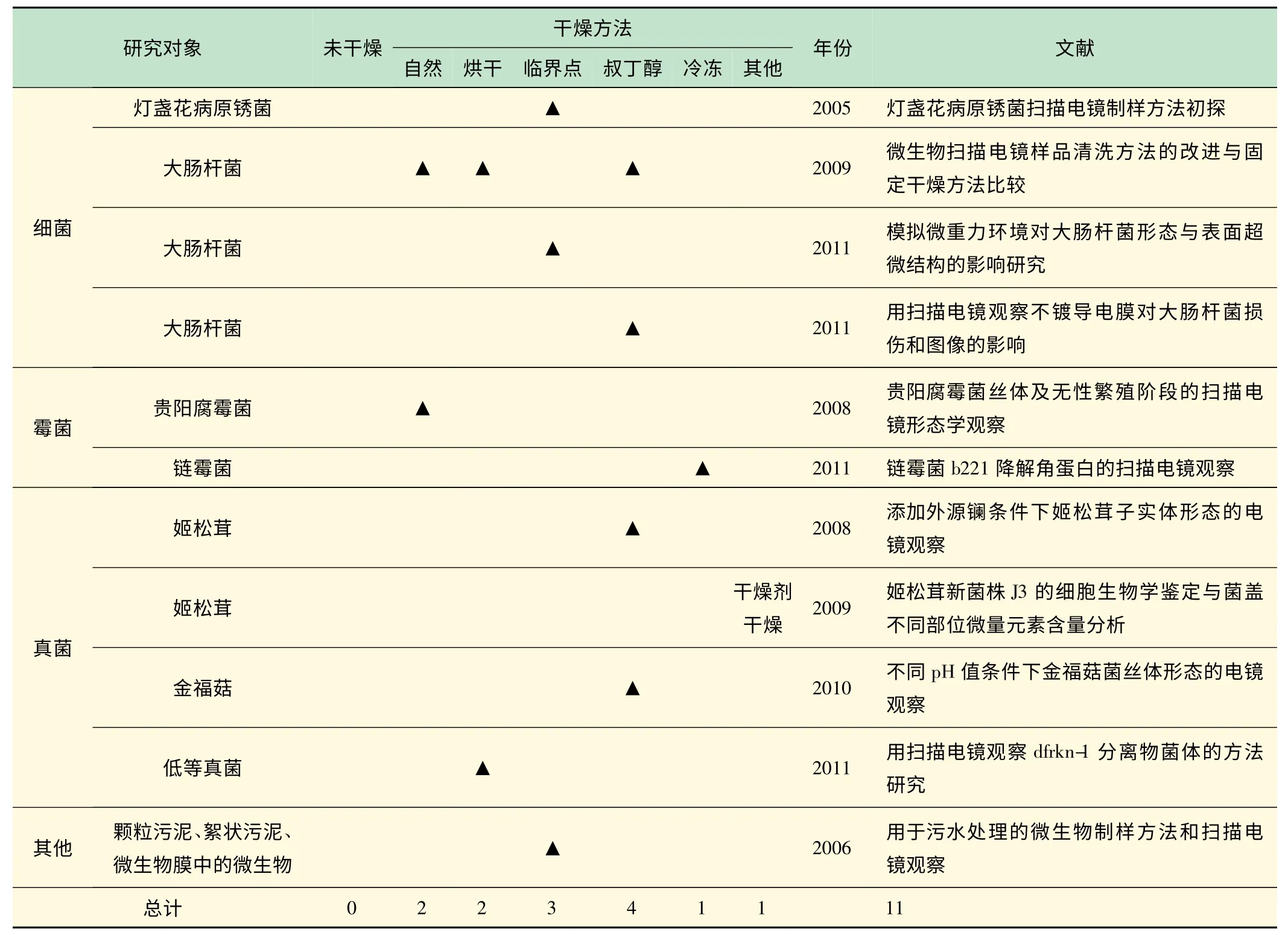
表3 不同种类微生物样品的扫描电镜制样干燥方法
2.2 植 物
综合2004 年以来的数据,在对植物样品进行干燥时,研究者选用最多的方法是临界点干燥法,然后是自然干燥法和叔丁醇干燥法(见表4)。从文献的时间来看,自然干燥法和临界点干燥法是两种比较传统的干燥方法,应用最为广泛,自2004 年起基本每年都有文献;叔丁醇干燥法和冷冻干燥法作为较新的干燥方法,近年来才开始获得广泛的应用。有8 篇文献未对植物样品进行任何干燥就放入扫描电镜观察,其中5 篇关于花粉使用的是常规电镜,2 篇关于叶片使用的是环境扫描电镜,1 篇关于全株使用的是冷冻扫描电镜。需要特别指出的是,只有花粉的文献是真正意义上的未干燥,其余3 篇文献则是由于使用了特殊类型的扫描电镜。
共有15 篇文献是关于花粉的研究,其中5 篇未干燥,4 篇采用自然干燥法,6 篇采用临界点干燥法(见表5)。一般来说,花粉本身含水量较少且外表不易变形,多采用自然干燥法。蔡秀珍等认为虽然花粉有坚硬的外壁,但如果直接通过野外日晒或室内烘箱烘干来干燥,脱水过程过于剧烈,不利于花粉表面微观结构的保存,而用酒精系列梯度脱水后再自然干燥则可得到较为理想的制样效果[10]。也有些植物的花粉组织幼嫩,本身含水分较多,在自然干燥处理过程中容易因为表面张力的作用,使得其表面结构发生皱缩、塌陷、变形。陈新芳等的研究就表明自然干燥法不适合用于五指毛桃花粉的扫描电镜样品制备,而临界点干燥法制备的花粉表面干净、形态清晰饱满、基本无变形,立体感强[11]。
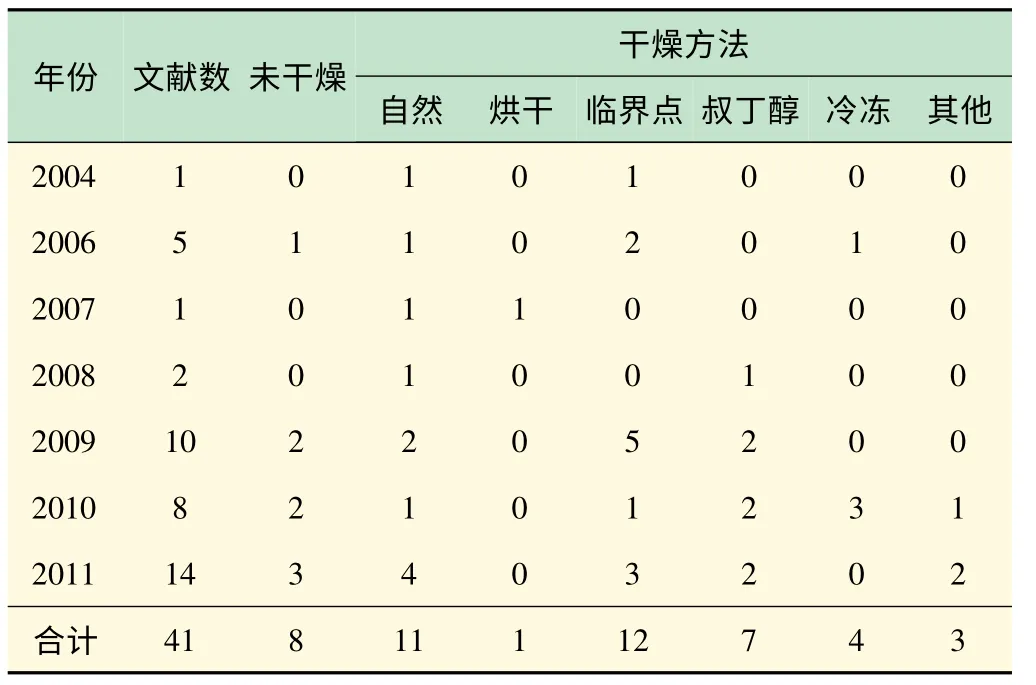
表4 植物样品的扫描电镜制样干燥方法与研究时间的关系

表5 不同种类植物样品的扫描电镜制样干燥方法

续表5
也许是因为植物样品的扫描电镜制样较为简单,关于其干燥方法的比较研究的文献较少。本文总结的文献中,仅有曹君迈等比较了微波干燥、液氮干燥、真空冷冻干燥、叔丁醇干燥4 种方法处理植物花蕾的效果,结果表明叔丁醇干燥法效果最好[3]。一般来说,含水量较少、细胞壁和蜡质层较厚的植物组织多采用自然干燥法,而幼嫩、含水分较多的组织则需要选择其他方法。临界点干燥法和叔丁醇干燥法几乎适用于各类型的植物样品,但是考虑到操作的复杂性,能使用更简便的干燥方法时一般不选用它们。
2.3 动 物
对于动物样品来说,临界点干燥法是首选的干燥方法,约60%的查阅文献使用了该方法,其次是自然干燥法和真空干燥法(见表6)。文献主要集中于线虫动物门、节肢动物门和脊索动物门,且不同动物门的生物样品的干燥方法的选择略有区别(见表7)。

表6 动物样品的扫描电镜制样干燥方法与研究时间的关系

表7 不同种类动物样品的扫描电镜制样干燥方法

续表7

续表7
线虫最常被用作为研究扫描电镜制样干燥方法的材料。浦卫琼等比较了自然干燥法和临界点干燥法对柑桔寄生线虫的干燥效果,经比较认为用临界点干燥法制样效果较好,虫体表面环纹、侧线、阴门、肛门、交合刺等明显易见,清晰度好[12]。郭素枝等以甘薯茎线虫为材料进行的研究表明,临界点干燥法的可观察率略高于叔丁醇干燥法,但两种方法的制样效果都较好,能获得良好的微形态结构,侧线数目清晰,虫体不皱缩、不变形[8]。李蕾等认为对线虫而言,叔丁醇干燥法的效果比临界点干燥法好[6]。
郭素枝等以节肢动物门生物茧蜂和蚜虫为材料,比较了6 种干燥方法分别对含水量低(酒精浸泡标本、针插标本及蚜虫前胸背板)和含水量高(蚜虫腹部)的昆虫样品的制样效果[5]。结果表明,相同试样采用不同的干燥法,其效果大不相同:①对含水量高的蚜虫腹部,叔丁醇干燥法可与临界点干燥法相媲美,且前者操作更简便,而其他干燥方法会引起虫体变形,只是变形程度有所差异;②对含水量低的蚜虫前胸背板等样品,几种干燥方法均不见变形,建议采用最经济省时的自然干燥法。因此,对于节肢动物门生物来说,含水量低且观察部位相对较硬的样品多采用自然干燥法,而含水量高且较柔软的样品多采用临界点干燥或真空干燥法。
脊索动物门样品采用最多的是临界点干燥法,少数含水量极低且较硬的样品如鳞片、毛发可使用简单的自然干燥法。未找到以脊索动物门样品为材料进行不同干燥方法制样效果研究的文献,因此不知道叔丁醇干燥法与临界点干燥法效果的异同。但叔丁醇干燥法在对鼠红细胞[13]、人干细胞[14]、人杯状细胞[15]、鼠肠粘膜[16-17]等的研究中取得了满意的观察效果。
3 结 语
在进行扫描电镜生物样品制备时,应根据生物样品的特性、观察要求和设备条件来选择采用何种干燥方法。通过以上分析,我们提出以下扫描电镜生物样品干燥方法选择的一般性原则:
(1)对于微生物等微小的生物样品,如果想要操作简便,可以选用自然干燥法或烘干干燥法;如果想要获得较好的效果,建议选用临界点干燥法或真空干燥法。
(2)一般来说,含水量较少、细胞壁和蜡质层较厚的植物组织多采用自然干燥法,而幼嫩、含水分较多的组织则需要选择其他方法。临界点干燥法和叔丁醇真空干燥法几乎适用于各类型的植物样品,但是考虑到操作的复杂性,能使用更简便的干燥方法时一般不选用它们。
(3)临界点干燥法是动物样品的首选干燥方法。考虑到操作的简便性,对于含水量低且观察部位相对较硬的动物样品也可以采用自然干燥法,但是含水量高且较柔软的样品推荐采用临界点干燥或叔丁醇真空干燥法。
[1] 郭素枝. 扫描电镜技术及其应用[M]. 厦门:厦门大学出版社,2006:74-84.
[2] 徐柏森,杨 静. 实用电镜技术[M]. 南京:东南大学出版社,2008:67-71,93-96.
[3] 曹君迈,贝盏临,江 涌,等. 枸杞花蕾扫描电镜制样方法的探讨[J]. 北方园艺,2010,2010(3):30-32.
[4] 孙京田,谢英渤. 生物医学扫描样品制备中几种干燥方法的比较[J]. 实验室研究与探索,1999,18(3):52-55.
[5] 郭素枝,季清娥. 昆虫扫描电镜样品干燥法[J]. 福建农业大学学报,2001,30(2):262-265.
[6] 李 蕾,刘奇志,王玉柱,等. 线虫扫描电镜样品制备技术的比较[J]. 电子显微学报,2008,27(3):255-260.
[7] 钱天乐,周逸卿,邹珍友,等. 微生物扫描电镜样品清洗方法的改进与固定干燥方法比较[J]. 安徽农业科学,2009,37(23):10886-10888.
[8] 郭素枝,章淑玲,陈玉芬,等. 甘薯茎线虫的扫描电镜制样方法[J]. 福建农林大学学报(自然科学版),2005,34(1):43-45.
[9] 孔祥林,骆 荣,刘鲜林,等. 贵阳腐霉菌丝体及无性繁殖阶段的扫描电镜形态学观察[J]. 电子显微学报,2008,27(4):331-335.
[10] 蔡秀珍,刘克明,刘锦辉,等. 凤仙花属两种植物花粉的扫描电镜制样研究[J]. 激光生物学报,2007,16(1):109-111.
[11] 陈新芳,刘春玲,杨秉耀. 五指毛桃花粉扫描电镜样品的制备[J]. 仲恺农业技术学院学报,2004,17(4):55-58.
[12] 浦卫琼,王 扬,喻盛甫,等. 柑桔寄生线虫扫描电镜制样技术比较研究[J]. 电子显微学报,2003,22(6):664-664.
[13] 王响英,吴淑燕,李苏安,等. 叔丁醇脱水干燥法在游离细胞扫描电镜样品制备中的应用[J]. 苏州大学学报(医学版),2005,25(5):834-835.
[14] 路 菊,陶忠芬,黄文琪,等. Cytodex-3 微载体负载人骨髓间充质干细胞的培养及扫描电镜样品的制备与观察[J]. 电子显微学报,2006,25(8):243-244.
[15] 王 丽,闫 静,张连威,等. 杯状细胞扫描电镜的观察[J].电子显微学报,2008,27(4):319-321.
[16] 王响英,吴淑燕,李苏安,等. 叔丁醇干燥微波超快扫描电镜样品的制备方法[J]. 电子显微学报,2005,24(4):443-443.
[17] 张献彩,张 雷. 糖尿病小鼠小肠黏膜扫描电镜的观察[J]. 重庆医学,2011,40(28):2815-2816.

