六味地黄丸含药血清减轻KCl诱导的PC12细胞损伤
王 俊,刘慧慧,陈文娜,柳 春
(辽宁中医药大学1.教务处;2.生理与心理教研室;3.实验中心;4.生物化学教研室,辽宁沈阳 110847)
老年性痴呆是老年期的中枢神经系统进行性慢性疾病,主要临床表现为进行性的记忆能力减退,认知障碍,情感淡漠等。随着我国逐步进入老龄化社会,其发病率也逐年升高。现代医学对于此病尚无很有效的防治措施。中医认为老年性痴呆的发病与“肾虚”密切相关,认为“肾虚髓空”是老年痴呆发病的根本[1]。因此,“补肾”对于预防和治疗老年性痴呆具有重要的意义。本研究选取滋阴补肾的经典名方“六味地黄丸”含药血清,对KCl诱导的损伤细胞进行干预,观察对其乳酸脱氢酶活力的影响,并检测细胞环磷酸腺苷反应元件结合蛋白(cAMP-response element binding protein,CREB)的基因及蛋白表达水平,以探讨六味地黄丸对神经细胞的影响。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级雄性SD大鼠22只,体质量(300~350 g),[北京华阜康生物科技股份有限公司,SCXK(京)2009-0004],随机分为正常组与六味地黄丸干预组。
1.1.2 药品与试剂:六味地黄丸(北京同仁堂科技发展股份有限公司制药厂);MTT(北京鼎国昌盛生物技术有限公司);乳酸脱氢酶测试盒(南京建成生物工程研究所);RT-PCR试 剂 盒、CREB引 物、β-actin引 物和Trizol试剂盒[宝生物工程(大连)有限公司],兔抗大鼠CREB抗体(北京博奥森生物技术有限公司)。
1.2 含药血清的制备
六味地黄丸干预组,以生药浓度为0.75 kg/L水溶液[2],按10 mL水溶液/kg灌胃,每天 2次,正常组给予同体积双蒸水灌胃,连续给药4 d,第5天首次给药1.5 h后腹主动脉取血,静置2 h,2 000 r/min离心10 min后分离血清。经56℃,30 min灭活,0.22 μm滤膜过滤灭菌,-20℃保存备用。
1.3 细胞培养、分组及处理
取对数生长期的PC12细胞(中国科学院上海生命科学研究院生物化学与细胞生物学研究所),浓度为1×105个/mL,培养12 h后,换用无血清的DMEM培养液继续培养12 h后用于实验。细胞分为1)对照组(control):10%正常血清;2)模型组(model):10%正常血清;3)六味地黄丸含药血清组(LW-containing serum,LWCS):10%六味地黄丸含药血清(预保护48 h)。2、3 组经150 mmol/L KCl刺激20 min后,用PBS洗2遍后加入无血清DMEM继续培养6 h。
1.4 指标检测与方法
1.4.1 MTT法测定细胞存活率:不同浓度的KCl及不同作用时间对PC12细胞活力的影响:配置浓度为50、100、150 和200 mmol/L的 KCl,分别损伤10、20 和30 min。按文献[3]方法酶标仪(492 nm)检测。
1.4.2 LDH活性测定:收集细胞上清液,每组测定5个复孔,毎孔20 μL上清液,按照说明书测定450 nm的A值。
1.4.3 RT-PCR法检测细胞CREB mRNA表达:利用Primer Premier 5.0软件设计PCR引物(TaKaRa公司)。CREB1引物序列,上游引物:5'-CTGATTCC CAAAAACGAAGG-3',下游引物:5'-CTGCCCACTG CTAGTTTGGT-3',扩增产物长度为188 bp;β-actin引物序列,上游引物:5'-AGTGCGACGTGGACATCCG-3',下游引物:5'-TGGCTCTAACAGTCCGCCTAG-3',扩增产物长度为295 bp。反应条件:94℃,2 min;94℃,30 s;65℃,30 s;72℃,1 min;72℃,5 min;4℃保存。其中,从94℃,30 s到72℃,1 min为35个循环。扩增产物经1.5%的琼脂糖凝胶电泳,所得条带使用WD-9413B凝胶成像分析仪进行图像分析。用CREB与β-actin的mRNA的吸光度的比值(%)来表达CREB mRNA的相对表达量。
1.4.4 SABC法检测细胞CREB的蛋白表达:细胞爬片,经固定后,1∶100兔抗CREB抗体4℃过夜(阴性用PBS代替),滴加HRP二抗37℃孵育20 min,行常规免疫组化染色。应用BI-2000医学图像分析系统,测定每个视野下的阳性细胞表达的平均吸光度(mean absorbance,MA)值。
1.5 统计学分析
2 结果
2.1 形态学观察
倒置显微镜下,对照组细胞为梭形,细胞间接触紧密,伪足有交错,增值旺盛,折光度强;模型组细胞伪足消失,大部分折光度减弱,部分细胞皱缩、变圆、脱落,漂浮于培养基中;六味地黄丸含药血清组细胞折光度强,细胞增殖旺盛(图1)。
2.2 KCl诱导细胞损伤模型建立
随着KCl的浓度加大及作用时间延长,细胞活力逐渐减弱(表1)。
2.3 各组细胞LDH活力、CREB的基因及蛋白表达变化
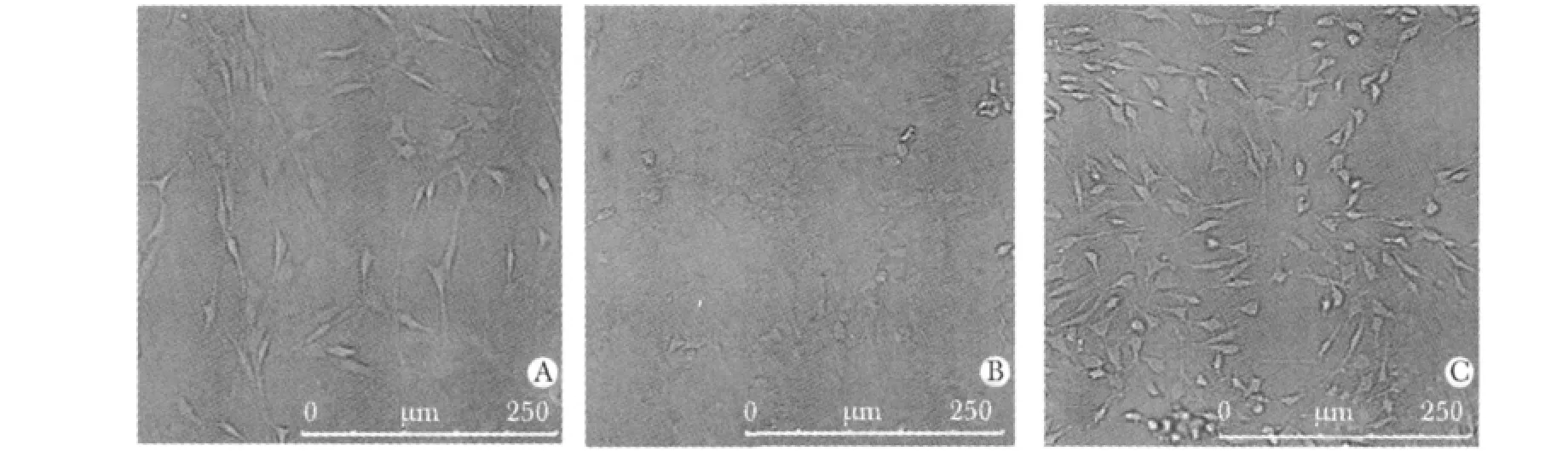
图1 KCl作用各组细胞后形态变化Fig 1 The morphology of cells in each group(×200)
表1 不同浓度的KCl及作用不同时间对PC12细胞活力的影响Table 1 Activity of PC12 cells induced by KCl in different cencentration and different time(±s,A value,n=5)

表1 不同浓度的KCl及作用不同时间对PC12细胞活力的影响Table 1 Activity of PC12 cells induced by KCl in different cencentration and different time(±s,A value,n=5)
*P<0.05 compared with control group.
KCl(mmol/L)10 min 20 min 30 min control 0.3990±0.1133 0.3990±0.1133 0.3990±0.1133 50 0.4005+0.2528 0.3719±0.0135 0.3367±0.0330 100 0.3527+0.5404 0.3409±0.0375 0.2731±0.0347*150 0.3045+0.3860 0.2873±0.0463*0.2447±0.0301*200 0.2857+0.3001 0.2747±0.0175*0.1885±0.0591*
2.3.1 KCl损伤对各组细胞LDH活力的影响:模型组细胞上清液中LDH活力显著增高于对照组(P<0.01),六味地黄丸含药血清组细胞上清液中LDH活力较模型组显著降低(P<0.01)(表2)。
2.3.2 各组细胞CREB与β-actin的mRNA的吸光度比值(%)变化:模型组细胞的CREB mRNA相对表达显著低于对照组(P<0.01);六味地黄丸含药血清组细胞CREB mRNA表达较模型组显著回升(P<0.01)(表2,图2)。
2.3.3 各组细胞CREB蛋白表达的变化:模型组细胞的CREB蛋白表达显著低于对照组(P<0.01);六味地黄丸含药血清组细胞CREB蛋白表达较模型组显著回升(P<0.01)(表2,图3)。
3 讨论
随着年龄的增长,进入老年期,神经元Ca2+调节功能出现紊乱,细胞内Ca2+浓度升高,Ca2+内流增加、线粒体缓冲Ca2+的能力下降等[4]。细胞内Ca2+浓度的持续升高会导致神经元损伤和凋亡。超出细胞生长所需的正常浓度的K+可引起细胞膜电位去极化,膜上电压门控钙通道开放[5],造成细胞内钙超载,本实验结果表明不同浓度的KCl对细胞的损伤程度呈剂量-时间依赖性。通过MTT实验结果筛选最终选取150 mmol/L KCl作为细胞损伤浓度,模拟神经细胞损伤的状态。
表2 各组细胞LDH活力、CREB的基因及蛋白表达变化Table 2 The protein levels of CREB,LDH and the expression of CREB mRNA in each group(±s)
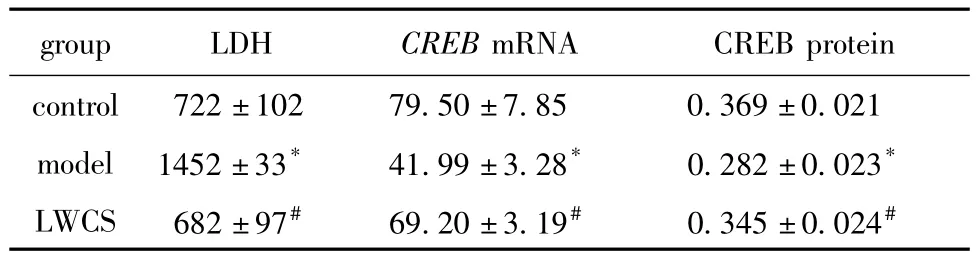
表2 各组细胞LDH活力、CREB的基因及蛋白表达变化Table 2 The protein levels of CREB,LDH and the expression of CREB mRNA in each group(±s)
*P<0.01 compared with control group;#P<0.01 compared with model group.
group LDH CREB mRNA CREB protein control 722±102 79.50±7.85 0.369±0.021 model 1452±33* 41.99±3.28* 0.282±0.023*LWCS 682±97# 69.20±3.19# 0.345±0.024#
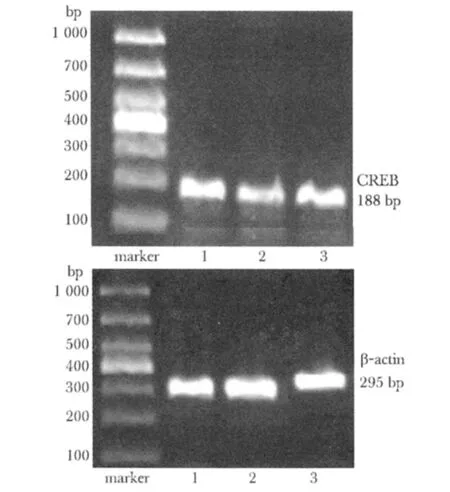
图2 各组细胞CREB及β-actin的mRNA RT-PCR结果Fig 2 The bands of CREB mRNA by RT-PCR in each group
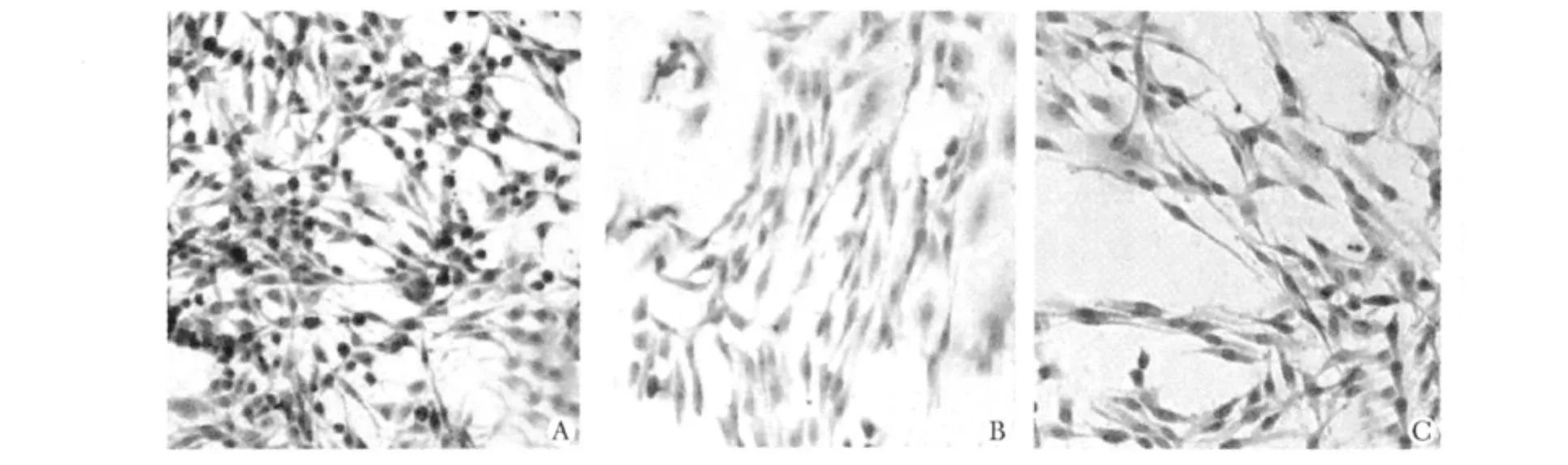
图3 各组细胞CREB免疫组化染色变化Fig 3 The immunohistochemistry stain of CREB in each group(×200)
CREB是真核细胞内核转录调节因子[6],调节基因的转录和蛋白质的合成,因此细胞内CREB表达水平的高低可反映细胞的状态。在神经系统中,CREB作为细胞内多种信号传导通路的重要作用点,通过Ca2+和cAMP等多种信号途径被激活,进而调节下游相关因子的转录,从而影响神经元的存活与生长、突触的可塑性和学习记忆的形成[7]。因此当PC12细胞内钙超载后,细胞内Ca2+信号通路被抑制,细胞内CREB无法被激活,从而影响细胞存活。
中医从“补肾填精”论治老年痴呆有效,已有实验表明六味地黄丸对肾虚型老年痴呆症状具有明显改善作用[8]。现代研究表明六味地黄丸可能通过作用于电压门控离子通道,减小细胞兴奋性时Ca2+由此时入胞内的数量,调节胞内Ca2+浓度及胞内级联反应[9]。本实验结果表明,六味地黄丸含药血清对PC12细胞的影响明显,为六味地黄丸临床应用防治老年痴呆提供了实验依据。但究竟是六味地黄丸中哪些成分发挥作用,或是六味地黄丸是否还通过其他途径影响细胞,有待于进一步研究。
[1]周金黄,刘干中,王建华,等.老年性痴呆的研究进展[M].中药药理与临床,第四册.北京军事医学科学出版社,1996,219-225.
[2]郝艳鹏,张悦,刘煜敏,等.六味地黄丸含药血清对HK-2细胞对TGF-β/Smad信号通路的影响[J].中国病理生理杂志,2011,27:149 -151.
[3]许杰,张蕊,岳云,等.氯胺酮上调 GSK-3β活性加重Aβ25-35诱导的大鼠PC12细胞Tau蛋白过度磷酸化[J].基础医学与临床,2011,31:510 -514.
[4]Ilya Bezprozvanny,Mark PM.Neuronal calcium mishandling and the pathogenesis of Alzheimer's disease[J].Trends Neurosci,2008,31:454 -459.
[5]娄淑杰,王晨光,黄秀英,等.高钾离子引起PC12细胞内游离Ca2+浓度升高的机制[J].第二军医大学学报,1998,19:343 -344.
[6]熊果,马康华.cAMP反应元件结合蛋白(CREB)与细胞凋亡[J].基础医学与临床,2011,31:328-330.
[7]葛军,张玉,郑增长,等.CREB转录因子及其磷酸化信号通路的研究进展[J].安徽农业科学,2010,38:16769-16771.
[8]王红梅,宋彩梅,刘新民,等.六味地黄丸对肾虚型老年痴呆动物模型的改善作用[J].中国实验方剂学杂志,2012,18:112 -114.
[9]杨胜,张永祥.六味地黄汤含药血清对大鼠海马神经元电压门控离子通道的影响[J].中药药理与临床,2002,18:1-2.

