海带多糖纯化及清除自由基活性研究
彭臻菲,方哲翔,刘 敏,张其清,*
(1.福州大学化学化工学院,福建福州 350108;2.福州大学生物和医药技术研究院,福建福州 350002)
海带(Laminaria japonica),又名昆布、江白菜,属褐藻,分布于我国山东、辽宁、浙江、福建等沿海省区,是一种广泛养殖的经济型海藻。我国海带的养殖规模和产量均居世界首位,海带年产量占世界海带年产量的90%。其中,福建省海带养殖产量位居全国首位[1]。我国海带产品主要以初级加工产品为主,海带产品平均单价在600美元/t。而邻国日本则注重开发海带功能保健食品,其海带产品平均单价是中国的3倍[2]。因此,提高海带产品产值,解决制约海带产业发展的高产、低值问题,是推动海带养殖、生产、销售良性健康发展的关键。多糖是海带主要的生物活性物质之一,已有研究发现,海带多糖具有抗氧化、降血脂、抗动脉粥样硬化、降血糖、抗凝血以及抗肿瘤等方面的活性,预示着海带多糖具有开发为药品或功能保健品的潜能[3-7]。但是,目前海带多糖生物活性的研究仍不够系统,很多关于生物活性的报道选用的是纯度低的海带多糖,且缺乏结构分析和活性机制研究。本实验立足福建海带的资源优势,制备纯度较高的海带多糖,对其结构进行分析,并在体外评价其自由基清除活性,为海带功能性产品的研究与开发提供理论研究基础。
1 材料与方法
1.1 材料与仪器
海带多糖 本实验室制备;S-300凝胶填料、葡聚糖Dextran T系列分子量标准品 均购自GE公司;D-木糖、D-半乳糖、D-甘露糖、D-鼠李糖、D-葡萄糖、D-阿拉伯糖、D-岩藻糖 均购自国药集团;D-葡萄糖醛酸 Alfa Aesar公司产品;苯酚、浓硫酸、氯仿、氯化钠、甲醇、PMP、三氟乙酸 均为国产分析纯;乙腈 国产色谱纯。
DBS自动部分收集器、HL2S恒流泵 上海沪西分析仪器有限公司;RE5210A旋转浓缩仪 上海亚荣生化仪器厂;UV1600分光光度计 上海美谱达仪器有限公司;Agilent1100高效液相色谱 美国安捷伦公司;AFZ1001U超纯水系统 艾科浦公司;TP114电子天平 赛多利斯公司;Nexus670红外光谱仪 赛默飞世尔公司。
1.2 实验方法
1.2.1 海带多糖纯化 海带多糖的制备参考文献8。海带干粉经水提醇沉及DEAE-A25粗分后,得到海带多糖粗组分,分别为高、中、低盐组分,其中低盐洗脱组分便于后处理,且具有较高的自由基清除活性[8]。取适量海带多糖低盐粗组分干粉,溶于去离子水,配成浓度为5mg/mL样品溶液。经S-300凝胶层析分离,去离子水洗脱,流速为3mL/10min,苯酚-硫酸法测定各管多糖含量,收集合并各洗脱峰峰尖部分,经浓缩冻干后即得纯化后多糖组分WPS-1-1和 WPS-1-2。
1.2.2 多糖相对分子量测定 取纯化多糖样品,溶于去离子水,微孔滤膜过滤,备用。
色谱条件:色谱柱为TSK-GEL(G5000 PWXL,7.8×300mm),检测器为ELSD800,流动相为去离子水,流速 0.5mL/min,柱温 30℃,进样量 25μL。
1.2.3 多糖的单糖组成测定 采用高效液相色谱法分析多糖的单糖组成,具体方法如下:称取纯化的多糖样品,溶于去离子水配制成25mg/mL样品溶液,量取100μL样品溶液置安瓿瓶中,加入2mol/L三氟乙酸150μL,封口,110℃水解2h。冷却至室温后,加入200μL甲醇,氮气吹干,重复操作2次,以除去未反应的三氟乙酸。加入超纯水溶解水解物后,加入0.6mol/L氢氧化钠溶液和0.4mol/L PMP-甲醇溶液,混匀后,于70℃水浴100min,冷却至室温,0.3mol/L盐酸中和后,氯仿萃取,取水相进行液相色谱分析。
色谱条件:色谱柱为C18柱(Waters Cosmosil C18,4.6 ×250mm i.d.,5μm),流动相为0.1mol/L 磷酸盐缓冲液(pH6.7)-乙腈(83∶17),流速 1mL/min,检测波长254nm,柱温30℃,进样量20μL。
1.2.4 多糖红外光谱测定 取纯化多糖样品5mg,KBr研磨压片后,在4000~500cm-1波数范围内进行红外扫描。
1.2.5 多糖清除自由基活性测定

式中:Ai为样品组吸光值;A0为对照组吸光值。
1.2.5.2 羟自由基(·OH)清除能力测定 利用Fenton反应产生·OH。分别于试管中加入 Tris-HCl缓冲液 1.0mL、番红溶液 1.0mL、蒸馏水 1.0mL、EDTANa2-Fe2+溶液 0.5mL、多糖样品溶液 0.5mL和H2O2溶液0.5mL,混匀,37℃水浴保温30min,冷却至室温后于520nm处测定吸光度。对照组以0.5mL蒸馏水代替待测多糖样品,空白组以1mL蒸馏水代替待测多糖样品和EDTANa2-Fe2+溶液。计算海带多糖对·OH清除率公式:
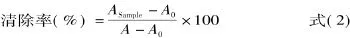
式中:ASample为加入样品后的吸光值;A0为对照组的吸光值;A为空白组的吸光值。
2 结果与讨论
2.1 海带多糖纯化
海带多糖低盐粗组分的纯化结果见图1。海带多糖粗组分经S-300层析分离后得到两个洗脱峰,分别命名为WPS-1-1和 WPS-1-2。其中,多糖洗脱峰WPS-1-1为主要洗脱组分。分别收集两个洗脱峰峰尖部分,经浓缩、冻干,计算多糖洗脱组分WPS-1-1和 WPS-1-2 得率分别为 40%和 16.2%。初步测定1mg/mL浓度下WPS-1-1和WPS-1-2两个洗脱组分对·OH清除活性,发现WPS-1-1对·OH清除率是 WPS-1-2的 2.5 倍。因此,选择 WPS-1-1组分进行多糖结构分析和自由基清除活性研究。

图1 海带多糖S-300洗脱曲线Fig.1 Elusion curve of Laminaria japonica polysaccharide on S-300 chromatography
2.2 多糖纯度鉴定
多糖纯度指的是相似链长多糖分子的平均分布。通常需要采用至少2种方法进行多糖纯度鉴定。本实验分别采用高效液色谱法和琼脂糖凝胶电泳法鉴定多糖纯度。
由图2可知,多糖组分WPS-1-1经高效液相色谱分离后呈单一的对称峰,表明WPS-1-1为均一多糖组分。

图2 WPS-1-1高效液相色谱分析Fig.2 HPLC analysis of WPS-1-1
由图3可知,多糖组分WPS-1-1经琼脂糖凝胶电泳分离后,甲苯胺蓝染色结果显示其呈单一斑点,表明WPS-1-1为均一多糖组分。因此,高效液相色谱和琼脂糖凝胶电泳检测结果均表明,WPS-1-1为均一的多糖组分。

表1 WPS-1-1 单糖组成(%)Table1 Monosaccharide composition of WPS-1-1(%)

图3 WPS-1-1琼脂糖凝胶电泳分析Fig.3 Electrophoresis of WPS-1-1 on a garose gel
2.3 多糖相对分子量测定
取已知分子量的Dextran T系列标准品(分子量分别为10、70、150、500ku)进行高效液相色谱分析,记录各分子量标准品的保留时间。以标准品柱内保留时间为横坐标,相对分子量对数值为纵坐标,绘制分子量标准曲线,回归得其方程为:y=-0.2778x+9.2743(R2=0.9962),其中,y为分子量Mw对数值lgMw,x为保留时间(min)。将测得的 WPS-1-1柱内保留时间为15.207min,代入标准曲线方程,得其相对分子量为112ku。
2.4 多糖的单糖组成测定
海带多糖纯化组分WPS-1-1经酸解、PMP衍生化后,采用高效液相色谱分析,结果见表1。与标准单糖保留时间比对,海带多糖纯化组分WPS-1-1含有甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖和木糖、岩藻糖等单糖。其中,岩藻糖、木糖、半乳糖、甘露糖为主要单糖组分,其摩尔比为 6.9∶3.3∶1.5∶1。
2.5 多糖红外光谱分析
海带多糖纯化组分WPS-1-1红外扫描图谱见图4。红外分析结果显示,多糖纯化组分WPS-1-1具有多糖类物质的特征吸收峰。在3350~3390cm-1之间出现一个宽峰,是糖分子内或分子间氢键伸缩振动结果;2935cm-1附近较弱的肩峰是C-H伸缩振动引起的;1648cm-1的吸收峰为C=O不对称伸缩振动;1410~1420cm-1之间吸收峰是C-H的变角振动;1245~1255cm-1吸收峰与S=O伸缩振动有关,提示硫酸酯基的存在;1000~1200cm-1间的吸收峰是吡喃糖环的醚键和羟基的吸收峰[9]。895cm-1处吸收峰是吡喃糖β-型C-H变角振动,提示WPS-1-1组分含有β-糖苷键。
2.6 多糖清除自由基活性测定
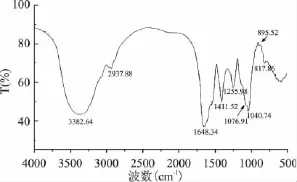
图4 WPS-1-1红外光谱分析Fig.4 FT-IR spectra of WPS-1-1
本实验体外评价了海带多糖纯化组分WPS-1-1的自由基清除活性。由图5a可知,WPS-1-1对清除率与多糖浓度呈正相关。在浓度为0.1mg/mL时,其对清除率为18%,当浓度达到1mg/mL时,其对·清除率达到91.7%,与相同浓度下 VC对清除率相当。WPS-1-1对·OH 清除活性实验结果见图5b。随着 WPS-1-1作用浓度的增大,其对·OH清除活性逐渐增强。当 WPS-1-1浓度为0.5mg/mL时,WPS-1-1 对·OH 清除为30%,当浓度上升至3mg/mL时,其·OH清除率达到92%。前期实验已证明海带多糖低盐粗组分具有自由基清除活性,其对和·OH的最大清除率分别为70%和80%[8]。由此可见,随着海带多糖纯度的提高,多糖的自由基清除活性逐渐增强。本实验测得WPS-1-1对和·OH的IC50分别为0.35和1.0mg/mL,而 VC对的IC50则小于0.1mg/mL,对·OH 的 IC50为 1.81mg/mL。
海藻多糖构效关系研究结果表明,多糖的分子量、硫酸根含量、糖醛酸含量和岩藻糖含量等都与其自由基清除活性有关[14-16]。其中,岩藻糖是海藻多糖主要的结构组成。研究发现,岩藻糖含量越高的海藻多糖,其自由基清除活性越强[17]。由单糖组成分析结果可知,海带多糖纯化组分WPS-1-1主要由岩藻糖、木糖、半乳糖和甘露糖组成,其中岩藻糖含量达到50%,表明WPS-1-1岩藻糖含量可能是影响其自由基清除活性的主要因素之一。此外,红外光谱分析结果显示,WPS-1-1还含有活性基团硫酸基,但其对WPS-1-1自由基清除活性的影响仍有待于进一步研究。

图5 WPS-1-1自由基清除活性Fig.5 Scavenging effects on free radicals of WPS-1-1
3 结论
本实验纯化获得的多糖组分WPS-1-1是分子量为112ku的杂多糖,主要由岩藻糖、木糖、半乳糖和甘露糖组成,其摩尔比为 6.9∶3.3∶1.5∶1。红外光谱分析结果表明,WPS-1-1含有硫酸基,并以β-吡喃糖苷键为主要键型。体外清除自由基活性评价结果表明,WPS-1-1 对和·OH均有较好的清除活性,尤其是对·OH清除活性尤为显著。海带多糖纯化组分WPS-1-1是天然活性多糖,具有良好的生物相容性,其显著的清除自由基活性使其成为功能性自由基清除剂开发的优质资源。
[1]农业部渔业局.中国渔业年鉴[M].2008:230.
[2]程艳,陈丽娇,肖欣欣,等.国内外海带加工现状与福建省的发展对策[J].福建水产,2011,33(2):89-92.
[3]阎俊,罗琼,杨明亮,等.海带多糖抗脂质过氧化作用的研究[J].武汉大学学报,2003,24(3):219-221.
[4]李春梅,高永林,李敏,等.海带多糖对实验性高血脂鹌鹑的降脂及抗动脉粥样硬化作用[J].中药材,2005,28(8):676-679.
[5]X Zhao,S Dong,J Wang,et al.A comparative study of antithrombotic and antiplatelet activities of different fucoidans from Laminaria japonica[J].Thrombosis Research,2012,129:771-778.
[6]L Yu,Y Q Ding,L Liang,et al.Inhibition of growth and metastasis of human colorectal carcinoma cells by laminarin[J].Chin J Clin Rehabil,2003,7(26):3588-3589.
[7]王庭欣,赵文,蒋东升,等.海带多糖对糖尿病小鼠血糖的调节作用[J].营养学报,2001,23(2):137-139.
[8]Z Peng,M Liu,Z Fang,et al.In vitro antioxidant effects and cytotoxicity of polysaccharides extracted from Laminaria japonica[J].International Journal of Biological Macromolecules,2012,50:1254-1259.
[9]M Kaeurakova,P CaPek,V Sasinkova,et al.FT-IR study of Plant cell wall model compounds Peetic Polysaeeharides and hemceelluloses[J].Carbohydrate Polymers,2000,43:195-203.
[10]王云海,罗云敬,钟儒刚.过氧亚硝酸根对蛋白质损伤的研究进展[J].化学进展,2007,19(6):893-901.
[11]H M Shen,C F Yang,W X Ding,et al.Superoxide radicalinitiated apoptotic signaling pathway in selenite-treated HepG2 cells:mitochonaria serve as the main target[J].Free Radical Biology & Medicine,2001,30(1):9-21.
[12]楼兰花,骆红梅.羟自由基诱导心肌细胞损伤时ATP酶等变化[J].中国心血管杂志,2003,8(6):393-397.
[13]G D Smoluk,R C Fahey,J F Ward,et al.Interaction of glutathione and other low-molecular weight thiols with DNA:Evidence for counter ion condensation and colon depletion near DNA[J].Radiat.Res.1998,114:3-10.
[14]H Qi,T Zhao,Q Zhang,et al.Antioxidant activity of different molecular weight sulfated polysaccharides from Ulva pertusa Kjellm(Chlorophyta)[J].Journal of Applied Phycology,2005,17:527-534.
[15]X Zhao,C H Xue,B F Li.Study of antioxidant activities of sulfated polysaccharides from Laminaria japonica[J].Journal of Applied Phycology,2008,20:431-436.
[16]刘承颖,王维民.半叶马尾藻中岩藻聚糖硫酸酯的提取纯化及抗氧化研究[J].食品研究与开发,2008,29(11):71-75.
[17]薛长湖,陈磊,李兆杰,等.岩藻聚糖硫酸酯体外抗氧化特性的研究[J].青岛海洋大学学报,2000,30(4):583-588.

