不同抑制剂和激活剂对菠萝茎蛋白酶酶学特性的影响
赵力超,陈洁兰,王 燕,刘 欣
(华南农业大学食品学院,广东广州 510642)
菠萝茎蛋白酶含有多种不同蛋白水解酶组分,对多种蛋白质及多肽具有催化水解活性,在医药和食品工业上应用广泛[1]。菠萝蛋白酶作为一种生物大分子,与大部分酶一样存在活力不稳定问题,极易受到生产、储存、运输过程中诸多因素影响[2],极大地限制了其生产和应用[3]。因此,其应用领域的基础研究热点在于活性保护剂的研发和分子水平失活机理的阐释。目前对于菠萝蛋白酶失活和激活方面的研究,大多集中于活力影响因素种类和水平、活力保护剂种类和用量等方面的研究[4]。对其在储存和加工应用过程中不同因素造成失活机理、激活机理暂未见系统报道。通过分子构象分析菠萝茎蛋白酶失活、激活机理,对于生产中采用相应的活力保护手段(添加蛋白热稳剂、还原剂、防腐剂、疏水基、巯基保护剂等),使酶在储存和应用过程中的稳定性提高,具有很好的应用指导意义。作者前期已对多种的添加剂对菠萝茎蛋白酶的影响进行了系统研究[5],本文选择其中不同种类的抑制剂和激活剂进行进一步构效关系研究。菠萝茎蛋白酶溶液三级结构的一个重要内容就是其氨基酸残基的微区结构,因为蛋白质的活性部位往往就在这些微区上,芳香氨基酸因常在蛋白质功能方面表现重要作用且便于研究,在氨基酸微区的研究中占有重要地位[6]。菠萝茎蛋白酶由其特定的空间构象决定了其特有的生物功能。溶液构象研究是从宏观上掌握菠萝茎蛋白酶整体结构和了解菠萝茎蛋白酶在生理状态下发挥活性作用时的结构状态的关键。研究抑制剂和激活剂与酶的相互作用,是从分子水平上阐明酶失活和激活机理的基础。本文采用紫外光谱法和CD光谱法,研究不同抑制剂和激活剂对菠萝茎蛋白酶活力、动力学参数及光谱特性等的影响,综合失活和激活两方面的规律,总结菠萝茎蛋白酶构效变化机制,为菠萝茎蛋白酶的工业化应用提供理论基础。
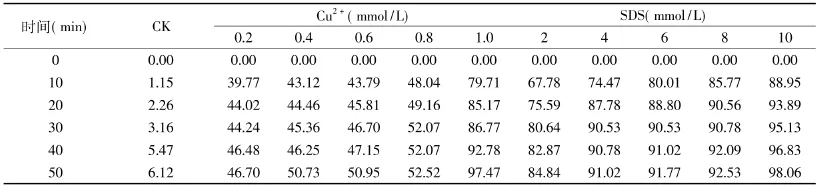
表1 不同浓度抑制剂对菠萝茎蛋白酶酶活的抑制率(%)Table1 Inhibition rate of stem bromelain with different concentrations of inhibitors(%)
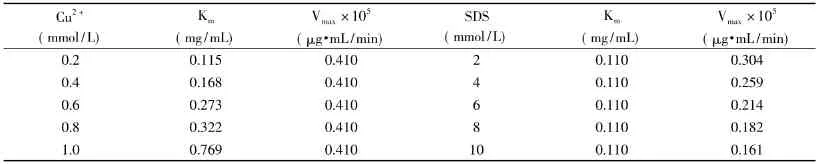
表2 不同浓度抑制剂对菠萝茎蛋白酶的Km和Vmax的影响Table2 Kmand Vmaxof stem bromelain with different concentrations of inhibitors
1 材料与方法
1.1 材料与仪器
菠萝茎蛋白酶 由湛江徐闻县美仑生物制品有限公司提供;其它试剂 均为分析纯。
Jasco 500c型圆二色谱仪 日本Jasco公司;UV-3010紫外可见分光光度计 日本日立公司。
1.2 实验方法
1.2.1 酶活测定 参考施特尔马赫[7]酪蛋白法。
1.2.2 反应动力学测定 酶解动力学利用米氏(Michaelis- Menten)方程计算[8],酶变性速度利用Guggenheim法计算[9],变性速率常数查考邹承鲁法[10]。
1.2.3 紫外差吸收光谱测定 采用紫外-可见分光光度仪检测190~400nm的紫外吸收光谱(双光束,狭缝宽度1.0nm,石英吸收池光径10mm,室温25℃)。结合参比,绘制紫外差吸收光谱。
1.2.4 CD光谱测定 采用圆二色谱仪检测190~240nm的远紫外吸收光谱(100μL液池,光径0.lmm,25℃恒温),数据采集间隔0.5nm,累加4次测量求平均值消除仪器噪音。用仪器附带的Moffit-Yang运算法,计算样品分子中各二级结构的含量。
1.2.5 抑制剂对菠萝茎蛋白酶构象与活力的影响抑制剂选择Cu2+和十二烷基磺酸钠(SDS),Cu2+的终浓度设定为 0.2、0.4、0.6、0.8、1.0mmol/L,SDS 终浓度设定为 2、4、6、8、10mmol/L。测定不同浓度抑制剂存在时菠萝茎蛋白酶以上相关指标;测定紫外差吸收光谱时,处理时间为10min;测定 CD色谱时,固定Cu2+浓度 0.6mmol/Lol/L、SDS 浓度 6mmol/Lol/L,处理时间为10min。酶活抑制率(%)=(对照酶活-各试剂处理后酶活)/对照酶活×100。
1.2.6 激活剂对菠萝茎蛋白酶构象与活力的影响激活剂选择乙二胺四乙酸二钠(EDTA-2Na)、偏重亚硫酸钠(Na2S2O5)、β-巯基乙醇(β-ME),Na2S2O5的终浓度分别为 0.02、0.04、0.06、0.08、0.10mmol/L,EDTA-2Na和 β-ME 的终浓度设定为 0.2、0.4、0.6、0.8、1.0mmol/L。相对酶活 =添加激活剂的酶活/不加激活剂的酶活。
2 结果与讨论
2.1 抑制剂对菠萝茎蛋白酶构象与活力的影响
2.1.1 抑制剂对菠萝茎蛋白酶活力的影响 不同浓度Cu2+和SDS一定时间内对菠萝茎蛋白酶活力的影响情况如表1所示。
由表1可知,在抑制剂作用下菠萝茎蛋白酶活力明显降低,且随抑制剂浓度的升高、作用时间的延长继续降低。在1.0mmol/L Cu2+或10mmol/L SDS存在时,作用50min,酶活基本被全部抑制。
2.1.2 抑制剂抑制类型分析 在含有不同浓度Cu2+和SDS的环境中,菠萝茎蛋白酶Km和Vmax值如表2所示。
由表2可知,Cu2+对菠萝茎蛋白酶的抑制作用为竞争性抑制,最大反应速度Vmax没有变化,而抑制常数Km值随Cu2+浓度的增大而下降。Cu2+的抑制机制可能是因其与菠萝茎蛋白酶催化中心的巯基(E-SH)形成巯醇盐(E-S-Cu)[11]。从而导致酶与底物的可结合性变小,从而导致Km下降。而SDS对菠萝茎蛋白酶的抑制作用为非竞争性抑制,抑制常数Km值没有变化,而最大反应速度Vmax随SDS浓度的增大而下降。Ibel等人[12]提出表面活性剂与蛋白质的作用主要是疏水基与蛋白质发生作用,而阴离子表面活性剂的亲水基端与酶分子可能发生吸附作用。当表面活性剂浓度较高时,与同一酶分子结合的表面活性剂分子数增多,它们之间的相互作用太强亦会破坏酶的活性。同时,由于SDS是一种电解质,因此能通过离子效应减弱维持蛋白质三级结构的静电相互作用。

表3 不同浓度抑制剂对菠萝茎蛋白酶变性与失活速度的影响Table3 Degeneration and inactivation rate constants of stem bromelain with different concentrations of inhibitors
2.1.3 抑制剂对菠萝茎蛋白酶的变性和失活速度的影响 在含有不同浓度Cu2+和SDS的环境中,菠萝茎蛋白酶的变性和失活速度分别如表3所示。
由表3可知,Cu2+和SDS作用下的菠萝茎蛋白酶失活表现出两相变化,快相变化速度是慢相的两个数量级。此外,酶的变性与失活表现为不同步性,快相的失活速度高于变性速度,而慢相的失活速度则低于变性速度。抑制剂作用下菠萝茎蛋白酶的失活表现为快慢两相,这意味着可能存在着变性与失活的多相反应中间过渡态。对于酶反应前期这种快失活慢变构的特征,说明酶的活性部位位于对Cu2+较为脆弱的特殊的构象区域,与整个酶分子比较,对Cu2+更为敏感,其构象的轻微变化迅速地影响到酶的催化活性,这可能涉及维系酶活力中心的次级键牢固程度不同所致[13]。该结论与Cu2+为竞争性抑制剂相一致。而从SDS的快失活慢变构的特征说明,虽然SDS是非竞争性抑制剂,但酶活性部位较整体构象而言更容易受到SDS的影响,使酶活力变化快于其整体构象的变化[6]。
2.1.4 抑制剂对菠萝茎蛋白酶构象的影响 在含有不同浓度Cu2+和SDS的环境中,菠萝茎蛋白酶紫外吸收差光谱图分别如图1和图2所示。根据菠萝茎蛋白酶CD谱图(略),计算出菠萝茎蛋白酶分子中各二级结构的含量,如表4所示。

表4 抑制剂处理后菠萝茎蛋白酶的二级结构含量变化Table4 The percentages of the secondary structure of stem bromelain with inhibitors

图1 不同浓度Cu2+影响下菠萝茎蛋白酶紫外差吸收光谱图Fig.1 UV difference absorption spectra of stem bromelain with different Cu2+concentrations

图2 不同浓度SDS影响下菠萝茎蛋白酶紫外差吸收光谱图Fig.2 UV difference absorption spectra of stem bromelain with different SDS concentrations
由图1和表4可看出,含Cu2+菠萝茎蛋白酶的紫外差吸收光谱变化相对剧烈,在190~330nm出现差吸收负峰,并随着Cu2+离子浓度的增加,吸收峰强度增大,其主要的两个负吸收峰位分别位于202、250nm处,但峰型并不是非常显著。而二级结构中α-螺旋含量显著下降,β-折叠、β-转角、无规卷曲含量都稍提高。推测Cu2+与酶蛋白的结合导致蛋白质二级结构发生明显变化,芳香族氨基酸的位置暴露,更加亲水或者蛋白质分子结构变得更加松散,从而使得Cu2+离子结合后菠萝茎蛋白酶的紫外光谱发生明显变化[14-15]。
由图2可看出,不同浓度SDS处理后菠萝茎蛋白酶的紫外吸收光谱发生明显变化,在196、232nm处出现差吸收负峰,并随着SDS浓度的增大负峰强度增大;在220nm处出现差吸收正峰,且随着SDS浓度的增大正峰强度逐渐减弱;在270~310nm出现宽而扁平的差吸收负峰,也随着SDS浓度的增大负峰强度有增大趋势。酶在 220[6]、232nm[16]处差吸收峰说明了酶的α-螺旋度值的降低,肽链变的松散,酶分子由有序结构变成无规卷曲。Trp在220nm左右有强吸收峰[17],210~230nm 范围内的差光谱正峰的出现反映了色氨酸残基微环境的改变。Fasman[18]认为225~235nm的吸收差变化与芳香族氨基酸和二硫键微环境变化相关,278、286、295nm出现差吸收峰说明酶分子中Tyr、Trp和Phe由深埋在分子内部转移到分子表面的极性环境中,改变程度随SDS浓度增大而扩大。所以,SDS的加入,使菠萝茎蛋白酶的肽链发生去折叠或某种程度的伸展,原来深埋于分子内部的疏水基团暴露出来,其内部的疏水基团或疏水结合点裸露从而使紫外吸收变弱。

表5 菠萝茎蛋白酶在不同浓度激活剂中的相对酶活Table5 Relative enzyme activity of stem bromelain with different concentrations of activators
实验中菠萝茎蛋白酶在2mmol/L SDS溶液中变性达到平衡时紫外光谱未发生大的变化,但酶的活力已丧失约70%。该阶段酶的失活明显早于酶分子整体构象变化,这表明酶的活性部位处于分子中有限的容易被抑制剂扰乱的区域。活性部位结构及有关臂运动的结构与整体构象相比更具柔性。本文结果支持了邹氏酶活性部位的柔性理论。
2.2 激活剂对菠萝茎蛋白酶构象与活力的影响
2.2.1 激活剂对菠萝茎蛋白酶活力的影响 不同浓度EDTA-2Na、Na2S2O5和β-ME一定时间内对菠萝茎蛋白酶活力的影响情况如表5所示。
由表 5可见,在含有 EDTA-2Na、Na2S2O5和β-ME的环境中,菠萝茎蛋白酶活力均出现一定程度的提高,其相对活力均大于1。激活能力由大到小为:Na2S2O5>β-ME>EDTA-2Na。不同浓度激活剂处理菠萝茎蛋白酶,在一定范围内酶活性随激活剂浓度升高而增强,但当激活剂超过一定浓度后,酶活又随着激活剂浓度增大而缓慢降低。这种现象的产生可能是由于适当浓度的激活剂更容易改变酶的构象,使之处于一种活化的状态,内部被氧化的Cys残基能更多地接触到激活剂,酶分子则可以更好地调整构象,使之更有利于催化。而当体系中激活剂浓度超过最佳值时,它对酶构象的改变超出了酶的承受能力,虽然更有利于酶的激活,但有一定破坏作用。
2.2.2 激活剂对菠萝茎蛋白酶构象的影响 在含有不同浓度EDTA-2Na、Na2S2O5及β-ME的环境中,菠萝茎蛋白酶紫外差光谱图分别如图3~图5所示。根据菠萝茎蛋白酶CD谱图(略),计算出菠萝茎蛋白酶分子中各二级结构的含量,如表6所示。

图3 不同浓度EDTA-2Na影响下菠萝茎蛋白酶紫外差吸收光谱图Fig.3 UV difference absorption spectra of stem bromelain with different EDTA-2Na concentrations

图4 不同浓度Na2S2O5影响下菠萝茎蛋白酶紫外差吸收光谱图Fig.4 UV difference absorption spectra of stem bromelain with different Na2S2O5concentrations
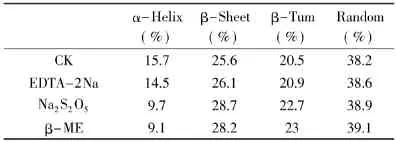
表6 激活剂处理后菠萝茎蛋白酶的二级结构含量变化Table6 The percentages of the secondary structure of stem bromelain with activators
由图3~图5可知,随着激活剂的添加,菠萝茎蛋白酶紫外差吸收峰主要出现在230nm以下,且最大差吸收峰位于197~200nm之间。一般认为230nm以下的差光谱可以反映酶蛋白主链构象的变化,240~300nm范围内的差光谱则是 Trp、Tyr、Phe以及-S-S-的贡献。所以,激活剂作用下菠萝茎蛋白酶分子构象只涉及主链构象的变化,未涉及基团构象的变化,激活剂作用下虽然改变了酶分子的二级结构,但并未造成疏水基团的暴露,酶分子的活性中心仍被疏水基团围绕。因此,酶分子活力得到保持。而抑制剂作用下酶分子的构象变化更为剧烈,二级结构发生松散,疏水基团发生暴露并在230nm产生Phe、Tyr和Trp的吸收峰,从而造成酶分子活力下降。

图5 不同浓度β-ME影响下菠萝茎蛋白酶紫外差吸收光谱图Fig.5 UV difference absorption spectra of stem bromelain with different β-ME concentrations
表6显示,激活剂作用下菠萝茎蛋白酶分子均出现α-螺旋含量下降、β-转角和无规卷曲含量增加,酶分子结构趋向于松散,但其构象的变化并不如添加SDS和Cu2+时剧烈。相反,由于酶分子结构的松散,激活剂更易于进入酶分子的疏水区对已经氧化的巯基进行还原,底物也更易于进入酶分子的疏水裂隙,造就了一种酶分子与底物结合更为容易的状态,使得酶分子被激活。所以,酶的激活现象是有普遍性的,许多酶在一定化学试剂的作用下可以提高活性,这说明酶的天然构象并不一定是其表现活力的最佳构象。酶活性部位柔性假说认为,酶的激活现象“虽然很可能也同时发生了酶分子整体的部分伸展,但活力的提高仍然是由于适当增加了酶活性部位柔性所造成的”[19]。但这种结构的松散并不是越大越好,其存在一个度的问题,与二级结构α-螺旋、β-转角和无规卷曲的变化程度有关。
本文很好验证了这一点,酶分子的激活需要α-螺旋一定程度的下降。EDTA-2Na处理下酶分子α-螺旋下降程度不够(α-螺旋含量由15.7下降到14.5),酶活提高不明显;偏Na2S2O5和β-ME处理下酶分子α-螺旋下降程度较EDTA-2Na大(α-螺旋含量由15.7分别下降到9.7和9.1),其中,Na2S2O5对酶活的提升最明显;继续降低酶分子α-螺旋含量,SDS和Cu2+作用下酶分子α-螺旋含量下降最明显,但却表现出酶活的抑制作用。反观β-转角和无规卷曲也可得出类似结果。这就表明菠萝茎蛋白酶分子的激活和失活均取决于其二级构象的变化程度。
3 结论
本文首次采用紫外差光谱法、CD光谱法并结合酶解动力学、失活动力学等基本数据,综合菠萝茎蛋白酶的失活和激活两方面实验,从构象和活力变化的规律阐述酶的失活及激活机理。研究表明,抑制剂与激活剂作用下菠萝茎蛋白酶CD图谱均表现为α-螺旋度降低,β-折叠、β-转角以及无规卷曲含量的不同程度提高,但抑制剂作用下螺旋降低、折叠与卷曲的升高程度更明显。此外,抑制剂与激活剂作用下菠萝茎蛋白酶的紫外差吸收光谱也显示差异,激活剂作用下主要表现为230nm以下的二级结构变化,而抑制剂除上述变化外,还显示生色基团Trp、Tyr、Phe的暴露,表明抑制剂作用下酶分子构象变化更剧烈。进一步推测:酶分子的天然构象并非其活力表现最适构象,酶分子的适度松散,更有利于激活剂进入活性中心,从而还原巯基,激活酶分子,同时,酶分子的适度松散可能更有利于底物进入活性中心进行催化作用,提高酶分子活力。
[1]Khatoon H,Saleemuddin M.Stem bromelain:An enzyme that naturally facilitates oriented immobilization[J].Protein and Peptide Letters,2007,14:233-236.
[2]王燕,赵力超,陈洁兰,等.菠萝蛋白酶工业化提取工艺的改良及酶学性质研究[J].食品工业科技,2011,32(10):353-357.
[3]吴茂玉,马超,乔旭光,等.菠萝蛋白酶的研究及应用进展[J].食品科技,2008(8):17-20.
[4]Amid A,Ismail N A,Yusof F,et al.Expression,purification,and characterization of a recombinant stem bromelain from Ananas comosus[J].Process Biochemistry,2011,46:2232-2239.
[5]赵力超,王燕,何凤林,等.多糖和添加剂对菠萝茎蛋白酶活力的影响[J].食品科学,2011,32(15):225-229.
[6]王黎明.表面活性剂SDBS、SDS和CTMAB对土壤酸性磷酸酶的影响及机理研究[D].浙江大学,2004.
[7]施特尔马赫.酶的测定方法[Z].北京:中国轻工业出版社,1992:24.
[8] Murachi T,Yasuda Y.Purification and physical characterization of stem bromelain.[J].Biochemistry,1964:48-55.
[9]吴友吉,金盈.Guggenheim法在物理化学实验教学中的应用[J].科技信息,2010(13):564.
[10]邹承鲁.酶活性部位的柔性[J].科学通报,1989,4(5):398-407.
[11]Kamphuis I G,Swarte M B.Structure of papain refined at 1.65 A resolution.[J].Journal of Molecular Biology,1984,179:233-256.
[12]Ibel K,Kirschner K,Mascher E.Protein-decorated micelle structure of sodium-dodecyl-sulfate-protein complexes as determined by neutron scattering.[J].European Journal of Biochemistry,1990,190:311-318.
[13]颜思旭,余卫平.缢蛏两种碱性磷酸酯酶与十二烷基磺酸锂作用过程中构象与活力变化的差异[J].厦门大学学报:自然科学版,1985,21(1):128-132.
[14]林沁瑛,林青松,汪白桦,等.中华猕猴桃蛋白酶在半极性介质中的构象变化和动力学研究[J].厦门大学学报:自然科学版,1993,32(2):210-215.
[15]冯永君,李德舜,孙丽,等.火菇素酪氨酸微区的研究[J].化学学报,2000,58(8):1037-1042.
[16]Glazer A N.Studies on the ultraviolet difference spectra of proteinsand polypeptides[J].The JournalofBiological Chemistry,1961:2943-2947.
[17]陶慰孙.蛋白质分子基础[Z].北京:人民教育出版社,1981:225-247.
[18]Fasman G D,Randall L L.Chaperone SecB:Conformational changes demonstrated by circular dichroism[J].Journal of Protein Chemistry,1995,14:595-600.
[19]邹承鲁 .活性部位的柔性[J].生理科学进展,2001,32(1):7-12.

