特发性肺动脉高压患者外周血内皮祖细胞数量和肺动脉压力的关系研究
张 韩,李彦明,万琪琳,程冠昌,洪 岩,陈君柱
肺动脉高压 (pulmonary artery hypertension,PAH)是一种临床综合征,可由许多心、肺和肺血管疾病引起。特发性肺动脉高压 (idiopathic pulmonary arterial hypertension,IPAH)是PAH的一种,典型的病理改变为后小动脉中膜增厚,内皮细胞呈向心性单克隆性丛样增生[1]。其发生机制不是十分清楚,最近的研究认为和内皮系统的失衡有关,也是本文的研究对象,内皮祖细胞 (endothelial progenitor cells,EPCs)是内皮细胞的前体细胞,参与血管形成内皮损伤后的修复,对于内皮平衡的保持起到一定的作用[2]。本文通过观察28例IPAH患者外周血EPCs数量,分析EPCs与平均肺动脉压力之间的关系,为探讨PAH新的治疗方法提供一定的理论基础。
1 资料与方法
1.1 一般资料 选择2008年1月—2010年6月住院的28例IPAH患者为IPAH组,均参照世界卫生组织2003年的诊断标准,其中男10例,女18例;平均年龄 (33.1±10.4)岁,右心飘浮导管测定肺动脉压力[3]。选择同期健康志愿者20例为对照组,其中男8例,女12例;平均年龄 (2.1±10.1)岁。两组患者均排除糖尿病、肾病、肿瘤、骨折及近期外伤病史者,两组患者性别、年龄具有均衡性。
1.2 方法
1.2.1 肺动脉压力的测定 右心漂浮导管由本院心导管室完成。
1.2.2 EPCs的培养 无菌采集空腹外周血20ml,离心后获取单个核细胞,接种在人培养板上,培养板由连接蛋白 (fibronectin)包被,4d后换液继续培养,7d后进行细胞化学分析。采用激光共聚焦显微镜鉴定FITC-UEA-Ⅰ和 DiI-acLDL双染色阳性细胞,认为是正在分化的EPCs,用倒置相差显微镜下计数EPCs数目。
1.3 统计学方法 应用SPSS13.0统计软件进行数据分析,计量资料以(±s)表示,两组比较采用t检验,以α=0.05(双侧)作为检验水准。相关性分析采用双变量相关分析。
2 结果
2.1 外周血EPCs的鉴定 以梭形黏附细胞作为判断标准,培养4d可出现梭形细胞,7d后梭形的内皮样细胞数较前增加。通过共聚焦显微镜鉴定UEA-Ⅰ和DiLDL双染色阳性细胞被认为是正在分化的EPCs(见图1),在倒置荧光显微镜下计数3个随机选择视野 (×200)的EPCs,IPAH组细胞较对照组明显减少。
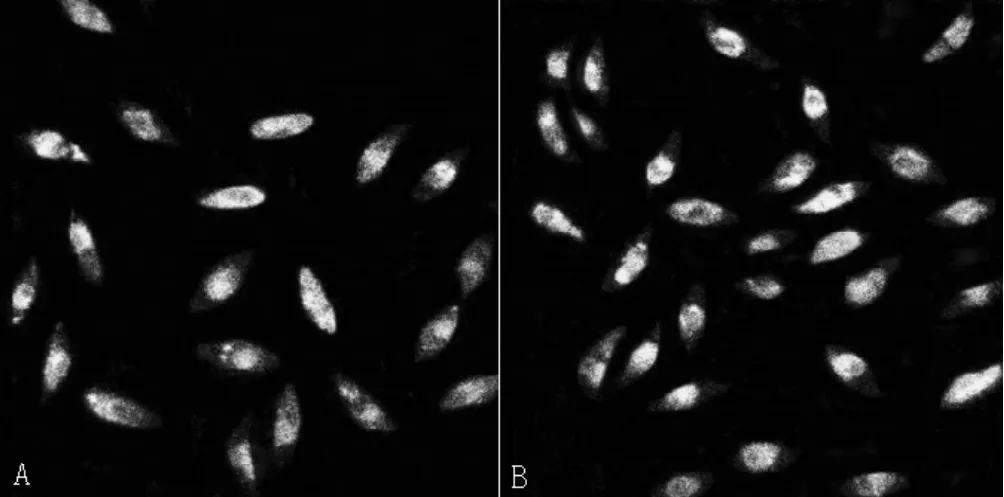
图1 正在分化的EPCsFigure 1 EPCs of the differentiation
2.2 两组外周血 EPCs数量比较 对照组外周血 EPCs为(34.7±7.6) 个,IPAH 组外周血 EPCs为 (61.6 ±10.4) 个,两组外周血EPCs数量比较,差异有统计学意义 (P<0.05)。
2.3 平均肺动脉压力及EPCs水平的相关性分析 28例IPAH患者经右心漂浮导管检查,平均肺动脉压力和外周血EPC数量做相关分析,发现二者呈负相关 (r=-0.625,P<0.001)。
3 讨论
IPAH的典型病理改变为肺血管小动脉中膜增厚,内皮细胞呈向心性单克隆从状增生,内皮细胞增殖紊乱,平滑肌细胞无限增殖,但平滑肌凋亡减少,导致血管中膜增厚,管腔狭窄,肺毛细血管丛状增生,毛细血管内皮损伤和修复不平衡,导致肺毛细血管阻力增加,进而导致肺动脉压力升高,最终引起右心功能不全,导致死亡[4]。
在1997年Asahara等[5]首次发现了EPCs,其特征是表面CD+34或VEGFR-2+阳性,并且在体外能增殖、转化为血管内皮细胞。目前,鉴定EPCs的方法主要有两种[6]:(1)流式方法检测:CD34、Flk-1、vWF和CD133等表面标志阳性的细胞;(2)荧光显微镜双染色鉴定。本研究采用的荧光双染色鉴定EPCs的方法被证实是可靠的,已广泛应用于EPCs的鉴定[7]。
本研究表明,IPAH患者循环血中EPCs数量降低和肺动脉压力呈负相关,提示EPCs数量降低可能减弱EPCs修复内皮细胞功能,EPCs在PAH形成过程中起一定的作用。本研究发现,IPAH确诊时肺动脉平均压力80%都 >40mmHg(1mmHg=0.133kPa),属于3级PAH阶段,可能在发病早期,由于患者症状轻及医护人员的认识不足导致延误诊断。因此,寻找一些简单的客观指标显得特别重要,本研究结果提示外周血EPCs数量可能对诊断IPAH有一定的帮助。
1 Cool CD,Stewart JS,Werahera P,et al.Three-dimensional reconstruction of pulmonary arteries in plexiform pulmonary hypertension using cell-specific marlcer:evidence for a dynamic and heterogeneous process of pulmonary endothelial cell growth [J].Am J Pathol,1999,155:411-419.
2 Suzuki T,Nishida M,Futami S,et al.Neoendothelialization after peripheral blood stem cell transplantation in humans.A case report of a Tokaimura nuclear accident victim [J].Cardiovasc Res,2003,58:487-492.
3 Teichert-Kuliszewska K,Kutryk MJ,Kuliszewski MA,et al.Bone morphogenetic protein receptor-2 signaling promotes pulmonary arterial endothelial cell survival:implications for loss-of-function mutations in the pathogenesis of pulmonary hypertension [J].Circ Res,2006,98:209-217.
4 Rhodes CJ,Howard LS,Busbridge M,et al.Iron deficiency and raised hepcidin in idiopathic pulmonary arterial hypertension:clinical prevalence,outcomes,and mechanistic insights[J].Am Coll Cardiol,2011,58(3):300-309.
5 Asahara T,Murohara T,Sullivan A,et al.Isolation of putative endothelial progenitor cells for angiogenesis [J].Science,1997,275(5302):964-967.
6 Heilmann C,Beyersdorf F,Lutter G.Collateral growth:cells arrive at the construction site [J].Cardiovasc Surg,2002,10(6):570-578.
7 Evis H,Bu DX,Barry IH,et al.Vascular and inflammatory stresses mediateatherosclerosis via RAGE and its ligands in apoE-/-mice[J].J Clin Invest,2008,118(1):183-194.

