基于亚甲基蓝二氧化硅纳米颗粒的细胞与活体成像*
周 冰,王玉双,杨淑娜,何晓晓,王柯敏
(湖南大学生物学院,化学生物传感与计量学国家重点实验室,湖南大学化学化工学院,生物纳米与分子工程湖南省重点实验室,湖南 长沙 410082)
在各种组织和器官都保持完整的状态下有效地观察肿瘤细胞进入体内的分布、迁徙等生物学行为离不开细胞标记和体内示踪技术,这对于临床医学上肿瘤的判断、治疗和手术等有着重要的意义.在各种细胞标记及活体示踪技术中,荧光成像技术因其非侵入性及可重复性的特点而成为越来越多的研究者选择的细胞标记及体内示踪的方法[1].传统的细胞体内成像主要依靠一些有机荧光染料,如荧光素异硫氰酸酯(FITC)、吲哚类菁染料等,它们由于具有较差的光稳定性及半衰期短等缺点,从而在进行高灵敏检测及较长时间的细胞体内成像研究中受到限制.发展合适的标记成像探针已成为当前细胞标记与体内成像研究的热点之一.
随着纳米技术的发展,基于功能化荧光纳米材料的标记技术为细胞和活体标记示踪研究提供了新的思路.目前标记、示踪细胞和活体研究最多的纳米材料主要有量子点[2]、荧光纳米颗粒[3]等.相对于传统荧光染料而言,量子点具有较好的量子产率、大的Stokes位移、好的抗光漂白能力与组织穿透力[4].但是,使用量子点进行活体成像的最大挑战在于量子点长期毒性的不确定性[5].二氧化硅荧光纳米颗粒因合成过程更为简便,对细胞的毒性要弱,生物相容性更好,可作为药物载体达到细胞治疗的目的等优势成为一种理想的成像探针并已经在生物医学成像研究中得到广泛应用[6].如本研究小组在二氧化硅荧光纳米颗粒的制备和应用研究方面开展了系统的工作.利用油包水反向微乳液方法成功制备出多种包裹不同荧光染料(如RuBpy,Cy5.5和FITC等)的二氧化硅荧光纳米颗粒,这些纳米颗粒在分子和细胞层面的成像和检测中得到了很好的应用[7-10].然而,针对活体这个特殊的研究对象,由于动物体在可见光的激发下自身组织会有较强背景荧光,严重干扰目标探针信号的准确度和灵敏度,而在近红外光区,生物组织对光的吸收较少,光的组织穿透力强,成像信背比相对较高[11-12],从而使得近红外二氧化硅荧光纳米颗粒成为细胞标记与活体成像的理想材料之一.
目前所报道的包裹近红外荧光染料种类较少而成本相对较高,亚甲基蓝是一种廉价的近红外染料,并且已用于生物样品的荧光分析中[13].本文采用反相微乳液法,制备以亚甲基蓝为内核材料的亚甲基蓝二氧化硅纳米颗粒,通过优化亚甲基蓝的包裹浓度获得荧光信号较强的纳米颗粒.通过MTT实验来考察颗粒对细胞的毒性效果以及较为适宜的标记细胞的浓度.利用激光共聚焦显微镜来考察Hela细胞对颗粒的吞噬情况以及颗粒在细胞内的分布情况,在此基础上,进一步通过活体荧光成像系统考察颗粒体内示踪成像的可行性.
1 实验部分
1.1 试剂及仪器
二甲基亚砜(DMSO,北京,鼎国公司);正硅酸乙酯(TEOS,广东汕头市西陇化工厂);Triton X-100(上海生物工程有限公司);环己烷、正己醇(上海化学试剂公司);亚甲基蓝(美国,sigma公司);戊巴比妥钠(美国,sigma公司);LysoTracker Green DND 26(美国,Invitrogen公司);RPMI 1640无血清培养基(美国,GIBCO公司);实验用水为超纯水(18.2MΩ);PBS缓冲液、D-Hank’s液均为自配;宫颈癌细胞系(Hela)由本实验室细胞中心提供.
高速离心机(日本,Hitachi公司);透射电子显微镜(日本,JEOL公司);酶联免疫检测仪(美国,Bio-Rad公司);细胞培养箱(美国,Nuair公司);扫描激光共聚焦显微 镜 (日 本,Olympus 公 司);Malvern Zetasizer 3000HS粒度分析仪(英国,Malvern公司);Maestro CRI荧光活体成像仪(美国,Maestro公司).
1.2 实验方法
1.2.1 亚甲基蓝二氧化硅纳米颗粒的制备
包裹亚甲基蓝的二氧化硅纳米颗粒是根据文献报道的油包水反相微乳液法进行制备[14],即将环己烷(7.5mL)、正己醇(1.6mL)和 Triton X-100(1.8 mL)混合,搅拌5min至澄清,然后加入480μL一定浓度的亚甲基蓝水溶液作为分散相,常温下搅拌30min,形成油包水的微乳液体系,随后加入一定量的浓氨水和正硅酸乙脂,室温反应24h.反应结束后用无水乙醇破乳,离心收集颗粒,然后用无水乙醇和水分别洗涤数次后,将颗粒分散在超纯水中,于室温下暗处储存备用.
1.2.2 亚甲基蓝二氧化硅纳米颗粒的吸收光谱和荧光光谱测定
采用紫外可见分光光度计分别测定了纯亚甲基蓝溶液和亚甲基蓝二氧化硅纳米颗粒的吸收光谱情况.采用活体荧光成像仪测定了亚甲基蓝二氧化硅纳米颗粒的荧光发射光谱及荧光成像图.
1.2.3 亚甲基蓝包裹浓度的优化
为优化亚甲基蓝溶液的最佳包裹浓度使颗粒的荧光强度达到最高,在反应体系中分别加入2mg/mL,2.5mg/mL,3mg/mL,3.5mg/mL,4 mg/mL和5mg/mL的亚甲基蓝溶液制备得到包裹不同浓度的亚甲基蓝二氧化硅纳米颗粒.利用活体荧光成像仪测定包裹不同亚甲基蓝浓度的亚甲基蓝二氧化硅纳米颗粒的整体荧光成像图.
1.2.4 亚甲基蓝二氧化硅纳米颗粒的浓度测定
采用差量法对制备的亚甲基蓝二氧化硅纳米颗粒进行定量.具体操作如下:(a)首先将一个干净的1.5mL离心管置于烘箱内烘干过夜,称其重为W1(mg),然后每天称重一次直至其重量不再变化为止,记为W2(mg);(b)将制备出的亚甲基蓝二氧化硅纳米颗粒悬浮液混合均匀后,取200μL加入到已知重量的小离心管中,称重后记为W3,然后将离心管放置于真空冷冻干燥仪中进行冷冻干燥,干燥后的重量记为W4(mg).则荧光纳米颗粒的浓度可用下述公式来计算:

1.2.5 亚甲基蓝二氧化硅纳米颗粒的电镜和电势表征
采用透射电子显微镜对亚甲基蓝二氧化硅纳米颗粒的大小和形貌进行表征 .具体步骤为:将亚甲基蓝二氧化硅纳米颗粒悬浮在适量超纯水中,超声分散后,将颗粒水溶液滴加在福尔马膜铜网上,自然干燥后用透射电子显微镜观察拍照.同时用Zeta电位粒度仪测量二氧化硅荧光纳米颗粒的表面电势,具体步骤为:亚甲基蓝二氧化硅纳米颗粒悬浮液按仪器测定浓度范围进行稀释,再置于超声波中超声分散后进行测定.
1.2.6 亚甲基蓝二氧化硅纳米颗粒的细胞毒性考察
通过MTT实验考察一系列浓度(0.1mg/mL~2 mg/mL)亚甲基蓝二氧化硅纳米颗粒对Hela细胞的毒性作用.MTT实验原理为:活细胞线粒体中的琥珀酸脱氢酶能够代谢还原MTT,同时在细胞色素C的作用下,生成蓝紫色不溶于水的甲臜,甲臜的生成量与活细胞数成正比,加入二甲基亚砜(DMSO)溶解甲臜后可以用酶标仪在570nm处进行测定,利用所测吸光度推算出活细胞的数目.具体操作步骤为:收集对数期的Hela细胞以每孔5 000~10 000个细胞的密度接种于96孔板中,每孔体积200μL,然后置于细胞培养箱中培养.待细胞贴壁生长24h后取出96孔板,向其中加入已灭菌的二氧化硅荧光纳米颗粒(初始浓度约12mg/mL),使其在Hela细胞培养液中的最后浓度分别为0.1,0.2,0.4,0.8,1,1.6,2mg/mL.待颗粒与培养液充分混匀后将96孔板放入细胞培养箱中继续培养,荧光纳米颗粒与Hela细胞共孵育24h后取出培养板,在每孔中加入10μL 5mg/mL的MTT,放入细胞培养箱中继续培养4h,然后取出96孔板并快速取出孔内液体,再每孔加入150μL DMSO,置于酶标仪中震荡反应10min后测定其在570nm处的吸光度值.每个浓度梯度设5个重复孔,实验重复3次.采用细胞存活率来体现不同浓度纳米颗粒对细胞毒性的大小:

1.2.7 亚甲基蓝二氧化硅纳米颗粒用于活体成像
在颗粒进行Hela细胞示踪成像之前,首先对颗粒的活体荧光成像情况进行考察.具体步骤为:取两组裸鼠,每只裸鼠在实验时,肌肉注射50μL的异丙嗪,30min后再按照80mL/20g剂量进行腹腔注射浓度为2%戊巴比妥钠,等到完全麻醉后从尾静脉注射12.5mg/mL的亚甲基蓝二氧化硅纳米颗粒200μL,取不同的时间点对小鼠进行活体成像,观察体内荧光分布变化情况.活体成像系统采用635nm的红光激发,680nm~800nm收集,曝光时间1 000 ms.(所有动物实验操作均遵守湖南省实验动物中心实验动物使用和保护规章制度,许可证:NO.SYXK(湘)2008-0001).共重复3次.取第2组裸鼠作为对照,不注射亚甲基蓝二氧化硅纳米颗粒,重复3次.实验中所使用的裸鼠均为4~6周龄,体重在15~20g之间,裸鼠用屏蔽的动物隔离器饲养,温度控制在28℃左右,湿度在40%左右,饲养条件完全按照裸鼠饲养条件进行饲养.
为了对活体荧光成像结果的准确性进行证实,在尾静脉注射亚甲基蓝二氧化硅纳米颗粒90min后对裸鼠进行解剖,取出其部分器官进行荧光成像.将未注射的裸鼠同时解剖作为对照,同样对解剖后的裸鼠和取出的相应器官进行荧光成像.器官的摆放按照从上到下、从左至右的顺序依次为:无食物残渣的小肠、膀胱、肾脏、脾脏、心脏、肺、皮肤、肝脏、肌肉、含食物残渣的大肠.
为了进一步验证活体荧光成像结果,对裸鼠、亚甲基蓝二氧化硅纳米颗粒、裸鼠饲料同时进行活体荧光成像考察.活体成像系统采用615~665nm的红光激发,680~800nm收集,曝光时间200ms.
2 结果与讨论
2.1 亚甲基蓝二氧化硅纳米颗粒的制备及亚甲基蓝浓度的优化
通过反相微乳液法制备了亚甲基蓝二氧化硅纳米颗粒.为了考察亚甲基蓝是否包裹进二氧化硅纳米颗粒内,采用紫外可见分光光度计来考察纯亚甲基蓝染料和亚甲基蓝二氧化硅纳米颗粒在水相中的吸收光谱,采用活体成像仪测定亚甲基蓝二氧化硅纳米颗粒的荧光发射光谱.结果如图1所示,纯亚甲基蓝染料的紫外最大吸收峰约为650nm,制备成亚甲基蓝二氧化硅纳米颗粒的最大吸收峰蓝移至620 nm左右,没有很大改变.通过对颗粒的荧光发射光谱测定可以看出,亚甲基蓝二氧化硅纳米颗粒的最大发射峰大约在710nm.这些吸收峰和发射峰都在近红外区域,说明已成功制备了亚甲基蓝二氧化硅纳米颗粒.这为能更灵敏的进行细胞标记和活体示踪成像奠定了一定的基础.从颗粒的荧光成像图可以看出亚甲基蓝二氧化硅纳米颗粒具有较强的荧光强度.此结果表明亚甲基蓝二氧化硅纳米颗粒能够为体内示踪成像提供较好的荧光信号.
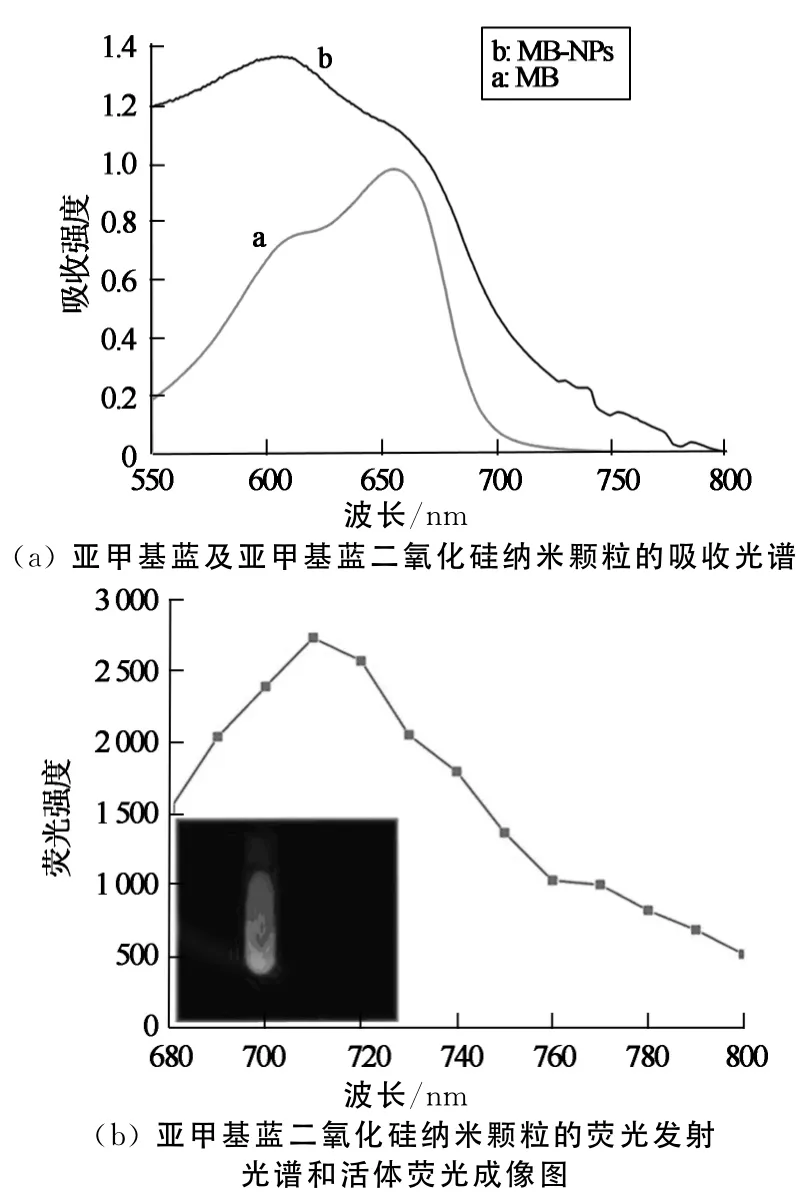
图1 颗粒的光谱性和荧光成像图Fig.1 The spectroscopic properties and fluorescence images of the nanoparticles
亚甲基蓝虽然有荧光但是其荧光量子产率不是很高,并且容易发生荧光自淬灭.为了获得荧光信号较强的亚甲基蓝二氧化硅纳米颗粒,对亚甲基蓝的包裹浓度进行了优化.活体荧光成像结果如图2所示,随着亚甲基蓝包裹浓度的不断增大,颗粒溶液的荧光强度呈先增强后逐渐减弱的趋势.颗粒溶液的荧光信号开始逐渐增强是因为亚甲基蓝浓度的增大,而随着亚甲基蓝浓度的进一步增强,颗粒内包裹的亚甲基蓝分子越来越多,分子间的距离越来越近,荧光自淬灭效应增强从而导致信号的减弱.从图中也可以看出,当亚甲基蓝溶液的浓度为3mg/mL时,颗粒的荧光信号最强,所以亚甲基蓝的包裹浓度确定为3mg/mL.
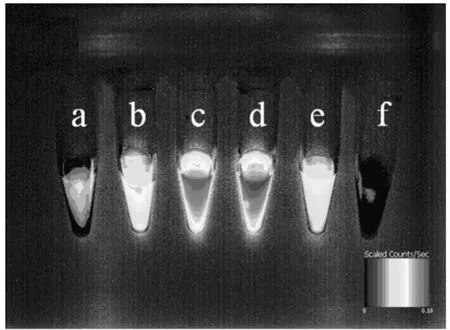
图2 亚甲基蓝二氧化硅纳米颗粒的活体荧光图Fig.2 The fluorescence images of prepared MB-SiNPs
2.2 亚甲基蓝二氧化硅纳米颗粒电镜和电势表征
利用透射电子显微镜(TEM)对制备的荧光信号最强的亚甲基蓝二氧化硅纳米颗粒的大小和形貌进行了表征,结果如图3所示.从图中可以看出颗粒的大小均匀、分散性好、粒径约73nm,呈明显球形.Zeta电位粒度仪分析结果表明,亚甲基蓝二氧化硅纳米颗粒的表面电势为-28.9mV.
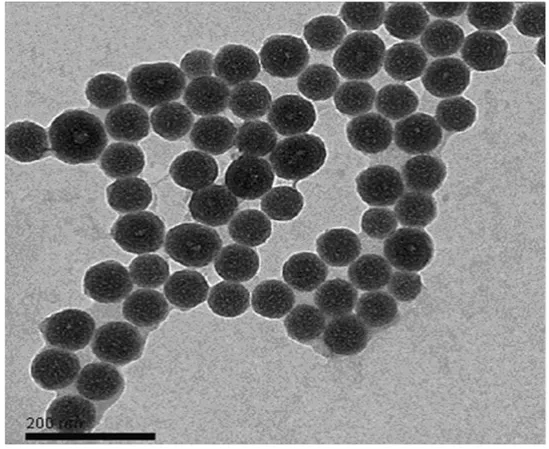
图3 亚甲基蓝二氧化硅纳米颗粒的透射电子显微镜图Fig.3 The transmission electron microscope(TEM)images of prepared MB-SiNPs.
2.3 亚甲基蓝二氧化硅纳米颗粒的细胞毒性考察
亚甲基蓝二氧化硅纳米颗粒对Hela细胞的毒副作用主要通过细胞的存活率来考察.结果如图4所示:在亚甲基蓝二氧化硅纳米颗粒与Hela细胞共孵育24 h后,当颗粒的浓度为1mg/mL时,细胞存活率仍在80%左右.随着颗粒浓度的增大,细胞的存活率逐渐降低,颗粒对细胞产生了一定的毒性.此结果表明:亚甲基蓝二氧化硅纳米颗粒对Hela细胞的毒性作用存在一定的浓度依赖性,毒性强度随着颗粒浓度的增大而逐渐增强,但是当与Hela细胞作用的颗粒浓度在1mg/mL范围内时,细胞存活率都维持在80%以上,因此可以用浓度为1mg/mL的亚甲基蓝二氧化硅纳米颗粒来对细胞进行标记实验.

图4 不同浓度的亚甲基蓝二氧化硅纳米颗粒对Hela细胞存活率的影响Fig.4 The cell viability assay of Hela in the presence of different concentrations of MB-SiNPs using MTT assay
2.4 亚甲基蓝二氧化硅纳米颗粒用于Hela细胞荧光成像
为了考察亚甲基蓝二氧化硅纳米颗粒是否可以作为Hela细胞的标记物,考察了Hela细胞对亚甲基蓝二氧化硅纳米颗粒的吞噬情况以及颗粒在细胞内的分布情况.如图5所示,亚甲基蓝二氧化硅纳米颗粒能够被Hela细胞吞噬,并且摄取大量颗粒后的Hela细胞依然能够保持较好的细胞形态.采用溶酶体标记物对溶酶体进行标记,结果发现,亚甲基蓝二氧化硅纳米颗粒的荧光信号能够与溶酶体标记物的荧光信号共定位,表明纳米颗粒会被Hela细胞摄取,主要分布在溶酶体部位.以上结果表明,亚甲基蓝二氧化硅纳米颗粒可以作为Hela细胞的有效标记物.

图5 Hela细胞对亚甲基蓝二氧化硅纳米颗粒的吞噬情况Fig.5 Confocal laser scanning microscopy(CLSM)images of Hela cells after incubated with MB-SiNPs
2.5 亚甲基蓝二氧化硅纳米颗粒用于活体荧光成像
为了考察亚甲基蓝二氧化硅纳米颗粒是否可以作为体内示踪剂,首先考察了没有标记细胞的纯亚甲基蓝二氧化硅纳米颗粒的荧光活体成像情况.将一定量的亚甲基蓝二氧化硅纳米颗粒从尾静脉注射入裸鼠体内,然后对其在裸鼠体内的成像效果进行考察.结果如图6,以没有注射亚甲基蓝二氧化硅纳米颗粒的裸鼠荧光情况作为信号对照,注射亚甲基蓝二氧化硅纳米颗粒10min后,随着全身血液循环,裸鼠全身都发射出荧光信号,然后信号慢慢聚集在肝脏等器官中.这一结果说明亚甲基蓝二氧化硅纳米颗粒具备进行活体荧光成像的可行性.但是从对照图(0min)可以看出,即使未注射亚甲基蓝二氧化硅纳米颗粒,裸鼠腹腔部位也有着明显的信号,降低了成像的灵敏度.
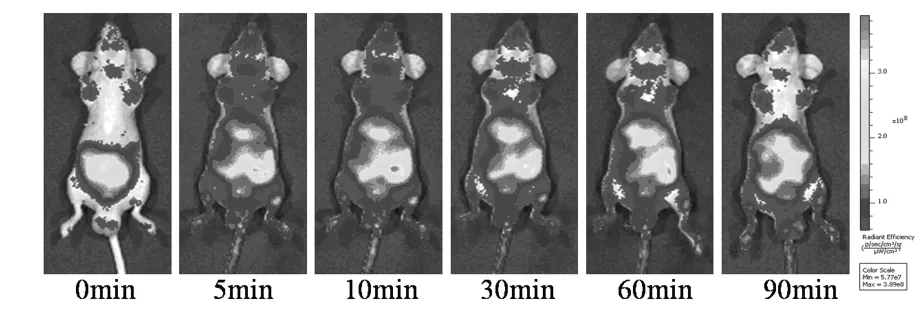
图6 尾静脉注射亚甲基蓝二氧化硅纳米颗粒的实时活体荧光成像图Fig.6 Real-time in vivo abdomen imaging of nude mice intravenously injected with MB-SiNPs
为进一步考察活体荧光成像结果以及裸鼠腹腔荧光信号的来源,我们将注射了亚甲基蓝二氧化硅纳米颗粒后90min的老鼠进行解剖,并得到解剖器官的荧光成像图.如图7(A)所示,在器官成像图中,从左至右、从上至下依次为无食物的小肠、膀胱、肾脏、脾脏、心脏、肝脏、皮肤、肺、肌肉、带食物的大肠.从图7(A1-A2)中可以看出,注射亚甲基蓝二氧化硅纳米颗粒后解剖器官中肝脏和脾脏有着明显的荧光信号,这一结果证明了活体荧光成像的准确性.但是从图7(A3)中可以看到大肠也有着很强的荧光信号.基于此结果,我们猜测对照裸鼠腹部的荧光信号主要来自于裸鼠的食物.为了证实这一猜测,我们对裸鼠,亚甲基蓝二氧化硅纳米颗粒及裸鼠饲料进行了活体荧光成像.结果如图7(B)所示,裸鼠腹部有很强的荧光信号,而裸鼠饲料的荧光信号强度跟我们制备的颗粒的荧光强度性质类似,这说明了裸鼠食物也是可以被红光激发而发射出近红外光信号.这一结果证实了前面的假设,对照裸鼠腹部的强荧光信号来自于食物.
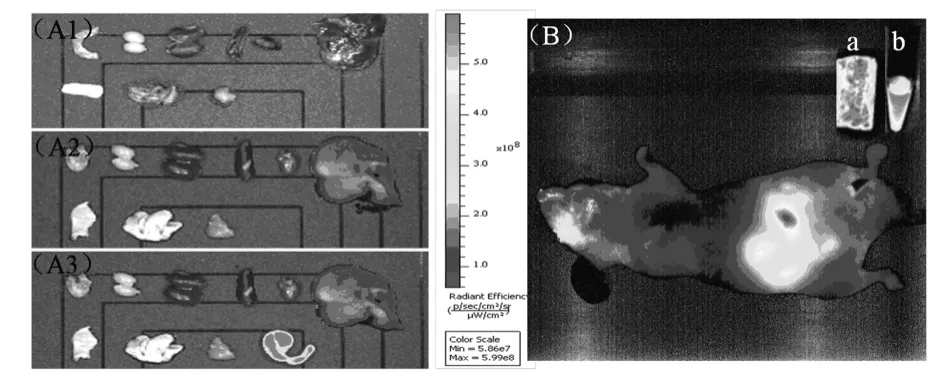
图7 (A)未注射(A1)与注射了(A2,A3)亚甲基蓝二氧化硅纳米颗粒的裸鼠离体器官成像图;(B):裸鼠自发荧光成像图.a:裸鼠饲料;b:亚甲基蓝二氧化硅纳米颗粒Fig.7 (A)Ex vivo imaging of dissected organs from the nude mice without(A1)and with(A2,A3)injection of MB-SiNPs;(B)Autofluorescence imaging of nude mice.a:the mouse chow;b:MB-SiNPs
基于以上的实验结果,可以得出本文制备的亚甲基蓝二氧化硅纳米颗粒可以用于细胞标记及体内示踪成像,但要想进行高灵敏的荧光成像,必须要解决裸鼠食物荧光信号对目标信号的干扰.因此在设计近红外荧光探针来进行细胞标记及活体成像研究中,不仅要考虑降低可见光区裸鼠的组织自发荧光还要考虑降低近红外光区裸鼠食物的荧光信号.
3 结 论
本文通过优化亚甲基蓝的包裹浓度获得了荧光信号较强的亚甲基蓝二氧化硅纳米颗粒,并初步考察了该颗粒的Hela细胞标记成像和活体荧光成像.结果表明,包裹亚甲基蓝的二氧化硅纳米颗粒可以用于细胞标记和体内示踪成像.但是由于在相同的成像条件下,裸鼠食物的荧光信号也很强,干扰了成像的灵敏度.因此,发展一种能同时克服裸鼠组织自发荧光与裸鼠食物荧光信号的成像探针对于进行高灵敏的细胞标记及体内示踪成像具有重要的意义,这有待于进一步的研究.
[1]WEISSLEDER R,PITTET M J.Imaging in the era of molecular oncology[J].Nature,2008,452(7187):580-589.
[2]MICHALET X,PINAUD F,BENTOLILA L,etal.Quantum dots for live cells,invivoimaging,and diagnostics[J].Science,2005,307(5709):538-544.
[3]PENG J,WANG K,TAN W,etal.Identification of live liver cancer cells in a mixed cell system using galactose-conjugated fluorescent nanoparticles[J].Talanta,2007,71(2):833-840.
[4]GU Y P,CUI R,ZHANG Z L,etal.Ultrasmall near-infra-red Ag2Se quantum dots with tunable fluorescence forinvivoimaging[J].Journal of the American Chemical Society,2012,134(1):79-82.
[5]DERFUS A M,CHAN W C W,BHATIA S N.Probing the cytotoxicity of semiconductor quantum dots[J].Nano Letters,2004,4(1):11-18.
[6]BAGWE R P,HILLIARD L R,TAN W H.Surface modification of silica nanoparticles to reduce aggregation and nonspecific binding[J].Langmuir,2006,22(9):4357-4362.
[7]HE X X,CHEN J,WANG K M,etal.Preparation of luminescent Cy5doped core-shell SFNPs and its application as a near-infrared fluorescent marker[J].Talanta,2007,72(4):1519-1526.
[8]何晓晓,王柯敏,谭蔚泓,等.基于生物荧光纳米颗粒的新型荧光标记方法及其在细胞识别中的应用[J].科学通报,2001,46(16):1353-1356.HE Xiao-xiao,WANG Ke-min,TAN Wei-hong,etal.A novel f1uorescent label based on biolocal fluorescent nanoparticles and its application in cell recognition[J].Chinese Science Bulletin,200l,46(23),1962-1965.(In Chinese)
[9]段菁华,王柯敏,谭蔚泓,等.新型有机荧光染料嵌合的核壳荧光纳米材料的研制[J].高等学校化学学报,2003,24(2):255-259.DUAN Jing-hua,WANG Ke-min,TAN Wei-hong,etal.A study of a novel organic fluorescent core-shell nanoparticle[J].Chemical Journal of Chinese Universities,2003,24(2):255-259.(In Chinese)
[10]原茵,何晓晓,王柯敏,等.嵌合异硫氰酸罗丹明B核壳荧光纳米颗粒制备的新方法研究[J].高等学校化学学报,2005,26(3):446-446.YUAN Yin,HE Xiao-xiao,WANG Ke-min,etal.New method for preparing core-shell fluorescent nanoparticles doped with rhodamine B isothiocyanate[J].Chemical Journal of Chinese Universities,2005,26(3):446-446.(In Chinese)
[11]LEBLOND F,DAVI S C,VALDES P A,etal.Pre-clinical whole-body fluorescence imaging:Review of instruments,methods and applications[J].Journal of Photochemistry and Photobiology B:Biology,2010,98(1):77-94.
[12]ACHILEFU S.The insatiable quest for near-infrared fluorescent probes for molecular imaging[J].Angewandte Chemie International Edition,2010,49(51):9816-9818.
[13]DENG T,LI J,ZHANG L L,etal.A sensitive fluorescence anisotropy method for the direct detection of cancer cells in whole blood based on aptamer-conjugated near-infrared fluorescent nanoparticles[J].Biosensors and Bioelectronics,2010,25(7):1587-1591.
[14]HE X X,WU X,WANG K M,etal.Methylene blue-encapsulated phosphonate-terminated silica nanoparticles for simultaneous in vivo imaging and photodynamic therapy[J].Biomaterials,2009,30(29):5601-5609.

