L.paracasei W2芳香族氨基酸转氨酶基因克隆与序列分析
唐红梅,周丽丽,张奇,邵丽丽,王立梅,*
(1.苏州大学基础医学与生物科学学院,江苏 苏州 215123;2.常熟理工学院发酵工程技术研究中心,苏州市食品生物技术重点试验室,江苏 常熟 215500)
转氨酶是一类广泛存在于生物体内的生物催化剂,能将α-氨基酸中的氨基转移到α-酮酸分子上,参与许多代谢途径,包括氨基酸的合成和分解、维生素合成、碳氮吸收、次级代谢等[1-2]。转氨酶种类很多,其中芳香族氨基酸转氨酶主要催化苯丙氨酸、酪氨酸、天冬氨酸和亮氨酸的氨基转移[3]。在乳酸菌等微生物苯丙氨酸代谢途径中,苯丙氨酸通过转氨酶的作用形成苯丙酮酸,苯丙酮酸又可在乳酸脱氢酶作用下产生苯乳酸[4-5]。苯乳酸(phenyllactic acid,PLA),是一种新型天然防腐剂,有较广的抑菌谱,能抑制细菌和真菌的污染,可延长食品的货架期[6-8]。研究表明PLA 在较低浓度下就可有效抑制大部分食品腐败菌,特别是其抑制真菌效果要显著优于一些常用食品防腐剂,如苯甲酸纳、山梨酸钾等合成防腐剂[9],因此在食品工业中有广阔的应用前景。
本试验室筛选到一株可以产生苯乳酸的副干酪乳杆菌(L.paracasei W2)[10],并对其合成苯乳酸的培养基和培养条件进行了优化[11-12],然而在野生菌体内的芳香族氨基酸代谢途径中,芳香族氨基酸生物合成受到调节机制的作用,只是合成自身代谢需要的物质,不会大量产生目的产物苯丙氨酸,因此限制了苯丙氨酸通过转氨反应形成苯丙酮酸[13],进而限制了苯乳酸的合成,所以转氨酶是产苯乳酸途径中的一种关键酶[14]。
本研究从L.paracasei W2 中扩增获得转氨酶基因序列(Genbank 登录号:JX144982),通过生物信息学的方法对转氨酶基因及其编码的蛋白结构和性质进行全面的分析,为研究转氨酶在副干酪乳杆菌产苯乳酸途径中的生物学功能以及对其进行分子改造从而提高苯乳酸产量提供理论参考。
1 材料与方法
1.1 材料
1.1.1 菌株与载体
副干酪乳杆菌(L.paracasei W2):由常熟理工学院发酵工程技术研究中心分离并保存;转化宿主细胞大肠杆菌JM109、克隆载体pMD19-T 购自大连宝生物公司。
1.1.2 培养基及试剂
LB 培养基用于培养大肠杆菌、MRS 培养基用于培养L.paracasei W2。基因组提取试剂盒、DNA 片段纯化试剂盒、ExTaq 酶、X-gal、IPTG、Amp、DL2000 Marker均购自大连宝生物公司。引物合成,产物测序由上海生工完成。
1.2 方法
1.2.1 引物设计
根据NCBI 中登录的Lactobacillus casei str.Zhang芳香族氨基酸转氨酶基因序列,设计一对引物FP 和RP,扩增转氨酶基因。
上游引物(FP):5’-ATGACATTAGTTGATCGGATG AATC-3’
下游引物(RP):5’-TTAATGCGTTGCCATATACTTGG-3’
1.2.2 基因组DNA 提取及PCR 扩增
利用基因组提取试剂盒提取L.paracasei W2 的基因组DNA,扩增转氨酶基因,PCR 反应体系(50 μL)包括:10×ExTaq Buffer(Mg2+)5 μL,dNTP Mixture(各2.5 mmol/L)4 μL,上下游引物(10 μmol/L)各2 μL,基因组模板5 μL,ddH2O 31.5 μL,ExTaq 酶0.5 μL。
PCR 反应程序:94 ℃预变性5 min,94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸2 min,进行30 个循环,最后72 ℃延伸10 min。反应结束后取10 μL PCR 产物于1%的琼脂糖凝胶电泳中检测结果。
1.2.3 重组质粒的构建
第五,巡演类演艺。巡演类演艺指的是在整个景区内进行巡游演出,这种演艺节目大多都出现在大型游乐场等需要和游客实时互动的旅游场合,这类演艺能调节游客在景区的心情,能营造更加强烈的氛围。
利用DNA 片段纯化试剂盒纯化PCR 产物,与克隆载体pMD19-T 连接,转化至大肠杆菌ML09,筛选阳性克隆,菌落PCR 鉴定阳性重组质粒,阳性菌株送至上海生工测序。
1.2.4 序列分析
利用生物信息学软件对芳香族氨基酸转氨酶基因序列进行同源性分析,保守结构域分析,蛋白的相对分子质量、等电点等理化性质分析以及二级结构预测,例如Protparam、SOPMA、PROSITE motif search 数据库,并用其中一些网站对蛋白进行了疏水性分析、跨膜螺旋区分析和磷酸化位点预测等。利用swissmode1 软件和PyMOL 软件预测了蛋白质的高级结构。将L.paracasei W2 和其他菌种的转氨酶进行氨基酸多序列比对,构建分子进化树。
2 结果与分析
2.1 芳香族氨基酸转氨酶基因的PCR 扩增
以L.paracasei W2 基因组为模板,用引物FP 和RP 扩增转氨酶基因,PCR 产物经1%的琼脂糖凝胶电泳检测,得到约1.1 kb 的片段,与Lactobacillus casei str.Zhang 芳香族氨基酸转氨酶大小一致,如图1。

图1 L.paracasei W2 芳香族氨基酸转氨酶基因Fig.1 Aromatic Aminotransferase Gene of L.paracasei W2
2.2 重组质粒的筛选与鉴定
将PCR 纯化产物与pMD19-T 简易载体连接,转化至JM109 感受态细胞,进行蓝白斑筛选,随机挑取白斑接种于5 mL LB(100 μg/mL Amp)的培养液中37 ℃、180 r/min 培养过夜。以菌液为模板进行PCR,所得到的片段大小与PCR 片段大小一样(1 164 bp),视为阳性克隆,菌液送至上海生工测序,结果如图2。
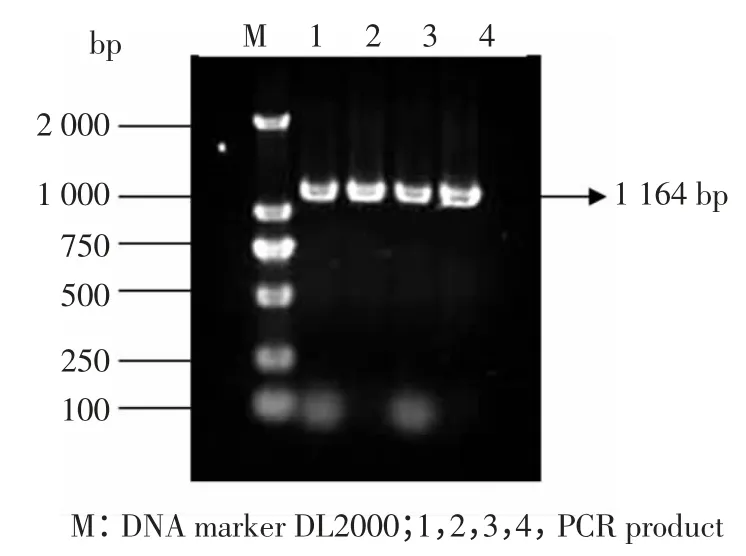
图2 菌落PCR 鉴定结果Fig.2 PCR identification result
2.3 转氨酶基因序列分析
2.3.1 blast 分析结果
利用nucleotide blast 工具对转氨酶基因序列进行同源性分析,如图3 所示,L.paracasei W2 的芳香族氨基酸转氨酶基因序列与L.casei str.zhang 相似性最高为100%,与L.casei BL23、L.casei ATCC 334、L.casei BD-II、L.casei LC2W 相似性达99%。
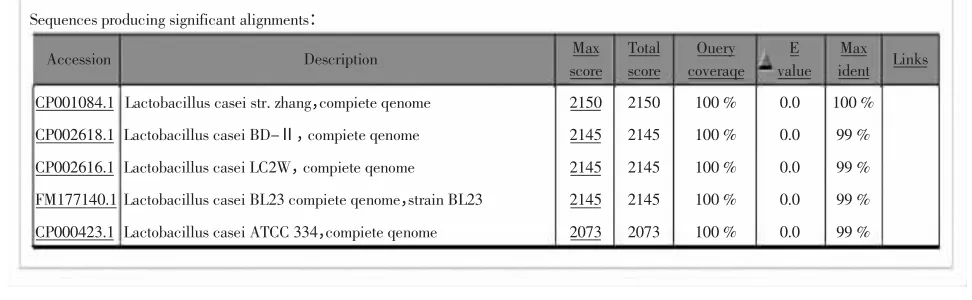
图3 blastn 分析结果Fig.3 Result of blastn analyse
2.3.2 rpsblast 分析
rpsblast 分析结果如图4,从图中可以看出该转氨酶有完整的芳香族氨基酸转氨酶基因保守结构域,另外该基因序列还编码天冬氨酸转氨酶及天冬氨酸转氨酶超家族。

图4 预测的L.caseiW2 的Aromatic Aminotransferase 保守功能域(标尺代表氨基酸位数)Fig.4 Prediction of conserved domain of Aromatic Aminotransferase from L.paracasei W2
2.3.3 利用EXPASY 中的ProtParam 分析芳香族氨基酸转氨酶的理化性质
L.paracasei W2 的芳香族氨基酸转氨酶由387 个氨基酸组成,理论分子量是41 961.2 Da,等电点为6.03。在组成蛋白的20 种氨基酸中,丙氨酸(Ala)所占的比例最高,达到11.9%,而色氨酸(Trp)所占的比例最低,为0.5%。该蛋白在水溶液中在280 nm 处的摩尔消光系数为36 330 M-1cm-1,0.1 %浓度时吸光系数(Abs)为0.866。其成熟N 端为甲硫氨酸时,在哺乳动物网状红细胞体外表达的半衰期为30 h,在酵母和大肠埃希菌体内表达的半衰期分别大于20 h 和10 h。脂肪族指数为93.10,在溶液中的不稳定指数为31.28。
2.3.4 信号肽、疏水性、磷酸化位点预测、跨膜螺旋区分析及PROSITE 分析
分析结果显示转氨酶没有信号肽,疏水性较高,有8 个Ser、4 个Thr、6 个Tyr 可能成为蛋白激酶的磷酸化位点,在转氨酶氨基酸序列的第94~112、119~137位存在两个跨膜螺旋区。转氨酶蛋白的功能位点在第233~246 位,氨基酸序列GVSKSHAMTGW RVG,其中K 为催化活性位点。
2.3.5 二级及三级结构预测

图5 副干酪乳杆菌的转氨酶二级结构预测Fig.5 Seconday structure prediction of the Aminotransferase from L.paracasei W2
二级结构预测结果如图5 所示,h 为α 螺旋、e 为延伸链、c 为无规卷曲,转氨酶含α 螺旋、β 折叠和无规卷曲的比例分别为44.96%、9.30%、28.94%,主要以α 螺旋为主。
利用swissmodel 软件和PyMOL 软件构建出副干酪乳杆菌(L.paracasei W2)转氨酶的高级结构,如图6。
2.3.6 副干酪乳杆菌(L.paracasei W2)Aromatic Aminotransferase 分子进化树的构建
将副干酪乳杆菌的转氨酶与其他菌株(Escherichia coli O157:H7 str.Sakai、Lactobacillus plantarum JDM1、Lactobacillus rhamnosus GG、Lactobacillus salivarius UCC118、Lactococcus lactis subsp.lactis Il1403、Listeria monocytogenes serotype 4 b str.F2365、Proteus mirabilis HI4320、Streptococcus oralis Uo5、Lactobacillus casei str.Zhang)的芳香族转氨酶进行氨基酸序列比对并构建分子进化树,结果如图7 所示。
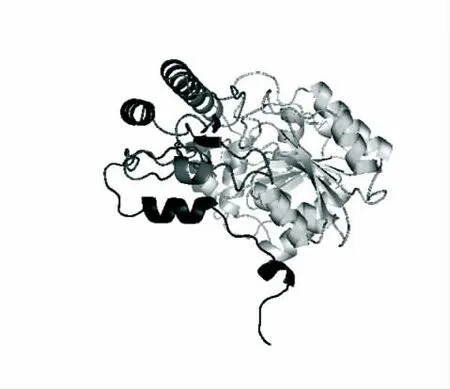
图6 L.paracasei W2 芳香族氨基酸转氨酶高级结构Fig.6 Tertiary structure of Aromatic Aminotransferase from L.paracasei W2

图7 副干酪乳杆菌的Aromatic Aminotransferase 的分子进化树Fig.7 Phylogenetic tree of Aromatic Aminotransferase from L.paracasei W2
分子进化树显示在选择的菌种中Aromatic Aminotransferase 分为两大类,而Lactobacillus rhamnosus GG、Lactobacillus casei str.Zhang、L.paracasei W2、Lactococcus lactis subsp.Lactis Il1403、Streptococcus oralis Uo5 起源于同一个分支点,其中L.paracasei W2与Lactobacillus casei str.Zhang 进化关系最近,其次与Streptococcus oralis Uo5、Lactococcus lactis subsp.Lactis Il1403 进化关系较近。
3 结论
在乳酸菌中,苯丙氨酸在转氨酶的作用下产生苯丙酮酸,苯丙酮酸又可在乳酸脱氢酶的作用下生成苯乳酸,转氨作用是产生苯乳酸的限速步骤[15]。本试验扩增得到转氨酶基因,大小为1 164 bp,与Lactobacillus casei str.Zhang 芳香族氨基酸转氨酶基因的相似性为100 %,证明L.paracasei W2 中确试存在此转氨酶基因。
对转氨酶蛋白的结构与性质进行分析显示该蛋白无信号肽序列,属于非分泌型蛋白[16],第233 位~第246 位是蛋白的功能位点,氨基酸序列为GVSKSHAMTGWRVG,其中K 为辅酶磷酸吡哆醛或磷酸吡哆胺结合位点,辅酶起临时的氨基载体的作用,通过辅酶在磷酸吡哆醛和磷酸吡哆胺之间的转换来完成氨基的转运[17-18]。蛋白序列中有8 个Ser、4 个Thr、6 个Tyr 可能成为蛋白激酶的磷酸化位点。磷酸化是蛋白质合成后广泛存在的一种化学修饰,是控制酶活性的重要步骤,有利于从分子水平上研究转氨酶的代谢功能[19]。通过氨基酸序列比对发现在转氨酶氨基酸序列中有保守的氨基酸位点和保守区域,是转氨酶酶活性区域,与酶催化活性直接相关。
目前对于大肠杆菌中转氨酶的研究有较多报道,其天冬氨酸转氨酶和芳香族氨基酸转氨酶都能催化苯丙氨酸的转氨反应,这两种酶分别由aspC 和tyrB基因编码[20]。通过序列分析,L.paracasei W2 转氨酶基因可以编码芳香族氨基酸转氨酶和天冬氨酸转氨酶,是芳香族氨基酸转氨酶经蛋白水解酶的作用转变成有活性的天冬氨酸转氨酶,两种酶都能催化苯丙氨酸的转氨作用。这为我们进一步研究转氨酶的酶学性质以及对其进行分子改造,从而提高L.paracasei W2 产苯乳酸能力提供了理论依据。
[1]Liepman A H,Olsen L J,Genomic analysis of aminotransferases in Arabidopsis thaliana[J].Critical Reviews in Plant Sciences,2004,23(1):73-89
[2]Mehta P K,Hale T I,Christen P,Aminotransferases:demonstration of homology and division into evolutionary subgroups[J].European Journal of Biochemistry,1993,214(2):549-561
[3]Yumi Nakai,Hideyuki Hayashi,Hiroyuki Kagamiyama.Cloning and characterization of the tyrB gene from Salmonella typhimurium[J].Biochimica et Biophysica Acta,1996,1308(3):189-192
[4]Gummalla S,Broadbent J R.Tyrosine and phenylalanine catabolism by Lactobacillus cheese flavor adjuncts[J].Dairy Sci.2001,84(5):1011-1019
[5]Broadbent J R,Gummalla S,Hughes J E,et al.Overexpression of Lactobacillus casei D -hydroxyisocaproic acid dehydrogenase in cheddar cheese[J].EnViron Microbiol.2004,70(8):4814-4820
[6]Dieuleveux V,Lemarinier S,Gue'guen M.Antimicrobial spectrum and target site of D-3-phenyllactic acid[J].Int J Food Microbiol 1998,40(3):177-183
[7]Lavermicocca P,Valerio F,Visconti A.Antifungal activity of phenyllactic acid against molds isolated from bakery products[J].Appl Environ Microbiol 2003,69(1):634-640
[8]Schnurer J,Magnusson J.Antifungal lactic acid bacteria as biopreservatives[J].Trends Food Sci Technol 2005,16(1):70-78
[9]Hummel W,Schutte H,Kula MR.Large scale production of Dlactate dehydrogenase for the stereospecific reduction of pyruvate and phenylpyruvate[J].Europen Journal of Applied Microbiology and Biotechnology,1983,18(2):75-85
[10]王立梅,郑丽雪.一株乳酸杆菌菌株及其应用:中国,ZL201010207351.1[P].2010-06-23
[11]刘戈,王立梅.Lactobacillus paracasei W2 合成苯乳酸培养条件的优化[J].食品科学,2010,31(23):174-177
[12]孙姜,郑丽雪,王立梅.Lactobacillus paracasei W2 产苯乳酸的发酵动力学研究[J].食品科学,2011,32(19):180-183
[13]Vermeulen N,Ga′nzle MG,Vogel RF.Influence of peptide supply and cosubstrates on phenylalanine metabolism of Lactobacillus sanfranciscensis DSM20451T and Lactobacillus plantarum TMW 1.468[J].J Agric Food Chem,2006,54(11):3832-3839
[14]Li XF,Jiang B,Pan BL.Biotransformation of phenylpyruvic acid to phenyllactic acid by growing and resting cells of a Lactobacillus sp[J].Biotechnol Lett,2007,29(4):593-597
[15]李兴峰,江波,潘蓓蕾.苯丙氨酸及苯丙酮酸对Lactobacillus sp.SK007 合成苯乳酸的影响[J].过程工程学报,2007,7(6):1202-1206
[16]葛菁萍,赵晓龙,张岚,等.副干酪乳杆菌响应调节蛋白基因克隆与序列分析[J].微生物学杂志,2009,29(1):60-64
[17]Elick S F,Vavara J.A kinetic and equilibrium analysis of the glutamic oxaloacetate transaminase mechanism[J].J Biol Chem,1962,237(7):2109-2122
[18]Kiick D M,Cook P F.pH studies toward the elucidation of the auxiliary catalyst of pig heart aspartate aminotransferase[J].Biochemistry,1983,22(2):75-382
[19]王禄山,高培基.生物信息学应用技术[M].北京:化学工业出版社,2007:161-164
[20]Pranav R,Prabhu,Andr′e O,Hudson.Identification and Partial Characterization of an L-Tyrosine Aminotransferase(TAT)from Arabidopsis thaliana[J].Biochemistry research international,2010(2010):11-12

