16%吡虫啉·噻嗪酮可湿性粉剂在水稻田中的残留动态研究
张永忠,刘 檀,任红波,陈国峰,张晓波,袁 赞
(1.东北农业大学理学院,哈尔滨 150030;2.农业部谷物及制品质量监督检验测试中心,哈尔滨 150086)
16%吡虫啉·噻嗪酮可湿性粉剂由两个有效成分组成(吡虫啉和噻嗪酮分别占2%和14%)。吡虫啉(Imidacloprid)属硝基亚甲基类内吸杀虫剂,干扰害虫运动神经系统,用于防治刺吸式口器害虫。噻嗪酮(Buprofezin)是二嗪类昆虫生长调节剂,干扰昆虫新陈代谢,可有效防治水稻上的叶蝉科和飞虱科[1-2]。两种农药长期单独使用,造成很高抗性;而16%吡虫啉·噻嗪酮可湿性粉剂可有效减缓抗药性,对于水稻稻飞虱有很好防治效果。
国外对两种农药在稻米中残留研究较少,对其在蔬菜和水果中残留关注较多,分析手段大多采用气相色谱质谱联用和液相色谱质谱联用[3-8]。吡虫啉在蔬菜上的使用较多,王明明等报道采用乙腈提取、氨基固相萃取小柱净化、高效液相色谱分离测定番茄中的吡虫啉的残留量[9]。殷春杭等采用二氯甲烷提取,并用C18柱净化,用高效液相色谱仪测定蔬菜中吡虫啉残留量。近年来随着吡虫啉在水稻上的使用量增加,其在稻米中的残留分析方法及消解动态研究也时见报道[10]。欧菊芳等建立以乙腈提取、GPC净化的高效液相色谱法测定稻米中吡虫啉残留量分析方法。研究乙腈、丙酮、甲醇、乙酸乙酯的提取效率,考查C18、活性炭、PSA、氟罗里硅土和GPC对稻米样品净化效果的影响[11]。吴声敢等采用高效液相色谱方法测定10%吡虫啉可湿性粉剂的残留量,得到吡虫啉在稻杆、田水和土壤中的半衰期分别为1.2~2.0,1.1~3.1和5.6~15.3 d[12]。胡莲英和高国文等用丙酮提取稻米中的噻嗪酮,提取液静置过夜后过滤,滤液经减压浓缩后用正己烷萃取3次,脱水,用气相色谱仪测定稻米中噻嗪酮的残留量[13-14]。该方法存在样品前处理步骤繁琐,提取和净化时间长的问题。本方法用乙腈作为吡虫啉和噻嗪酮的共同提取剂,用氟罗里硅土固相萃取小柱和氨基固相萃取小柱快速净化,分别采用反相HPLC-DAD和GC-μECD进行检测,建立吡虫啉和噻嗪酮残留的快速检测和监测方法,能满足大批量稻米样品快速检测和监测需要。
本试验在黑龙江省哈尔滨市、河南省郑州市、贵州省贵阳市进行16%吡虫啉·噻嗪酮可湿性粉剂在水稻田中消解动态试验和稻米最终残留试验,客观评价其在水稻田中消解动态,为该农药合理使用及环境评价提供理论依据。
1 材料与方法
1.1 仪器与试剂
Agilent 1100高效液相色谱仪(DAD检测器);Agilent 6890气相色谱仪(μECD检测器);美国RE-52AA型氮吹仪;德国KQ-500B型振荡器;WH-851型旋涡混合器。
吡虫啉和噻嗪酮标准品(纯度≥99.0%,由农业部环境监督检验测试中心提供);正己烷、乙腈、丙酮、甲醇和二氯甲烷均为色谱纯;氯化钠为优级纯;氟罗里硅土固相萃取小柱(规格500 mg,6 mL);氨基固相萃取小柱(规格500 mg,6 mL)。
1.2 田间试验
1.2.1 供试药剂
16%吡虫啉·噻嗪酮可湿性粉剂由海南正业中农高科股份有限公司提供。推荐使用方法为:施药剂量为 22~25 g·667 m-2,施药次数为 1次和 2次,施药间隔为7 d,最后1次施药距采收间隔期为14 d。
1.2.2 田间试验设计
根据我国农药登记田间最终残留试验标准操作规程[15]和推荐的使用准则设计田间试验。共设41个试验小区,每个小区面积30 m2。稻米最终残留试验36个小区,水稻植株消解动态3个小区,另设土壤和田水动态试验小区1个,空白对照小区1个。
1.2.3 消解动态试验
植株动态:16%吡虫啉·噻嗪酮可湿性粉剂以37.5 g·667 m-2(有效成分:吡虫啉0.75 g·667 m-2,噻嗪酮5.25 g·667 m-2)的剂量施药1次,施药2 h、1、3、5、7、10、14、21、28、45 d后采集植株样品。
土壤和田水动态:用同一个处理小区,以375.2 g·667 m-2(有效成分:吡虫啉7.5 g·667 m-2,噻嗪酮52.5 g·667 m-2)的剂量施药1次,施药2 h、1、3、5、7、10、14、21、28、45 d后采集土壤和田水样品。
1.2.4 稻米最终残留试验
在水稻生长期分别以25 g·667 m-2(有效成分:吡虫啉0.5 g·667 m-2,噻嗪酮3.5 g·667 m-2)和37.5 g·667 m-2的剂量施药2次和3次,施药7、14、21 d后,采集稻米样品。
1.2.5 田间试验样本的采集和制备
随机多点采集植株样品约2 kg,土壤样品约1 kg,稻米样品约2 kg,田水样品约3 000 mL。植株剪成1 cm以下的小段,土壤过40目筛,田水用纱布过滤,稻米脱壳。低温(-20℃)保存、备用。
1.3 分析方法
1.3.1 样品的提取
称取土壤、植株和稻米样品各10.0 g,分别置于具塞三角瓶中,加20 mL蒸馏水和50 mL乙腈,振荡30 min,过滤到盛有氯化钠的量筒中,待滤液全部过滤完毕,盖上塞子剧烈振摇后静上分层(直至上层清晰透明)。量取田水样品10 mL,置于50 mL具塞三角瓶中,加50 mL乙腈,振荡1 h,过滤到盛有氯化钠的量筒中,振荡分层。
准确吸取第一份上层乙腈相10 mL,在氮吹仪上吹干,用甲醇∶二氯甲烷(V/V为5/95)溶解残渣待净化,用于测定吡虫啉。准确吸取第二份上层乙腈相10 mL,在氮吹仪上吹干,用少量正己烷溶解残渣后待净化,用于测定噻嗪酮。
1.3.2 样品的净化
用甲醇∶二氯甲烷(V/V为5/95)活化氨基固相萃取小柱,将第一份待净化液倒入氨基固相萃取小柱,用甲醇∶二氯甲烷(V/V为5/95)淋洗,收集淋洗液约15 mL,氮气吹干,用甲醇定容至2 mL,供高效液相色谱仪(DAD检测器)测定吡虫啉。
用丙酮∶正己烷(V/V为10/90)活化氟罗里硅土固相萃取小柱,将第二份待净化液倒入氟罗里硅土固相萃取小柱,用丙酮∶正己烷(V/V为10/90)淋洗,
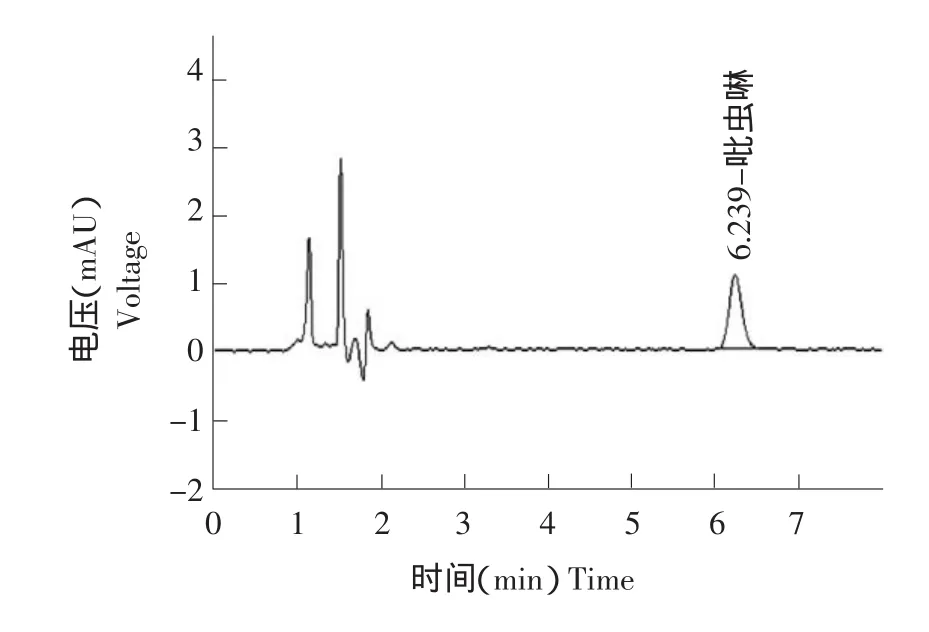
图1 吡虫啉标准样品液相色谱Fig.1 HPLC chromatogram of imidacloprid standard
按上述仪器测定条件确定吡虫啉的最小检出量为5×10-10g,噻嗪酮的最小检出量均为2×10-11g。吡收集淋洗液约15 mL,氮气吹干,用正己烷定容至2 mL,供气相色谱仪(μECD检测器)测定噻嗪酮。
1.4 色谱分析条件
1.4.1 吡虫啉液相色谱分析条件
色谱柱:Waters-C18,4.6 mm×150 mm,填料粒径 5 μm;动相:乙腈/水=20/80(V/V);流速:1 mL·min-1;检测波长:270 nm;柱温箱温度:35℃;进样量:10 μL。保留时间为6.2 min。
1.4.2 噻嗪酮气相色谱分析条件
色谱柱:DB1-30 m×0.25 mm弹性石英玻璃毛细管柱;载气:氮气;载气流速:1.0 mL·min-1;进样口温度:200℃;检测器温度:300℃;柱温:初始150℃保持1 min,6℃·min-1升到250℃保持10 min;进样量:1 μL。保留时间为14.5 min。
2 结果与分析
2.1 标准曲线
准确称取10.0 mg吡虫啉标准品,用甲醇配制成浓度为100 mg·L-1的储备液,再用甲醇逐级稀释成0.05、0.1、0.2、0.5、1.0 mg·L-1的标准溶液。准确称取10.0 mg噻嗪酮标准品,用正己烷配制成浓度为100 mg·L-1的储备液,再用正己烷逐级稀释成0.05、0.1、0.3、0.5、1.0 mg·L-1的标准溶液。在上述色谱条件下测定,以峰面积为纵坐标,浓度为横坐标,绘制标准曲线,其线性方程分别为Y=99.196x-2.7613,γ=0.9997;Y=32187x-1138,γ=0.9998。标准曲线呈良好的线性关系。获得两种农药的标准样品色谱图见图1、2。虫啉在植株、稻米、土壤和田水中的最低检出浓度为0.05 mg·kg-1,噻嗪酮在植株、稻米、土壤和田水中的最低检出浓度为0.02 mg·kg-1。
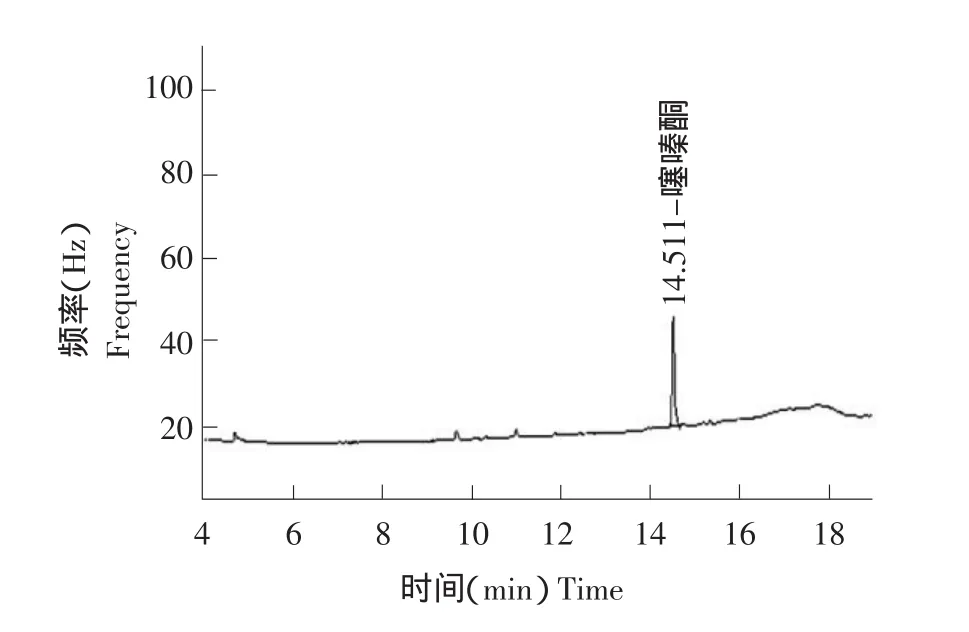
图2 噻嗪酮标准样品气相色谱Fig.2 GC chromatogram of buprofezin standard
2.2 方法的准确度和精密度分析
在土壤、稻米、植株和田水空白对照样本中添加不同浓度吡虫啉和噻嗪酮标准溶液,在上述色谱条件进行回收率测定,在 0.02~0.5 mg·kg-1范围内,各种样本的添加回收率均在89.2%~106.4%,变异系数在1.7%~13.2%。添加回收率和变异系数结果见表1。
稻米空白样本及添加吡虫啉和噻嗪酮样本的色谱图见图3~6。
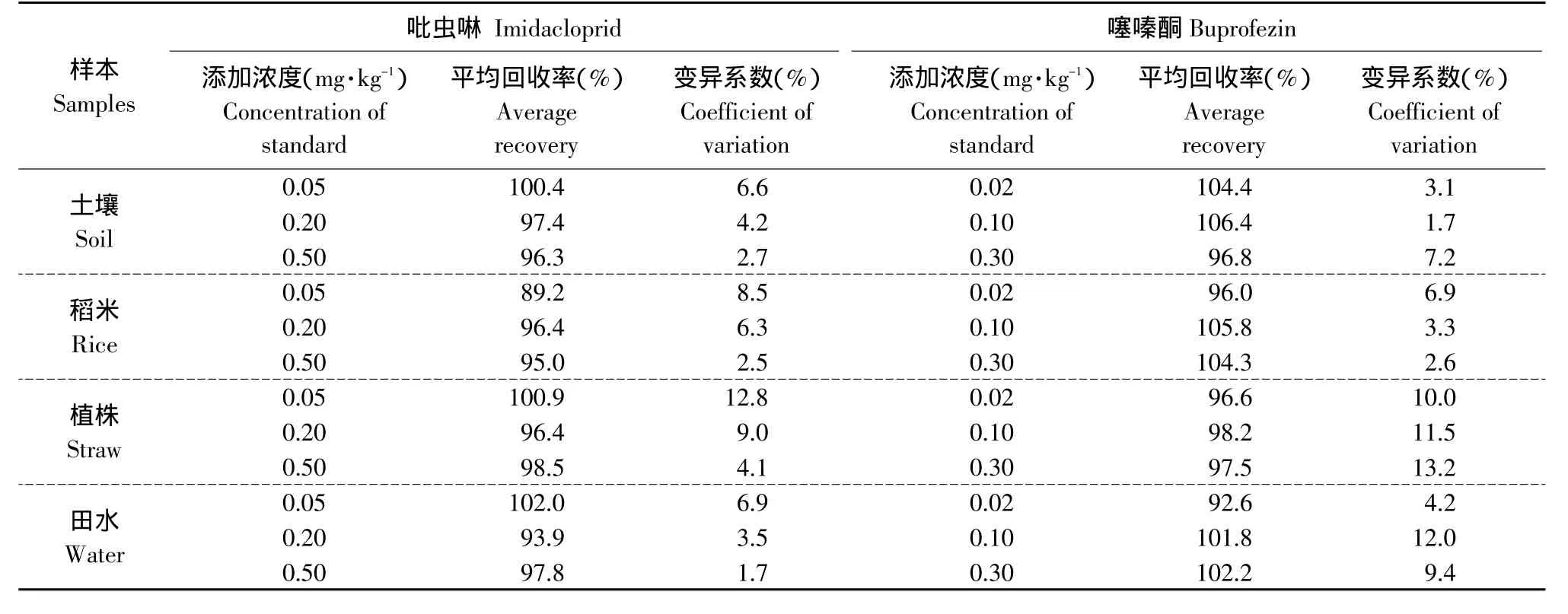
表1 吡虫啉和噻嗪酮添加回收率及变异系数Table 1 Average recovery and coefficient of variation of imidacloprid and buprofezin(n=5)
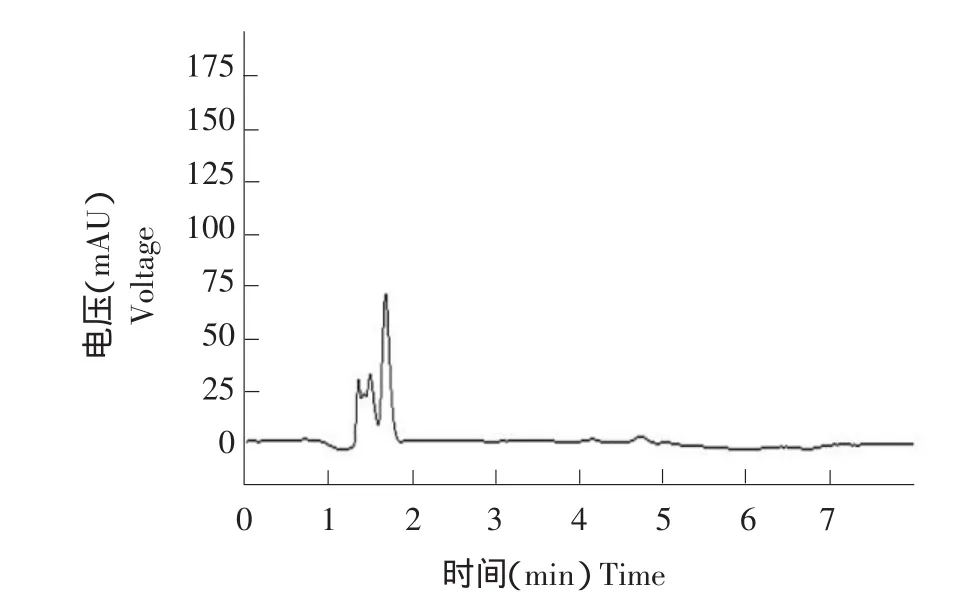
图3 稻米空白样本液相色谱Fig.3 HPLC chromatogram of blank rice sample
图4 稻米空白样本气相色谱Fig.4 GC chromatogram of blank rice sample
图5 稻米样本添加0.05 mg·kg-1吡虫啉液相色谱Fig.5 HPLC chromatogram of rice sample with imidacloprid of 0.05 mg·kg-1
图6 稻米样本添加0.02 mg·kg-1噻嗪酮气相色谱Fig.6 GC chromatogram of rice sample with buprofezin of 0.02 mg·kg-1
2.3 消解动态试验
吡虫啉在哈尔滨、郑州和贵阳三地水稻田中的消解动态见表2,植株中降解方程分别为:C哈=8.3373e-0.3293x(γ=-0.9826),C郑=7.5883e-0.3165x(γ=-0.9466),C贵=4.7054e-0.4138x(γ=-0.9967);土壤中降解方程分别为:C哈=3.087e-0.2513x(γ=-0.9705),C郑=1.2362e-0.3051x(γ=-0.9906),C贵=1.5782e-0.2619x(γ=-0.9612);田水中降解方程分别为:C哈=0.9576e-0.5155x(γ=-0.9974),C郑=0.8995e-0.339x(γ=-0.9879),C贵=0.5402e-0.4718x(γ=-0.9700)。
噻嗪酮在哈尔滨、郑州和贵阳三地水稻田中的消解动态见表3。植株中降解方程分别为:C哈=0.6393e-0.2372x(γ=-0.9807),C郑=0.3009e-0.2647x(γ=-0.9028),C贵=0.4849e-0.2976x(γ=-0.9939);土壤中降解方程分别为:C哈=0.8625e-0.0545x(γ=-0.9495),C郑=0.9839e-0.0738x(γ=-0.9811),C贵=4.7054e-0.2463x(γ=-0.9563);田水中降解方程分别为:C哈=0.2045e-0.3011x(γ=-0.9765),C郑=0.1768e-0.3855x(γ=-0.9731),C贵=0.1875e-0.3290x(γ=-0.9911)。
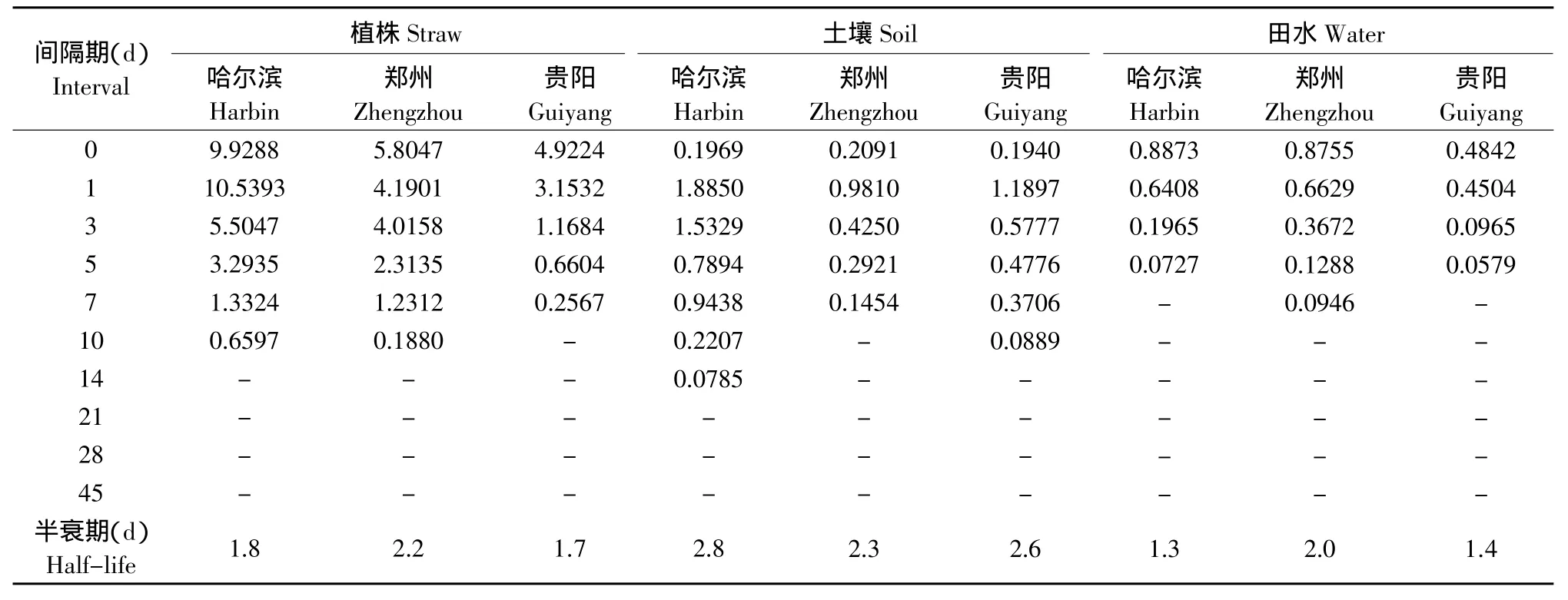
表2 吡虫啉在水稻田中的消解动态残留量Table 2 Dynamic degradation of imidacloprid in rice field (mg·kg-1)
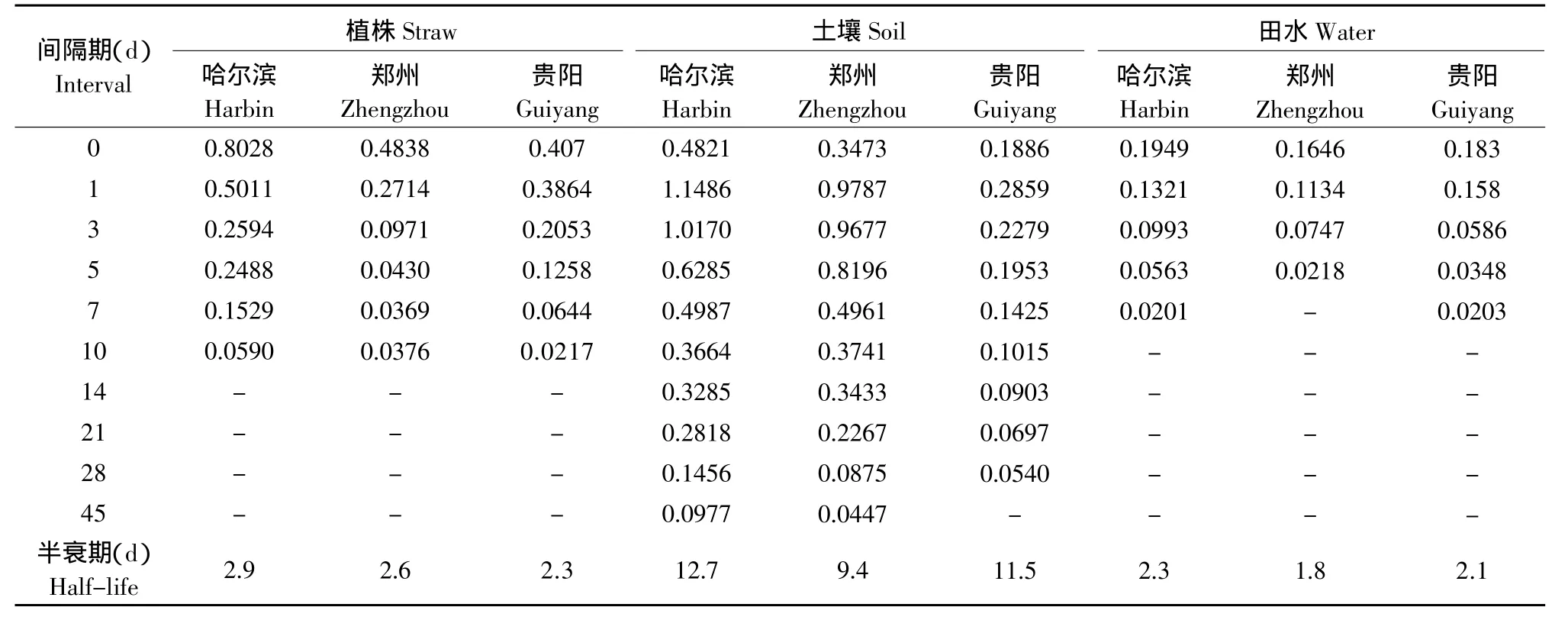
表3 噻嗪酮在水稻田中的消解动态残留量Table 3 Dynamic degradation results of buprofezin in rice field (mg·kg-1)
2.4 稻米最终残留试验
将16%吡虫啉·噻嗪酮可湿性粉剂以25和37.5 g·667 m-2的剂量在水稻田水分别喷施2次和3次,末次施药7、14、21 d后,哈尔滨、郑州和贵州三地吡虫啉在稻米中残留量皆<0.05 mg·kg-1,噻嗪酮在稻米中残留量皆<0.3 mg·kg-1。
3 讨论与结论
吴声敢等用二氯甲烷振荡提取法提取稻杆和田水中的吡虫啉,用甲醇索氏提取法和甲醇振荡提取法提取土壤和稻米中的吡虫啉[12]。而提取稻米中噻嗪酮的传统方法则是用丙酮作为提取溶剂。本试验优化前处理条件,用乙腈可同时提取植株、土壤、田水和稻米中的吡虫啉和噻嗪酮,提高提取效率。采用氟罗里硅土固相萃取小柱和氨基固相萃取小柱快速净化,节省前处理时间,满足大批量稻米样品快速检测和监测需要。
吡虫啉和噻嗪酮在水稻植株、土壤和田水中的消解为逐渐降低过程,均符合一级反应动力学方程。吡虫啉和噻嗪酮的半衰期均小于30 d,都属于易降解农药,在水中降解较快,在土壤中降解稍慢。由于哈尔滨、郑州和贵阳三地气候、降雨和土壤等因素不同,造成农药在三地的降解速率不同。这与农药本身的水解和光解行为有关[16-17]。
本试验分别采用反相HPLC-DAD和GC-μECD检测水稻植株、土壤、田水和稻米中吡虫啉和噻嗪酮农药残留量,提取方法简单、易操作。该方法添加回收率为89.2%~106.4%,变异系数为1.7%~13.2%。在检测灵敏度、准确度和重现性等方面均符合农药残留检测技术要求。吡虫啉在植株、土壤和田水半衰期分别为1.7~2.2、2.3~2.8和1.3~2.0 d,噻嗪酮在植株、土壤和田水半衰期分别为2.3~2.9、9.4~12.7和1.8~2.3 d。确定16%吡虫啉·噻嗪酮可湿性粉剂按照推荐使用准则,收获稻米中吡虫啉最终残留量均未超我国NY/T 1500.5.1-2007规定稻米中MRL值0.05 mg·kg-1[18]。收获稻米中噻嗪酮最终残留量均未超我国GB/T 14970-1994规定稻米中MRL值0.3 mg·kg-1[19]。
[1]化工部农药信息总站.国外农药品种手册[M].沈阳:化工出版社,1996:299,328.
[2]韩熹莱.中国农业百科全书.农药卷[M].北京:农业出版社,1993.
[3]Obama H,Okihashi M,Akutsu K,et al.Determination of acetamiprid,imidacloprid and nitenpyram residues in vegetables and fruits by high-performance liquid chromatography with diodearray detection[J].Journal of Agric Food Chem,2002,50:4464-4467.
[4]Di Muccio A,Fidente P,Attard Barbini D,et al.Application of solid-phase extraction and liquid chromatography-mass spectrometry to the determination of neonicotinoid pesticide residues in fruit and vegetables[J].Journal of Chromatography A,2006,1108(1):1-6.
[5]Mol H,Van Dam R.Determination of polar organophosphorus pesticides in vegetables and fruits using liquid chromatography with tandem mass spectrometry:Selection of extraction solvent[J].Journal of Chromatography A,2003,1015(1/2):119-127.
[6]Pareja L,Cesio V,Heinzen H,et al.Analytical methods for pesticide residues in rice[J].Trends in Analytical Chemistry,2011,30(2):270-291.
[7]Schenck F J,Howard K V.Rapid solid phase extraction cleanup for pesticide residues in fresh fruits and vegetables[J].Bull Environ Contam Toxicol,1999,63:277-281.
[8]Blasco C,Fernandez M,Pico Y,et al.Simultaneous determination of imidacloprid,carbendazim,methiocarb and hexythiazox in peaches and nectarines by liquid chromatography-mass spectrometry[J].Analytic Chimica Acta,2002,461(1):109-116.
[9]王明明,龚艳,陈浩,等.吡虫啉在番茄中的残留动态及残留去除方法[J].食品科学,2010,31(19):133-136.
[10]殷春杭,钱允辉,张琰.蔬菜中吡虫啉农药残留分析方法[J].中国测试技术,2008,34(3):98-100.
[11]欧菊芳,陈铭学,支建梁,等.凝胶渗透色谱净化液相色谱法测定稻米中吡虫啉的残留量[J].分析试验室,2008(5):279-282.
[12]吴声敢,吴俐勤,徐浩地,等.10%吡虫啉在水稻中残留动态研究[J].农药,2006,44(1):25-27.
[13]胡莲英.气相色谱法测定噻嗪酮在水稻中的残留量[J].农药,1998,27(1):43.
[14]高国文,张滢,童洁,等.噻嗪酮在稻谷中残留检测的2种方法比较[J].农药科学与管理,2005,26(8):11-12,14.
[15]农业部农药检定所.农药登记残留田间试验标准操作规程[M].北京:中国标准出版社,2007:3-5.
[16]刘维屏.农药环境化学[M].北京:化学工业出版社,2006.
[17]欧晓明.农药在环境中的水解机理及其影响因子研究进展[J].生态环境,2006,15(6):1352-1359.
[18]中华人民共和国农业部.NY/T 1500.5.1-2007[S].北京:农业出版社,2007.
[19]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 14970-1994[S].北京:中国标准出版社,1986.

