人参SE基因RNAi载体的构建及转化
刘天巍,任 丽,杨广顺,孙春玉,王 义,张美萍
(吉林农业大学生命科学学院,长春 130118)
RNA干扰(RNA interference,RNAi)是与靶基因同源双链RNA引发,在动植物和真菌中普遍存在序列特异的转录后基因沉默现象[1]。RNA干扰作为一种敲除基因新技术已广泛应用于基因功能、基因表达调控机制研究等领域。RNAi最早是在线虫C.elegans上发现[2],现已应用于真菌、动物和植物基因功能分析[3]。在拟南芥中,利用RNAi技术成功抑制一些参与生理代谢和生长发育基因表达,如AGAMOUS、CLAVATA3 和FAD2 等[4-5]。在烟草[6]、水稻[7]等作物上观察到双链RNA降低目的基因mRNA表达水平的现象,Tang等在利用RNAi技术改善植物营养价值的可行性方面进行了探讨[8]。
人参皂苷是人参属植物重要的次生代谢产物,有极广泛的生理和药理活性,包括提高机体免疫力、抗肿瘤、抗应激、抗炎、抗疲劳、增强记忆力、延缓衰老、降血糖、抗氧化等作用。人参皂苷含量较低,限制其开发与利用,因此如何提高其含量已成为研究热点,深入研究人参皂苷生物合成途径中关键酶基因的结构和功能,并利用基因工程手段调控这些关键酶基因的活性,达到调控人参皂苷含量目的,具有重要的理论和实际应用价值。鲨烯环氧酶(Squalene epoxidase,SE)是一种单加氧酶,是三萜皂苷生物合成途径中关键酶之一,其基因编码的酶催化鲨烯生成2,3-氧化鲨烯[9],鲨烯环氧酶是皂苷合成途径过程中最后一个通用酶[10]。研究证实体外诱导增加SE基因的mRNA表达,三萜生成量随之增加,降低SE基因的mRNA表达,三萜合成将受到抑制[11]。
本研究采用RT-PCR技术克隆得到人参SE基因片段,构建对应于SE基因的RNAi高效双元表达载体,利用RNA干扰技术抑制人参鲨烯环氧酶基因表达,有助于验证鲨烯环氧酶基因在三萜皂苷代谢途径中的重要功能,为以鲨烯环氧酶基因为基础的三萜皂苷合成途径调控研究奠定理论基础。
1 材料与方法
1.1 材料
菌株和载体:PUM-T快速克隆试剂盒(购自北京百泰克公司)。pMD18-T载体(购自TaRaKa公司)。大肠杆菌DH5α、pMHZ111载体均由本实验室保存。
试剂:胶回收试剂盒购于爱思进生物技术(杭州)有限公司,引物均由北京六合华大基因科技股份有限公司合成。
植物材料:供试材料为5年生人参嫩叶,由吉林农业大学生命科学学院细胞工程研究室提供。
1.2 方法
1.2.1 人参叶片总RNA的提取及RT-PCR反应
以5年生人参叶片为材料,采用改良的Trizol法(Invitrogen公司)提取总RNA,cDNA合成参照MBI公司RevertAidTMfirst strand cDNA Synthesis Kit反转录试剂盒进行。
1.2.2SE基因正义、反义片段的克隆与测序
根据SE基因及其保守区的基因信息利用软件primer 5.0设计人参SE干扰片段引物,并且根据pMHZ111表达载体的限制性内切酶酶切位点,在正义片段S引物两端分别加上XbaⅠ和BamHⅠ酶切位点,反义片段A引物两端分别加上XhoⅠ和HindⅢ酶切位点。引物序列如下:
正义片段S:
SE-S1: 5'TGCTCTAGACACTTTTATTAGGGG ATGC 3'
SE-S2: 5'CGCGGATCCAAGAAGTGGAGAAA TAGGC 3'
反义片段A:
SE-A1:5'CCGCTCGAGCACTTTTATTAGGGG ATGC 3'
SE-A2:5'CCCAAGCTTAAGAAGTGGAGAAA TAGGC 3'
采用25 μL反应体系,PCR扩增条件:94℃预变性5 min,94℃变性30 s,56℃退火45 s,72℃延伸45 s,循环35次,72℃后延伸7 min。将SE基因正义、反义片段的PCR产物纯化后分别连接T载体,将PCR验证正确的阳性重组子进行质粒DNA提取。选取PCR鉴定呈阳性的克隆进行酶切验证并测序。分别将测序正确的重组子命名为pMD18-T-S和pMD18-T-A。
1.2.3SE基因RNAi双元表达载体pMHZ111-SE的构建
由图1可知,pMHZ111载体具有多个酶切位点,利于干扰片段的连接,具有多种启动子。载体可作为普通RNAi表达载体使用,亦可作为双元干扰表达载体,在单子叶植物及双子叶植物中均可以表达。
利用XbaⅠ和BamHⅠ分别对测序正确的重组克隆质粒pMD18-T-S和pMHZ111进行正义片段双酶切,切胶回收,用回收的片段作正义连接,16℃连接过夜,转化大肠杆菌DH5α感受态细胞。选取长出的单菌落做PCR检测,检测出的阳性克隆摇菌提取质粒,将提取出的质粒和测序正确的pMD18-T-A进行XhoⅠ和HindⅢ反义片段双酶切,切胶回收,用回收的片段做反义连接,获得RNAi双元表达载体pMHZ111-SE。将其转化大肠杆菌,将已转化大肠杆菌的RNAi表达载体pMHZ111-SE进行菌落PCR扩增鉴定和酶切鉴定。
1.2.4 RNAi植物表达载体转化农杆菌GV3101
运用热激法转化农杆菌GV3101感受态细胞,并进行菌液PCR鉴定,将鉴定正确的转化子在抗性培养基中继代15代,进行pMHZ111-SE在农杆菌中的遗传稳定性分析。
1.2.5 人参愈伤组织的遗传转化
采用农杆菌介导转化法转化人参愈伤组织,23℃黑暗条件下培养3 d,再转入抑菌培养基。一周后转移到筛选培养基上进行筛选,待人参愈伤组织稳定生长时,用继代培养基继代。
1.2.6 抗性愈伤组织的PCR检测

图1 RNA干扰双元表达载体pMHZ111Fig.1 RNAi binary plant expression vector pMHZ111
将筛选出的人参愈伤组织采用CTAB法提取基因组DNA,以基因组DNA为模板,分别选用引物S1、P1和A1、P2进行PCR扩增。
1.2.7 人参皂苷的提取
将PCR鉴定正确的人参愈伤组织采用索式技术提取人参皂苷[12]。
1.2.8 皂苷含量的测定
运用高效液相色谱(High performance liquid chromatography,HPLC)法测定转基因和非转基因人参愈伤组织中6种主要单体皂苷Rb1、Rb2、Rc、Rd、Rg1、Re的含量(人参单体皂苷Rb1、Rb2、Rc、Rd、Rg1、Re对照品均购自中国药品生物制品检定所),比较分析单体皂苷含量差异。
2 结果与分析
2.1 正义片段SE-S和反义片段SE-A的克隆
以cDNA为模板,用引物SE-S1/SE-S2对正义片段S进行PCR扩增,用SE-A1/SE-A2对反义片段A进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测,结果显示扩增条带与预期364 bp的片段大小一致,初步表明已获得这两个干扰片段(见图2)。
2.2 重组质粒pMHZ111-SE的酶切鉴定
首先对重组质粒pMHZ111-SE进行菌落PCR鉴定,将鉴定正确的菌液提取质粒DNA,将阳性重组质粒pMHZ111-SE用XbaⅠ和BamHⅠ内切酶酶切,切出大小364 bp的正义片段及其余载体部分,将阳性重组质粒pMHZ111-SE用XhoⅠ和HindⅢ内切酶酶切,切出大小364 bp的反义片段及其余载体部分(见图3)。以上表明目的片段已和pMHZ111载体连接。
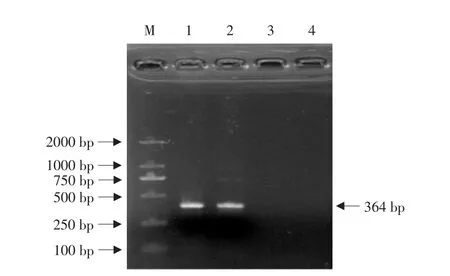
图2 正反义片段的PCR产物Fig.2 PCR product of sense and anti-sense fragment
2.3 抗性愈伤组织的PCR检测
根据pMHZ111中发夹内含子的序列信息设计PDK Intron的上游引物P1和下游引物P2,序如下:P1:5'AGCGAATTCTAGTATAAAATAGTTAA GTG 3',P2:5'ATGGAATTCCAATCCAAAT GTAA GATC 3'采用CTAB法提取抗性愈伤组织DNA,以P1、P2为引物,进行PCR验证,电泳结果如图4所示,由图4可见,得到大小为1 400 bp条带,符合内含子加上正义片段和反义片段长度,说明干扰载体pMHZ111-SE上目标片段已转入人参愈伤中。
2.4 转基因愈伤组织皂苷含量的测定
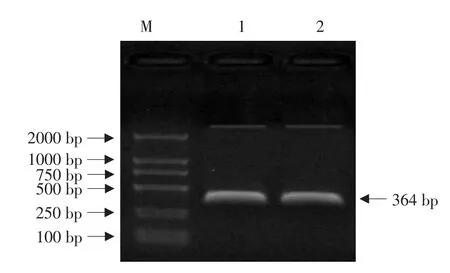
图3 重组质粒pMHZ111-SE酶切产物Fig.3 Recombinant plasmid digested product of pMHZ111-SE
采用索氏提取技术提取样品液,并用HPLC法测定阴性对照及转化后人参愈伤组织中6种主要单体皂苷Rb1、Rb2、Rc、Rd、Rg1、Re的含量。结果见图5。表明,经RNAi干扰后,Rg1、Re、Rc含量均有大幅度下降,其他3种皂苷含量变化不明显。人参皂苷生物合成过程不仅仅是由单基因控制,而是由多个基因控制,以及相关酶基因相互协同作用的结果。只抑制某一单基因的表达,对次生代谢终产物含量不会有显著影响;另外受转化材料限制,转化的人参愈伤组织较松散,不易除菌,有可能存在部分假阳性。
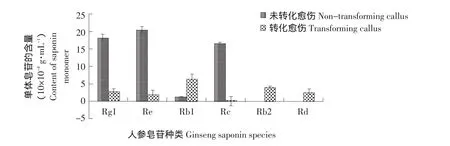
图5 人参愈伤组织中皂苷含量的变化Fig.5 Changes of saponin content of ginseng callus
3 讨论与结论
在通常情况下,人参根中总皂苷含量只占其干重5%[13],用传统方法从人参根中获得人参皂苷成本较高。因而针对皂苷生物合成途径限速酶调控机制,在分子水平上实现皂苷合成的定向调节是提高人参皂苷合成能力的有效手段。Lee等构建人参SQS正义植物表达载体并将其转化人参,结果表明达玛烷型和齐墩果烷型三萜皂苷含量比对照提高1.3~3.0倍[14]。
目前研究基因功能方法主要包括T-DNA插入突变、反义抑制、转座子插入突变等[15],传统阻断基因表达方法主要是反义RNA技术,反义RNA是在启动子下游连接一个反向的基因片段,从而使目的基因表达率降低,一般达85%。而本试验采用RNAi方法,与传统反义RNA方法相比,RNAi技术抑制基因表达效率更高,可达95%。
在构建RNAi载体时,要在启动子下游插入正向与反向的干扰片段,必须在两者之间有一段长度适当的内含子序列,以便在转入人参愈伤组织后形成发夹结构,由发夹结构形成约22 bp siRNA,由siRNA干扰SE基因表达,pMHZ111在启动子下游恰好有一个700 bp的内含子序列,符合构建干扰载体条件。
SE在人参皂苷合成的次级代谢中,主要作用是在角鲨烯的C=C双键中插入一个O原子使其成为环氧化物2,3-氧化角鲨烯,经一系列催化反应,形成包括人参皂苷在内的各种三萜类次生代谢产物。本研究基于人参皂苷生物合成途径,通过RNAi技术,抑制人参愈伤中鲨烯环氧酶基因的表达,结果导致皂苷合成减弱。表明调控SE基因可调控皂苷合成,即SE是人参皂苷合成途径关键酶。利用生物技术手段调控这些关键酶基因活性,提高人参中皂苷含量,为最终提高人参皂苷生物合成量提供重要理论依据,具有广阔应用前景。
[1]陈李淼,赵琳,郝迪萩,等.植物中RNA干扰技术的研究与应用[J].东北农业大学报,2009,40(10):122-128.
[2]Fire A,Xu S,Montgomery M K,et al.Potent and specific genetic interference by double-stranded RNA inCaenorhabditis elegans[J].Nature,1998,391(6669):806-811.
[3]Voinnet O.RNA silencing as a plant immune system a-gainst viruses[J].Trends Genet,2001,17:449-459.
[4]Chuang C F,Meyerowitz E M.Specific and heritable genetic interference by double-stranded RNA inArabidopsis thaliana[J].Proc Natl Acad Sci USA,2000,97:4985-4990.
[5]Stoutjesdijk P A,Singh S P,Liu Q,et al.hpRNA-mediated targeting of theArabidopsis FAD2 gene gives highly efficientand stable silencing[J].Plant Physiol,2002,129:1723-1731.
[6]Smith N A,Singh S P,Wang M B,et al.Total silencing by intron spliced hairpin RNAs[J].Nature,2000,407:319-320.
[7]Kanno T,Naito S,Shimamoto K.Post-transcriptional gene silencing in cultured rice cells[J].Plant Cell Physio,2000,41,321-326.
[8]Tang G L,Li G G.Using RNAi to improve plant nutritional value:From mechanism to application[J].Trends in Biotechnology,2004,22(9):463-469.
[9]Jennings S M,Tsay Y H,Fisch T M,et al.Molecular cloning and characterization of the yeast gene for squalene synthetase[J].Proc Natl Acad Sci U S A,1991,88(14):6038-6042.
[10]吴琼,周应群,孙超,等.人参皂苷生物合成和次生代谢工程[J].中国生物工程杂志,2009,29(10):102-108.
[11]Daraselia N D,Tarchevskaya S,Narita J O.The promoter for tomato 3-hydroxy-3-methylglu taryl coenzyme A reductase gene 2 has unusual regulatory elements that direct high-level expression[J].Plant Physio,1996,112(2):727-733.
[12]刘伟灿,张美萍,李超生,等.西洋参各部位皂苷成分的HPLC测定[J].人参研究,2010(1):20-23.
[13]张崇禧,郑友兰,张春红,等.不同方法提取人参总皂苷工艺的优化研究[J].人参研究,2003(4):5-8.
[14]Lee M H,Jeong J H,Seo J W,et al.Enhanced triterpene and phytosterol biosynthesis in panax ginseng overexpressing squalene synthase gene[J].Plant Cell Physio,2004,45(8):976-984.
[15]李文滨,李胜畅,王志坤.核因子Y在植物中的分类及其功能概述[J].东北农业大学学报,2012,43(1):12-17.

