葡萄果实(E)-β-丁香烯合酶基因的克隆及其表达分析
陶 然,任国慧,房经贵,李晓鹏,李阿英
(南京农业大学园艺学院,江苏南京210095)
香气在果实品质构成中是一项重要的经济性状,多样的香气成分使果实具备了不同的风味特点[1]。果树是大田与经济作物中以果实为直接食用部分的主要作物种类,果实中富含的香味成分决定了其特有的食用价值[2]。葡萄(Vitis vinifera Linn.)素有“水果皇后”的美称,是一种加工产品颇为丰富的水果,在世界果树栽培中属于种植面积较大的果树树种[3]。目前从葡萄果实中已鉴定出800 多种芳香成分[4],一些低分子量的挥发性萜类化合物(如单萜和倍半萜等)还是许多鲜食和酿酒葡萄品种特有的风味和香气成分[5-7]。有关葡萄果实芳香成分的研究[8-9]较多。近年来,随着植物代谢工程的兴起,许多果实风味成分的生物合成途径及其相关酶的重要性逐渐明晰。葡萄全基因组测序的结果表明:葡萄所包含的“制造”香气中萜类化合物的“香味基因”数目是已经完成基因组测序的其他植物的2 倍[10]。这些研究结果都为在分子水平上对葡萄香气成分的合成以及葡萄品质的改良提供了有益的参考与新的思路。
萜类化合物属植物次生代谢产物,因其种类繁多、结构多样,被认为是自然界中最大的一类复合物家族,由4 万多种成分组成[11]。在果实香气成分合成的三大主要途径中,萜类合成途径就是其中之一[12]。萜类合酶(terpenoid synthase,TPS)是萜类化合物合成的直接催化者,也是萜类生物合成中研究较多的一类关键酶,统称为TPS 家族。按形成产物的不同,TPS 家族酶可分为单萜合酶、倍半萜合酶和二萜合酶等,它们分别以牻牛儿基焦磷酸(geranyl diphosphate,GPP)、橙花基焦磷酸(neryl diphosphate,NPP)、法呢基焦磷酸(farnesyl diphosphate,FPP)和牻牛儿酰牻牛儿基焦磷酸(geranylgeranyl diphosphate,GGPP)为直接前体底物合成相应的单萜、倍半萜和二萜成分[13]。此外,一些萜类合酶的构成特性使其可催化单一底物产生多个萜类产物,因此很多TPS 都以主产物命名[14]。Martin 等[15]从葡萄品种‘琼瑶浆’(‘Gewürztraminer’)和‘黑比诺’(‘Pinot noir’)中分别克隆得到了 3 个(VvGwECar1、VvGwECar2 和VvGwECar3)和 2 个(VvPNECar1 和 VvPNECar2)萜类合酶家族基因,大肠杆菌体外表达结果显示它们编码的酶生成的主要产物都为(-)-丁香烯,与此同时也不同程度地产生了部分α-葎草烯和香叶烯D,因而这5 个基因编码的酶均被称为(E)-β-丁香烯合酶。目前,在葡萄果实发育时期有关(E)-β-丁香烯合酶基因调控表达方面的研究尚未见报道。
为了对葡萄(E)-β-丁香烯合酶基因有进一步认识,作者以欧美杂种中具有典型香味的酿酒葡萄品种‘德引84-1’(‘Deyin 84-1’)为实验材料,成功分离出 (E)- β - 丁 香 烯 合 酶 〔(E)-β-caryophyllene synthase〕基因,并统一命名为Vv-ECar,在比较其序列特征的基础上对葡萄果实发育时期Vv-ECar 的半定量和定量表达进行了分析,以期为葡萄果实中萜类成分的调控机制研究奠定基础。
1 材料和方法
1.1 电子克隆
以与编码葡萄倍半萜合酶基因同源性较高的EST 序列(序列号 EC953713.1)作为探针,对葡萄属(Vitis Linn.)EST 数据库进行 BLAST 检索,得到多条与之高度同源的葡萄EST 序列。将获得的EST 序列用DNAMAN 软件进行首尾拼接,获得新的Contig,将获得的 Contig 反复对葡萄 EST 公共数据库进行BLAST 检索及拼接,直到没有新的EST 序列可供拼接为止。最终拼接得到的目的基因可能的全长cDNA序列长度为1 843 bp。
1.2 实验克隆
1.2.1 材料 供试材料为酿酒葡萄品种‘德引84-1’,于2011 年采自中国农业科学院郑州果树研究所;分别于葡萄盛花后20、40、60 和80 d(即果实发育的幼果期、膨大期、转色期和成熟期),从标记植株的东、西、南、北4 个方向各选1 ~2 穗果,从每穗果的上、中、下、里、外各方位取大小一致的果实4 ~5 粒,其中幼果期采果约100 粒,其他时期各采果约50 粒;所有样品采集后立即投入液氮并带回实验室将种子剔除(处于幼果期的果实较小,无法剔除种子),然后将样品全部贮存于-70 ℃用于总RNA 的提取。
大肠杆菌菌株DH5α 由作者所在实验室保存。PowerScript ⅡTM反转录酶购自美国 Clontech 公司;DNaseⅠ酶、LA Taq 酶、Ex Taq 酶、pMD18-T Simple 载体、dNTP 和DNA Marker 均购自宝生物工程(大连)有限公司;TrizolR○Reagent 购自美国Invitrogen 生命技术公司;荧光定量染料SYBR GreenⅠ购自东洋纺(上海)生物科技有限公司;DNA 回收试剂盒及DL2000 Plus DNA Marker 由北京全式金生物技术有限公司生产;PloyA TtractR○mRNA Isolation System Ⅳ试剂盒由美国Promega 公司生产。所用的10 个引物由上海英骏生物技术有限公司合成,其序列及用途见表1。

表1 用于葡萄果实Vv-ECar 基因克隆的引物序列及用途Table 1 Sequence and use of primers used for cloning of Vv-ECar gene of Vitis vinifera Linn. fruit
1.2.2 RNA 提取与纯化 采用改良 CTAB 法[16-17]提取葡萄果实总RNA;采用PloyA TtractR○mRNA Isolation System Ⅳ试剂盒进行mRNA 的纯化。
1.2.3 cDNA 合成 以葡萄 mRNA 为模板,用引物P01 反转录合成cDNA 第1 条链,用引物P02 延伸加帽子,在空气加热条件下于42 ℃保温1 h、75 ℃保温10 min,于冰上冷却2 min 后置于-70 ℃保存备用。
1.2. 4 基因开放阅读框( ORF) 的扩增 以上述cDNA 为模板用引物P03 和P04 进行PCR 扩增,反应体系总体积 50 μL,包含 cDNA 2.0 μL、10 μmol·L-1引物各 2.0 μL、5 U·μL-1Ex Taq 酶 0. 50 μL、10×PCR buffer(Mg2+plus)5.0 μL、2. 5 mmol·L-1dNTP Mixture 4. 0 μL 和双蒸水 34. 5 μL。扩增程序为:94 ℃预变性5 min;94 ℃变性45 s、55 ℃退火45 s、72 ℃ 延伸90 s,共35 个循环;最终于72 ℃ 延伸5 min。用质量体积分数1.0%琼脂糖凝胶对获得的PCR 扩增产物进行电泳,切下目的片段并用DNA 凝胶回收试剂盒回收目标片段并进行TA 克隆,DNA 测序由上海博亚生物技术有限公司完成。
1.2.5 基因3'末端 PCR 扩增 以上述 cDNA 为模板用引物P05 和P06 进行PCR 扩增获得基因的3'末端(3'UTR 区)。反应体系总体积25 μL,包含 cDNA 1.0 μL、引物各1.0 μL、5 U·μL-1Ex Taq 酶0.15 μL、10×PCR buffer(Mg2+plus)2.5 μL、2.5 mmol·L-1dNTP Mixture 2.0 μL 和双蒸水 17.35 μL。扩增程序为:94 ℃预变性5 min;94 ℃变性40 s、54 ℃退火40 s、72 ℃延伸40 s,35 个循环;最后于72 ℃延伸 10 min。用质量体积分数2.0%琼脂糖凝胶对获得的PCR 扩增产物进行电泳检测,然后用DNA 回收试剂盒回收目标片段并进行TA 克隆,DNA 测序由上海博亚生物技术有限公司完成。
1.2.6 生物信息学分析 利用DNAMAN 软件对Vv-ECar 的ORF、3'末端序列进行拼接分析;并分别利用NCBI 的 BLASTn 和 BLASTp(http:∥blast. ncbi. nlm.nih.gov/Blast.cgi)将基因的核苷酸序列和氨基酸序列与茶〔Camellia sinensis (Linn.)O. Kuntze〕、毛果杨(Populus trichocarpa Torr. et A. Gray)、美味猕猴桃(Actinidia deliciosa C. F. Liang et A. R. Ferguso)、箭叶 橙 (Citrus hystrix DC.)、杨 (Populus balsamifera subsp. trichocarpa×P. deltoids)和香椿〔Toona sinensis(A. Juss.)Roem.〕的相应序列进行相似性分析。
1.3 Vv-ECar 基因的表达分析
从不同时期果实中提取总 RNA,用DNaseⅠ酶(RNase free)消化和 CHCl3抽提,然后分别取2 μg,用引物P01 逆转录合成的cDNA 为模板,采用Primer-BLAST(http:∥www. ncbi. nlm. nih. gov/tools/primerblast)设计的引物P09 和P10 进行半定量RT-PCR 和荧光定量PCR 分析,以确定Vv-ECar 在果实发育时期相对表达水平的变化。为确保半定量RT-PCR 和荧光定量PCR 的特异性,引物P09 和P10 被设计在Vv-ECar 基因的3'非翻译区(3'UTR),内参基因是利用葡萄UBI 的特异性引物P07 和P08 扩增获得的长度为141 bp 的基因片段。定量RCR 反应在Rotor-Gene 荧光定量 PCR 仪上进行,实验体系设置参照SYBR GreenⅠ说明书,每个样品重复检测3 次。实验数据采用 Lin-RegPCR[18]和 Excel 2003 软件进行分析。
2 结果和分析
2.1 葡萄果实 Vv-ECar 基因的克隆
根据电子克隆的Vv-ECar 的cDNA 全长设计简并引物P03 和P04,以葡萄品种‘德引84-1’果肉总RNA 逆转录的cDNA 第1 链为模板,扩增获得长度为1 674 bp 的全长开放阅读框ORF(图1-A)。利用引物P05 和P06 进行3'RACE 克隆,得到长度为209 bp的3'末端(图1-B),将引物3'端和ORF 全长拼接获得 Vv-ECar 基因 cDNA,全长为1 880 bp。Vv-ECar 的全长序列包括长度为1 674 bp 的ORF、209 bp 的3'非翻译区(3'UTR)以及28 bp 的poly+(A),经推导其氨基酸序列含有557 个氨基酸。该基因的GenBank 登录号为JF808010。
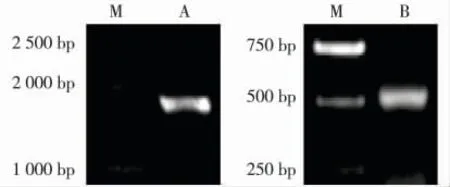
图1 葡萄果实Vv-ECar 基因的PCR 扩增结果Fig. 1 PCR amplification result of Vv-ECar gene of Vitis vinifera Linn. fruit
2.2 葡萄果实Vv-ECar 基因的序列分析
利用DNAMAN 将克隆获得的Vv-ECar 编码区序列与Martin 等[15]在葡萄品种‘琼瑶浆’和‘黑比诺’中已克隆得到的 VvGwECar1、VvGwECar2、VvGwECar3、VvPNECar1 和 VvPNECar2 等 5 个(E)-β-丁香烯合酶基因编码区序列进行比对,发现 Vv - ECar 与VvGwECar2 同源性最高,可达93%,与其他4 个基因的同源性也都在60% 以上。该序列的编码区与VvGwECar2 的编码区序列长度相同,都为1 674 bp,其中存在110 个碱基替换,包括30 个颠换和80 个转换。比对结果也表明:这2 个序列编码的氨基酸序列同源性也高达90.8%,氨基酸残基仅在51 个位点上有差异;此外,2 个氨基酸序列都从第310 位至第314位具有植物萜类合酶家族共有的1 个天冬氨酸富集基序(DDXXD)。因此可初步推断在本研究中克隆获得的基因为(E)-β-丁香烯合酶基因。
同源性比对结果显示:葡萄Vv-ECar 基因的核苷酸序列与茶(JQ247185.1)、毛果杨(JF449450.1)、美味猕猴桃(AY789791.1)、箭叶橙(HQ652871.1)、杨(AY438099.1)、香椿(AB509224.1)等植物的萜类合酶基因的序列同源性高达70%以上,其中与茶和杨的序列同源性高达73%。从进化树(图2)上也可看出:葡萄品种‘德引84-1’果实Vv-ECar 基因所编码的氨基酸序列与其他植物同源基因编码的氨基酸序列具有高度保守性。
2.3 葡萄果实发育期Vv-ECar 基因的表达分析
分别采用半定量RT-PCR 和荧光定量PCR 对葡萄果实发育期Vv-ECar 基因的表达状况进行分析,结果见图3。分析结果表明:采用荧光定量PCR 检测的葡萄果实发育期Vv-ECar 基因的相对表达量与半定量RT-PCR 结果一致。总体上看,在幼果期Vv-ECar表达最强,伴随果实的不断发育相对表达量逐渐下降,在果实成熟期时相对表达量又明显上升。
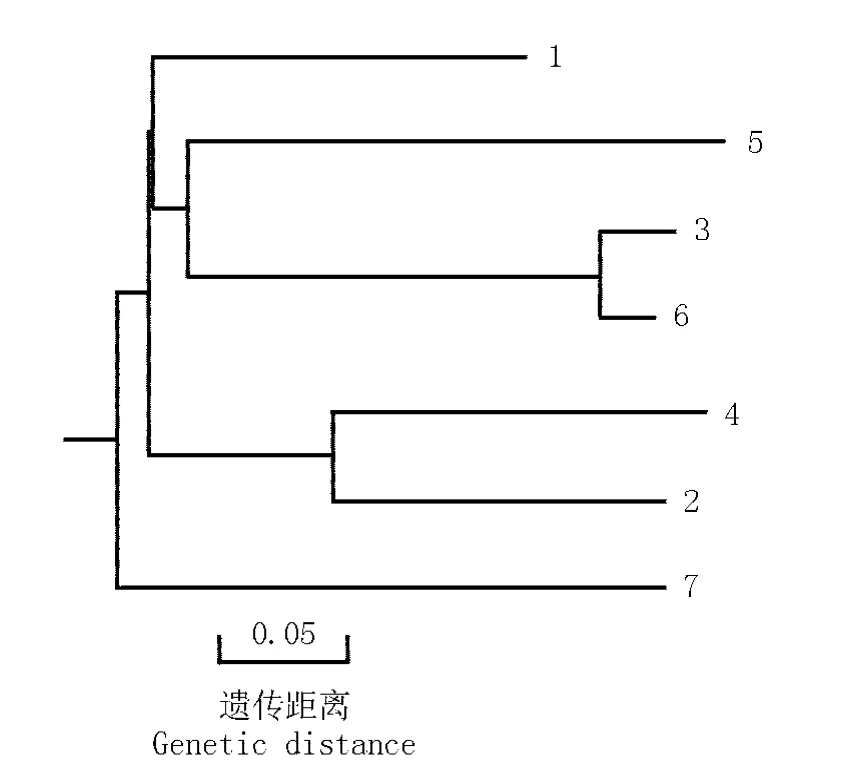
图2 葡萄果实Vv-ECar 基因与其他植物同源基因编码的氨基酸序列的分子进化树Fig. 2 Molecular phylogenetic tree of amino acid sequences encoded by Vv-ECar gene from Vitis vinifera Linn. fruit and homologous genes from other plants
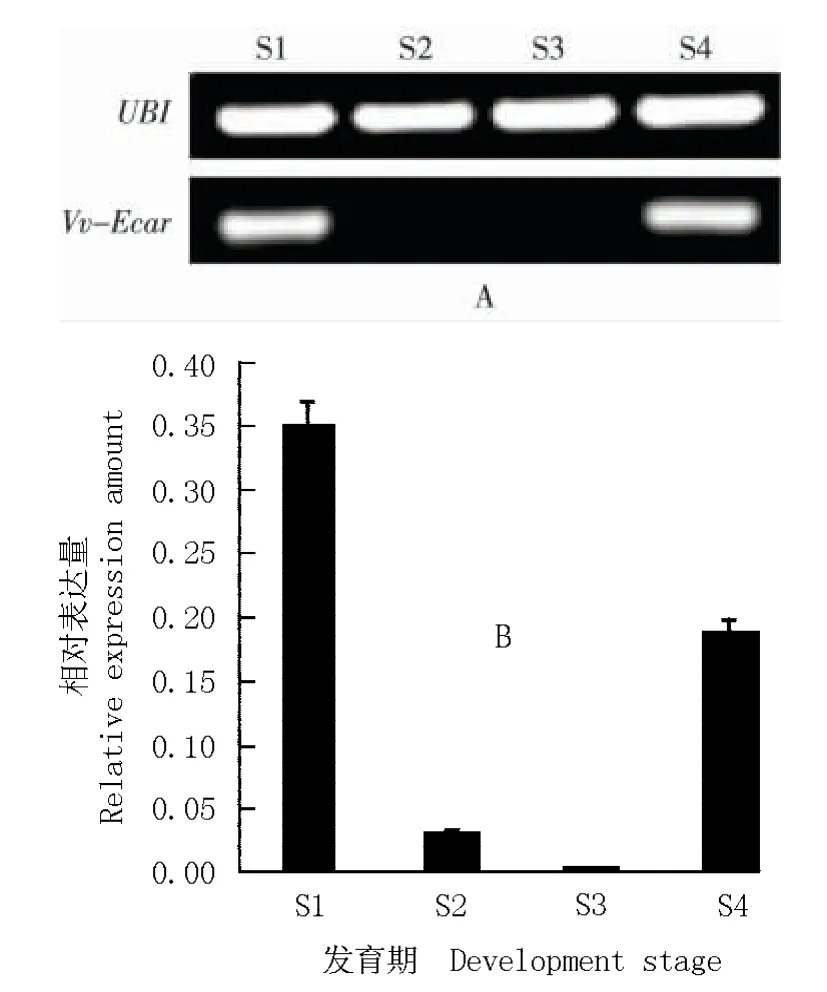
图3 葡萄果实不同发育时期Vv-ECar 基因表达的半定量RT-PCR和定量PCR 分析结果Fig. 3 Analysis results of semi-quantitative RT-PCR and quantitative PCR of Vv-ECar gene expression during different development stages of Vitis vinifera Linn. fruit
3 讨 论
葡萄果实香气是构成葡萄酒香气的重要组分之一,与发酵香和陈酿香共同构成了葡萄酒的香气和风格[19]。作者利用生物信息学方法同源克隆获得了与葡萄香气品质相关的(E)-β-丁香烯合酶基因Vv-ECar,该基因的核苷酸序列与 Martin 等[15]在葡萄品种‘琼瑶浆’和‘黑比诺’果实中克隆获得的5 个基因具有较高的同源性,与来源于茶、毛果杨、美味猕猴桃、箭叶橙、杨和香椿的萜类合酶的相关基因的同源性也较高,此外,葡萄Vv-ECar 基因编码的氨基酸具有萜类合酶家族的共有基序,因此可推断本研究克隆获得的cDNA 序列是葡萄Vv-ECar 基因。
萜类化合物种类繁多,是植物次生代谢物中种类最多的一类,更是特有香气组成的重要成分之一。通常萜类化合物的积累始于果实变色期,且随着葡萄果实的成熟总体含量逐渐上升,在葡萄果实过度成熟时萜类化合物含量最高[20]。葡萄果实发育过程中香气成分含量的变化主要集中于转色期到成熟期[21-22]。而作者的研究结果显示:葡萄Vv-ECar 基因在果实发育初期表达最强,随后逐渐减弱,在成熟期时该基因表达又明显增强。Lücker 等[23]的研究结果表明:葡萄种子特别是幼小种子中含有较多的萜类合酶,而在种子其后的发育过程中几乎无萜类合酶基因的表达,且处于发育阶段的果实(包括种子在内)中萜类合酶基因的表达都十分微弱。在本研究中,葡萄幼果期Vv-ECar 基因相对表达水平最高,也可能与幼果中含有幼嫩种子有关。Wilson 等[24]认为:在熟透的麝香葡萄(Vitis vinifera‘Muscat Hamburg’)中,萜类化合物的含量随着果实中糖分和一些单萜类化合物的积累达到峰值。作者认为葡萄果实成熟期萜类化合物含量较高,与葡萄果实发育后期Vv-ECar 基因表达量的明显上升有关。
[1]CHEN X Y,CHEN Y,HEINSTEIN P,et al. Cloning,expression,and characterization of(+)-δ-cadinene synthase:a catalyst for cotton phytoalexin biosynthesis[J]. Archives of Biochemistry and Biophysics,1995,324(2):255-266.
[2]李晓颖,谭洪花,房经贵,等. 果树果实的风味物质及其研究[J]. 植物生理学报,2011,47(10):943-950.
[3]冷翔鹏,张演义,张春华,等. 基于葡萄EST 数据库糖代谢途径有关基因的分析[J]. 植物生理学报,2012,48(3):289-297.
[4]ORTEGA-HERAS M,GONZÁLEZ-SANJOSÉ M L,BELTRÁN S.Aroma composition of wine studied by different extraction methods[J]. Analytica Chimica Acta,2002,458(1):85-93.
[5]BUCHBAUER G,JIROVETZ L,WASICKY M,et al. Headspace analysis of Vitis vinifera (Vitaceae)flowers[J]. Journal of Essential Oil Research,1994,6(3):311-314.
[6]BUCHBAUER G,JIROVETZ L,WASICKY M,et al. Aroma von weißweinblüten:korrelation sensorischer daten mit headspaceinhaltsstoffen[J]. Zeitschrift für Lebensmittel-Untersuchung und-Forschung,1994,199(1):1-4.
[7]BUCHBAUER G,JIROVETZ L,WASICKY M,et al. Aroma von rotweinblüten: korrelation sensorischer daten mit headspaceinhaltsstoffen[J]. Zeitschrift für Lebensmittel-Untersuchung und-Forschung,1995,200(6):443-446.
[8]涂正顺,薛 洁,常 伟,等. 吉林地区山葡萄果实香气成分的GC/MS 分析[J]. 西北农林科技大学学报:自然科学版,2007,35(10):66-70.
[9]张振华,葛毅强,倪元颖,等. 葡萄芳香物质研究进展[J]. 食品科学,2004,25(4):181-184.
[10]JAILLON O,AURY J M,NOEL B,et al. The grapevine genome sequence suggests ancestral hexaploidization in major angiosperm phyla[J]. Nature,2007,449:463-467.
[11]宋丽娟,李雄伟,陈 琳,等. 果实香气合成与遗传控制研究概述[J]. 果树学报,2008,25(5):708-713.
[12]GANG D R. Evolution of flavors and scents[J]. Annual Review of Plant Biology,2005,56:301-325.
[13]SCHILMILLER A L,SCHAUVINHOLD I,LARSON M,et al.Monoterpenes in the glandular trichomes of tomato are synthesized from a neryl diphosphate precursor rather than geranyl diphosphate[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(26):10865-10870.
[14]徐应文,吕季娟,吴 卫,等. 植物单萜合酶研究进展[J]. 生态学报,2009,29(6):3188-3197.
[15]MARTIN D M,AUBOURG S,SCHOUWEY M B,et al. Functional annotation,genome organization and phylogeny of the grapevine (Vitis vinifera)terpene synthase gene family based on genome assembly,FLcDNA cloning,and enzyme assays[J]. BMC Plant Biology,2010,10:226.
[16]张彦苹,王 晨,于华平,等. 适于葡萄不同组织RNA 提取方法的筛选[J]. 西北农业学报,2010,19(11):135-140.
[17]CHANG S J,PURVEAR J,CAIRNEY J C. A simple and efficient method for isolating RNA from pine trees[J]. Plant Molecular Biology Reporter,1993,11:113-116.
[18]RAMAKERS C,RUIJTERA J M,LEKANNE DEPREZA R H,et al. Assumption-free analysis of quantitative real-time polymerase chain reaction (PCR)data[J]. Neuroscience Letters,2003,339(1):62-66.
[19]李 华. 葡萄酒品尝学[M]. 北京:科学出版社,2006:59-65.
[20]EBELER S E,THORNGATE J H. Wine chemistry and flavor:looking into the crystal glass[J]. Journal of Agricultural and Food Chemistry,2009,57(18):8098-8108.
[21]COELHO E,ROCHA S M,DELGADILLO I,et al. Headspace-SPME applied to varietal volatile components evolution during Vitis vinifera L. cv.‘Baga’ripening[J]. Analytica Chimica Acta,2006,563(1/2):204-214.
[22]COELHO E,ROCHA S M,BARROS A S,et al. Screening of variety- and pre-fermentation-related volatile compounds during ripening of white grapes to define their evolution profile[J].Analytica Chimica Acta,2007,597(2):257-264.
[23]LÜCKER J,BOWEN P,BOHLMANN J. Vitis vinifera terpenoid cyclases:functional identification of two sesquiterpene synthase cDNAs encoding (+)-valencene synthase and (-)-germacrene D synthase and expression of mono-and sesquiterpene synthases in grapevine flowers and berries[J]. Phytochemistry,2004,65(19):2649-2659.
[24]WILSON B,STRAUSS C R,WILLIAMS P J. Changes in free and glycosidically bound monoterpenes in developing muscat grapes[J].Journal of Agricultural and Food Chemistry,1984,32(4):919-924.

