黄土高原半灌木达乌里胡枝子和铁杆蒿对土壤干旱胁迫的生理响应
蔡 马,韩蕊莲,靳淑静,郭 颖,梁宗锁2a,,3
(1. 仲恺农业工程学院生命科学学院,广东 广州510225;2. 西北农林科技大学:a. 水土保持研究中心,b. 生命科学学院,陕西杨凌712100;3. 中国科学院水利部水土保持研究所,陕西杨凌712100)
植物生长极易受环境中非生物因子的胁迫,干旱是对植物生长影响最大的环境因素之一。植物体内始终存在活性氧的产生和清除2 个过程,在正常情况下,二者处于平衡状态,而在逆境或是衰老过程中,自由基代谢平衡被破坏,产生的自由基对细胞和组织产生毒害[1]。干旱胁迫对植物的伤害主要表现在对植物的氧化胁迫[2],植物细胞内活性氧自由基产生与清除的不平衡导致膜脂过氧化作用的发生。为保护自身免受活性氧的伤害,植物体内存在着非酶抗氧化剂和抗氧化酶类2 类内源保护系统。植物抗逆性的高低取决于保护酶系统防御能力的强弱,而保护酶系统的防御能力是由多个抗氧化酶彼此间的协调能力决定的,不同酶的活性高低因植物种类、生物学特性、胁迫方式、胁迫程度及时间存在一定差异[3-4];植物通过积累渗透调节物质(如脯氨酸和可溶性蛋白质)和提高抗氧化酶(如超氧化物歧化酶SOD、过氧化物酶POD 和过氧化氢酶CAT 等)活性,抵御和适应干旱逆境[5-10]。在干旱逆境环境中抗氧化性强的植物,其保护酶活性仍能维持较高的水平,抑制活性氧积累,进而能减轻膜脂过氧化对细胞的伤害。膨压是维持植物正常生长的关键因素,其丧失将抑制植物生长;水分胁迫条件下,细胞通过溶质增加和渗透势降低维持叶水势降低后的膨压,并维持一定的气孔开度,由此通过渗透调节能力[11]来调整和适应干旱胁迫。
作者选用黄土高原地区2 种常见的半灌木达乌里胡枝子〔Lespedeza daurica (Laxm.)Schindl.〕和铁杆蒿(Artemisia sacrorum Ledeb.)为研究对象,系统研究不同土壤干旱胁迫条件下2 种植物体内保护酶活性与渗透调节物质的动态变化规律,以期揭示黄土高原乡土半灌木的抗旱生理机制以及抗旱性差异,旨在为黄土高原退耕还林坡地建设中树种的选择和应用提供理论依据。
1 材料和方法
1.1 实验材料与处理
供试材料为黄土高原群落演替中典型优势半灌木达乌里胡枝子和铁杆蒿的天然实生苗,采自陕西省安塞县中国科学院安塞水土保持综合试验站的野生封育坡面,于初春植物地上部未萌发之前挖取大小基本一致的根称取质量后栽植。
实验在中国科学院水利部水土保持研究所透光遮雨棚内进行。选取大小基本一致的根于2008 年4月初栽植于塑料桶(高27 cm、上口径35 cm、下口径22 cm)中;栽培基质为V(过筛垆土)∶V(蚯蚓粪)=3∶1的混合基质,其田间最大持水量(θf)为24%。参照文献[12]设置 3 个干旱处理水平:适宜水分(75% θf,CK)、中度亏缺(55% θf)、重度亏缺(35%θf),每桶栽植3 株,每处理6 个重复;各处理另设空白桶(裸土,不栽培植物),用于土壤蒸发量测定。栽植后充足浇水,待根正常萌芽成活后按照干旱处理水平进行水分控制,待土壤水分自然消耗至设定水平后,用电子称(载量30 kg、感量5 g)称取质量并将土壤含水量控制在设定水平,定时补充水分,准确记录加水量,使各处理的土壤含水量在实验期间保持在设定范围内。
1.2 测定项目与方法
分别于 2008 年 6 月 12 日、6 月 29 日、7 月 16 日、8 月 2 日和 8 月 19 日的 9:00 至 10:00 采集叶片进行各项指标测定。剪取每桶中3 株植株由顶部向下第2和第3 位的外围完全展开、长势一致的功能叶,混合后迅速装入自封袋并置于预冷的冰盒中,带回实验室进行相关指标测定。
1.2.1 酶液制备 称取 0.300 ~1.000 g 鲜叶,加 20 mmol·L-1KH2PO43.0 mL,于冰浴中研磨至匀浆,转移至10 mL 容量瓶中,用磷酸缓冲液冲洗研钵2 ~3 次(每次1 ~2 mL),冲洗液一并移入容量瓶中并定容至10 mL,摇匀;取5 mL 提取液于离心管中,在4 ℃、10 000 r·min-1离心 15 min,上清液即为酶粗提液,于-40 ℃冰箱中保存、待测。
1.2.2 生理生化指标测定 SOD 活性测定采用氮蓝四唑光还原法[13]211-213;CAT 活性测定采用紫外吸收法[13]214-216;采用愈创木酚显色法[13]217-218测定 POD活性;采用抗坏血酸氧化法[13]218-219测定 APX 活性;采用磺基水杨酸提取、茚三酮显色法[13]228-231测定游离脯氨酸含量;丙二醛(MDA)含量测定采用硫代巴比妥酸比色法[13]210-211;可溶性蛋白质含量测定采用考马斯亮蓝 G-250 染色法[13]142-143。
1.3 数据处理
采用Excel 2003 软件对实验数据进行统计和处理。
2 结果和分析
2.1 对叶片保护酶系统的影响
2.1.1 对SOD 活性的影响 土壤干旱胁迫条件下达乌里胡枝子和铁杆蒿叶片SOD 活性的变化见图1。由图1 可以看出:在重度和中度干旱条件下达乌里胡枝子和铁杆蒿叶片的SOD 活性与对照差异不显著,且均呈现相似的变化趋势,即随着胁迫时间的延长SOD 活性逐渐增加,且同一时期不同处理间SOD 活性差异不显著。此外,同一时期同一干旱胁迫处理条件下,达乌里胡枝子叶片的SOD 活性均高于铁杆蒿。说明在干旱胁迫条件下达乌里胡枝子和铁杆蒿中SOD 活性在清除活性氧方面有着重要的作用。
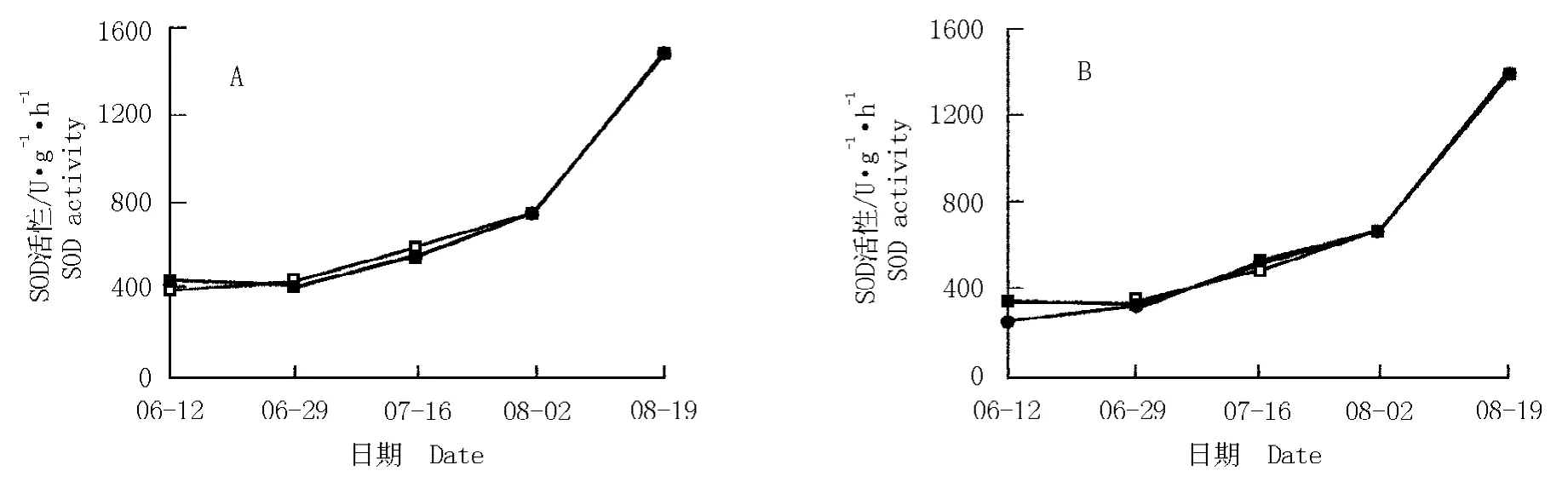
图1 土壤干旱条件下达乌里胡枝子(A)和铁杆蒿(B)叶片SOD 活性的动态变化Fig. 1 Dynamic change of SOD activity in leaves of Lespedeza daurica (Laxm.)Schindl.(A)and Artemisia sacrorum Ledeb.(B)under soil drought condition
2.1.2 对POD 活性的影响 干旱胁迫条件下达乌里胡枝子和铁杆蒿叶片POD 活性的变化见图2。由图 2-A 可见:在适宜水分(75%θf,对照)条件下,达乌里胡枝子叶片的POD 活性随处理时间延长呈先升高后降低再升高然后又降低的变化趋势,但变化幅度不大;在中度干旱胁迫(55%θf)条件下,其叶片的POD活性随处理时间延长呈现前期和中期缓慢升高、后期稍有降低的变化趋势,且总体变化幅度不大;而在重度干旱胁迫(35%θf)条件下,其叶片POD 活性随处理时间延长呈现前期大幅提高、至7 月16 日达到最高后急剧下降的变化趋势(呈倒“V”型),且总体变化幅度极大。总体上看,在胁迫的中后期,3 个处理组达乌里胡枝子叶片的POD 活性差异不明显,说明在干旱胁迫条件下达乌里胡枝子体内的POD 表现出良好的保护效应。
由图2-B 可见:在土壤重度干旱、中度干旱及适宜水分条件下,铁杆蒿叶片的POD 活性具有相似的变化趋势,即随处理时间的延长呈先逐渐升高然后逐渐降低的变化趋势,但POD 活性的最高点有差异。其中,在重度干旱条件下其POD 活性在7 月16 日达到最高值;而在中度干旱及适宜水分条件下 POD 活性在8 月2 日达到最高值。总体上看,在处理的前中期,POD 活性在重度干旱条件下均最高、在中度干旱条件下均最低;而在处理的中后期,POD 活性在适宜水分条件下均最高、在重度干旱条件下均最低。表明重度干旱条件下铁杆蒿体内POD 活性受到影响。比较而言,在重度干旱条件下,达乌里胡枝子叶片POD活性的变化幅度大于铁杆蒿。

图2 土壤干旱条件下达乌里胡枝子(A)和铁杆蒿(B)叶片POD 活性的动态变化Fig. 2 Dynamic change of POD activity in leaves of Lespedeza daurica (Laxm.)Schindl.(A)and Artemisia sacrorum Ledeb.(B)under soil drought condition
2.1.3 对CAT 活性的影响 干旱胁迫条件下达乌里胡枝子和铁杆蒿叶片CAT活性的变化见图3。由图3-A 可见:在土壤重度干旱、中度干旱及适宜水分(对照)条件下,达乌里胡枝子叶片的CAT 活性具有相似的变化趋势,即随处理时间的延长呈先降低再升高又降低的变化趋势,但CAT 活性的最高点以及同一时期CAT 活性有差异。其中,在处理的中前期,在重度干旱条件下CAT 活性均最高且7 月16 日达到最高值,而适宜水分条件下的CAT 活性均最低;而在处理的中后期,在适宜水分及中度干旱条件下CAT 活性均在8 月2 日达到最高值,且对照组的CAT 活性均最高,而重度干旱处理组的CAT 活性均最低。整体上看,在整个处理期间,在重度干旱条件下达乌里胡枝子叶片CAT 活性变化幅度大于中度干旱和适宜水分条件下,说明严重干旱加速了达乌里胡枝子体内活性氧清除的酶促反应。
由图3-B 可见:在土壤重度干旱、中度干旱及适宜水分条件下,铁杆蒿叶片的CAT 活性均在7 月16日达到最高值,然后急剧降低并趋于稳定。不同的是,在重度和中度干旱条件下,处理的前中期铁杆蒿的CAT 活性均呈先降低然后急剧升高的趋势,而在适宜水分条件下的前中期CAT 活性则呈逐渐升高的趋势。总体上看,2 个处理组的CAT 活性均高于对照且变化幅度也大于对照。
比较结果表明:整体上看,在土壤干旱条件下,铁杆蒿叶片CAT活性高于达乌里胡枝子,其对干旱适应调节能力较强。
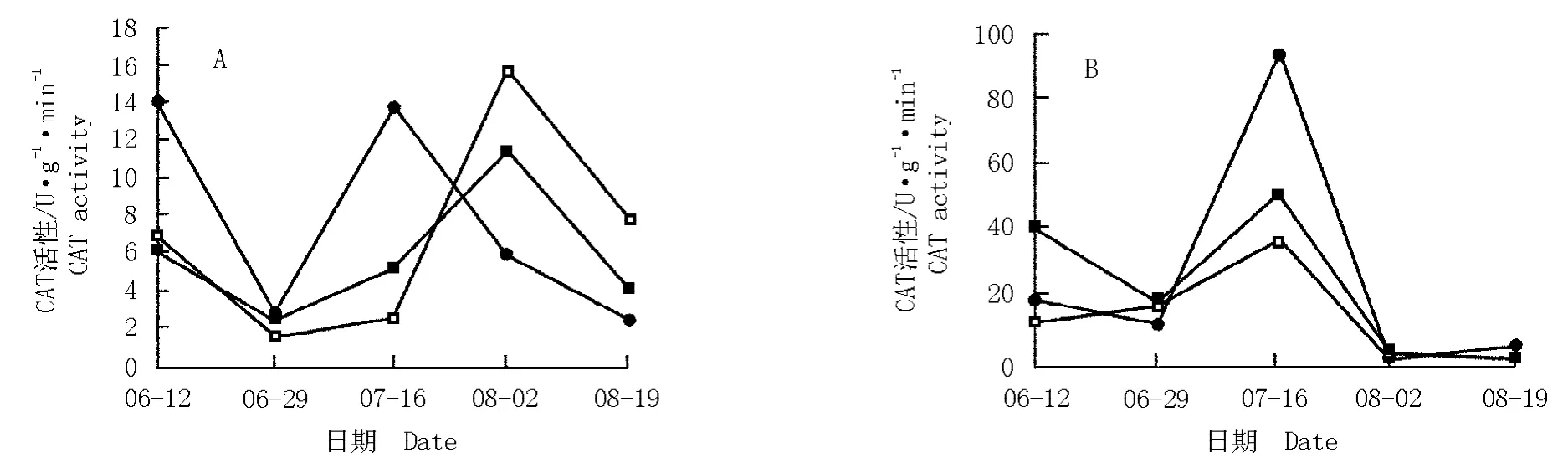
图3 土壤干旱条件下达乌里胡枝子(A)和铁杆蒿(B)叶片CAT 活性的动态变化Fig. 3 Dynamic change of CAT activity in leaves of Lespedeza daurica (Laxm.)Schindl.(A)and Artemisia sacrorum Ledeb.(B)under soil drought condition
2.1.4 对APX 活性的影响 土壤干旱胁迫条件下达乌里胡枝子和铁杆蒿叶片APX 活性的变化见图4。由图4-A 可见:在重度干旱胁迫条件下,达乌里胡枝子叶片APX 活性随处理时间的延长呈先急剧升高然后急剧降低的趋势,呈倒“V”型,最高值出现在7 月16 日;而在中度干旱及适宜水分(对照)条件下,随处理时间的延长,达乌里胡枝子叶片APX 活性均呈双峰型变化趋势,即先升高后降低再升高最后又降低的趋势,其中在7 月16 日达到谷值。总体上看,在干旱胁迫条件下达乌里胡枝子叶片APX 活性高于对照。
由图4-B 可见:在整个实验处理期间,铁杆蒿叶片APX 活性在中度干旱和适宜水分处理下均呈先升高再降低的趋势,最高值均出现在7 月16 日;而在重度干旱胁迫下,APX 活性在处理的前中期随处理时间延长呈平稳上升的趋势,在7 月16 日达到次峰值后降至谷值,在处理的末期急剧升至最高峰值。总体上看,在处理的前中期3 个处理组的APX 活性变化幅度不大,而在处理末期,在重度干旱条件下铁杆蒿APX 活性明显高于中度干旱及对照。说明在重度干旱胁迫后期,当铁杆蒿体内其他酶活性降低时APX 活性加强,是这个时期体内清除活性氧的主要作用酶。
2.1.5 对MDA 含量的影响 土壤干旱胁迫条件下达乌里胡枝子和铁杆蒿叶片MDA 含量的变化见图5。由图5 可见:在不同处理条件下,2 种植物叶片MDA含量的变化趋势相似,即随处理时间延长,MDA 含量先升高随后不同程度降低,均呈单峰曲线;但二者的MDA 含量水平及其峰值出现时间有一定差异。
由图5-A 可见:在处理前期,各处理组达乌里胡枝子叶片MDA 含量均无明显的变化,含量差异不明显;然后急剧增加并在7 月16 日达到峰值,其中对照组的峰值明显高于重度及中度干旱处理组;在处理的中后期各处理组达乌里胡枝子叶片MDA 含量逐渐减低并在末期达到最低值,3 个处理组的MDA 含量水平无明显差异。

图4 土壤干旱条件下达乌里胡枝子(A)和铁杆蒿(B)叶片APX 活性的动态变化Fig. 4 Dynamic change of APX activity in leaves of Lespedeza daurica (Laxm.)Schindl.(A)and Artemisia sacrorum Ledeb.(B)under soil drought condition
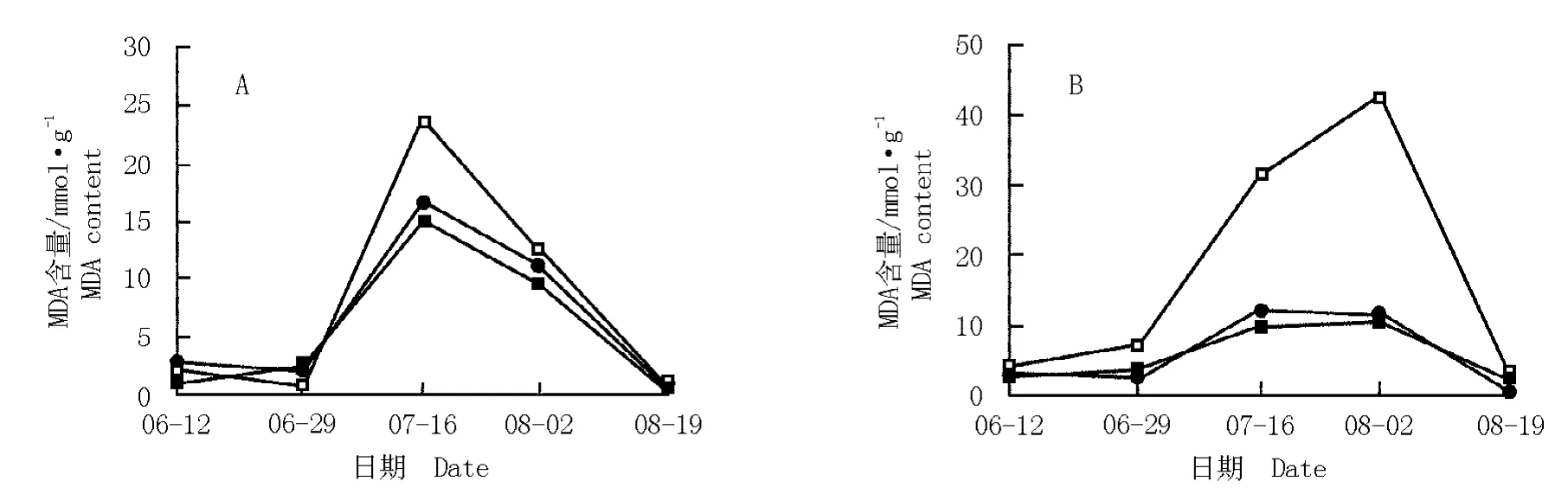
图5 土壤干旱条件下达乌里胡枝子(A)和铁杆蒿(B)叶片MDA 含量的动态变化Fig. 5 Dynamic change of MDA content in leaves of Lespedeza daurica (Laxm.)Schindl.(A)and Artemisia sacrorum Ledeb.(B)under soil drought condition
由图5-B 可见:在处理前期,各处理组铁杆蒿叶片MDA 含量均无明显的变化且含量水平差异不明显;而在处理中期,在中度干旱和适宜水分条件下铁杆蒿叶片MDA 含量略有上升但增幅不大,而在重度干旱条件下铁杆蒿叶片MDA 含量急剧升高并在8 月2 日达到峰值,其MDA 含量水平明显高于中度干旱及对照组;在处理末期,各处理组铁杆蒿叶片MDA 含量均降至最低且差异不大。
实验结果表明:在胁迫初期,供试2 种植物完全调动自身的调节能力,使其受干旱胁迫影响较小,各处理间MDA 含量差异不明显;随后当这种调节能力超过一定限度时,膜伤害程度加大(7 月中旬前后),MDA 在体内积累;但在胁迫后期启动了自身的抗氧化体系,使膜脂过氧化程度减轻,MDA 含量有所降低。
2.2 对叶片中渗透调节物质的影响
2.2.1 对游离脯氨酸含量的影响 土壤干旱胁迫条件下达乌里胡枝子和铁杆蒿叶片游离脯氨酸含量的变化见图6。由图6 可以看出:在重度干旱及适宜水分(对照)条件下,供试2 种植物叶片中的游离脯氨酸含量随处理时间的延长虽然呈现波动变化,但变幅不大。而在中度干旱条件下,在处理前中期2 种植物叶片游离脯氨酸含量与重度干旱及对照组的差异并不大;而在处理中后期(7 月16 日以后),2 种植物叶片游离脯氨酸含量明显高于重度干旱及对照组,其中达乌里胡枝子叶片游离脯氨酸含量在7 月16 日以后急剧增加,至实验结束时达到最高值,分别是对照和重度干旱处理组的 4.12 倍和 2.92 倍(图 6-A);而铁杆蒿叶片游离脯氨酸含量在7 月16 日以后呈现先急剧增加然后明显降低的趋势,但在实验结束时仍明显高于重度干旱及对照组(图6-B),表明不同植物对干旱胁迫的反应机制不同。总体上看,在不同处理条件下铁杆蒿叶片游离脯氨酸含量的变化趋势相似。

图6 土壤干旱条件下达乌里胡枝子(A)和铁杆蒿(B)叶片游离脯氨酸含量的动态变化Fig. 6 Dynamic change of free proline content in leaves of Lespedeza daurica (Laxm.)Schindl.(A)and Artemisia sacrorum Ledeb.(B)under soil drought condition
2.2.2 对可溶性蛋白质含量的影响 土壤干旱胁迫条件下达乌里胡枝子和铁杆蒿叶片可溶性蛋白质含量的变化见图7。由图7 可见:在土壤重度干旱、中度干旱及适宜水分(对照)条件下,达乌里胡枝子和铁杆蒿叶片可溶性蛋白质含量的变化规律基本相似,总体上随处理时间的延长均呈逐渐升高的趋势,且同一时期各处理组可溶性蛋白质含量差异不明显。
整体上看,3 个处理组达乌里胡枝子叶片中可溶性蛋白质含量在处理前期小幅下降然后逐渐增加,说明在胁迫前期蛋白质合成受阻,而在炎热的7 月,由于对干旱胁迫及气温升高的响应,其体内生理代谢产生变化与调整,导致蛋白质合成量增加或者诱导产生一些新蛋白质使可溶性蛋白质含量上升;而铁杆蒿叶片中可溶性蛋白质含量在胁迫初期稳定、在胁迫后期仅小幅变化,说明其对干旱胁迫有一定的耐性。
3 讨 论

图7 土壤干旱条件下达乌里胡枝子(A)和铁杆蒿(B)叶片可溶性蛋白质含量的动态变化Fig. 7 Dynamic change of soluble protein content in leaves of Lespedeza daurica (Laxm.)Schindl.(A)and Artemisia sacrorum Ledeb.(B)under soil drought condition
本实验结果表明:植物的保护酶系统和渗透调节机制对干旱胁迫的响应具有相互补偿的作用。由上述实验结果可以推测:总体上看,达乌里胡枝子和铁杆蒿在干旱胁迫中期主要依靠维持较高的保护酶活性来有效的清除细胞活性氧、抑制膜脂过氧化对细胞的伤寒,提高细胞抗氧化能力;而在胁迫后期,随胁迫时间的延长和胁迫强度的加剧,各种保护酶活性开始下降,2 种植物通过提高渗透调节能力抵抗干旱胁迫的伤害,即在胁迫后期通过增加游离脯氨酸的积累和加快可溶性蛋白质的合成启动抗旱渗透调节机制。在本实验中,2 种植物的MDA 含量在适宜水分下较高,与一般实验结果不符,这是否与植物种类有关则有待于进一步研究。综合分析结果表明:达乌里胡枝子和铁杆蒿2 种半灌木对中度干旱胁迫的生理响应能力最强,也表明作为黄土高原乡土植物,2 种植物自身具有独特的抗旱生物学及生态学特性,相同的生长环境及长期适应干旱胁迫使二者具备了相似的抗旱机制,体内形成一套较完善的抵御和适应干旱的能力;并在长期干旱条件下表现出极强的细胞膜稳定性,以抵御干旱胁迫对细胞造成的伤害,进而使达乌里胡枝子和铁杆蒿在黄土高原群落演替中占据优势,成为典型的优势群落,并在加快植被恢复进程和促进演替的正向发展中起重要作用。
[1]蒋明义,郭绍川. 水分亏缺诱导的氧化胁迫和植物的抗氧化作用[J]. 植物生理学通讯,1996,32(2):144-150.
[2]单长卷,韩蕊莲,梁宗锁. 黄土高原冰草叶片抗坏血酸和谷胱甘肽合成及循环代谢对干旱胁迫的生理响应[J]. 植物生态学报,2011,35(6):653-662.
[3]吴志华,曾富华,马生健,等. 水分胁迫下植物活性氧代谢研究进展(综述Ⅱ)[J]. 亚热带植物科学,2004,33(3):77-80.
[4]王 齐,孙吉雄,安 渊. 水分胁迫对结缕草种群特征和生理特性的影响[J]. 草业学报,2009,18(2):33-38.
[5]李景欣,云锦凤,苏布道,等. 几个不同种群冰草的抗旱性比较研究[J]. 干旱区资源与环境,2004,18(5):163-167.
[6]罗新义,谭大海,沙 伟. 渗透胁迫对冰草保护酶系统活性的影响[J]. 齐齐哈尔大学学报:自然科学版,2005,21(4):94-96.
[7]孙卫红,王伟青,孟庆伟. 植物抗坏血酸过氧化物酶的作用机制、酶学及分子特性[J]. 植物生理学通讯,2005,41(2):143-147.
[8]安玉艳,梁宗锁,韩蕊莲,等. 土壤干旱对黄土高原3 个常见树种幼苗水分代谢及生长的影响[J]. 西北植物学报,2007,27(1):91-97.
[9]刘红云,梁宗锁,刘淑明,等. 持续干旱及复水对杜仲幼苗保护酶活性和渗透调节物质的影响[J]. 西北林学院学报,2007,22(3):55-59.
[10]康俊梅,杨青川,樊奋成. 干旱对苜蓿叶片可溶性蛋白的影响[J]. 草地学报,2005,13(3):199-202.
[11]赵黎芳,张金政,张启翔,等. 水分胁迫下扶芳藤幼苗保护酶活性和渗透调节物质的变化[J]. 植物研究,2003,23(4):437-442.
[12]王改利,魏 忠,贺少轩,等. 土壤干旱胁迫对酸枣叶片黄酮类代谢及某些生长和生理指标的影响[J]. 植物资源与环境学报,2011,20(3):1-8.
[13]高俊凤. 植物生理实验指导[M]. 北京:高等教育出版社,2006.

