坛紫菜叶状体营养细胞与生殖细胞叶绿素荧光特性比较
李家富,张 涛,陆勤勤,朱建一,沈宗根,刘兆普,王长海
(1.南京农业大学 资源与环境科学学院,江苏 南京 210095;2.常熟理工学院 应用技术研究院,江苏 常熟 215500;3.江苏省海洋水产研究所,江苏 南通 226007)
坛紫菜(Porphyra haitanensis)是我国特有的暖温带物种,也是我国东南沿海广泛栽培的重要经济红藻。坛紫菜藻体由壳孢子萌发生长而成,藻体属单倍体,具配子体性质。坛紫菜藻体营养细胞生长分布均匀,有性生殖器官分为果胞和精子囊器,一般由藻体的末梢边缘部分营养细胞转化而来,精子囊器细胞在形成时,颜色逐渐淡化呈现白色或黄白色;果胞及受精分裂形成的果孢子囊中细胞颜色较营养细胞深,呈深紫红色[1]。紫菜叶状体生长在潮间带,前人对叶状体营养细胞和生殖细胞的生长特性进行了研究[2-3],对生殖细胞的生理特征主要是对条斑紫菜和半叶紫菜进行了研究[4]。
叶绿素荧光技术在研究PSII对光能的吸收、分配、耗散等方面具有独特优势,能够快速、准确、无损伤地检测植物光合电子传递能力等“内在性”特征,是光合作用尤其是 PSII功能研究的天然探针[5]。调制荧光技术首先应用在高等植物PSII原初反应和猝灭分析中,是研究光合生理特性的重要方法[6-7],在大型藻类中的应用则较晚,但已有研究表明该技术也能客观反映藻类光合特性[8-13]。
本文以坛紫菜叶状体为材料,对不同生殖细胞及营养细胞叶绿素荧光特性进行了研究,以求进一步了解紫菜叶状体发育过程中的光合特性。
1 材料与方法
1.1 试验材料
用于测试的坛紫菜(图 1)于 11月采自江苏省南通紫菜栽培海区,2 h内带回实验室,挑选健康完整藻体进行预培养,海水暗沉淀,培养温度为 15℃,光照强度为50 µmol/(m2·s)。预培养1 d后进行叶绿素荧光等指标的测定,实验进行3次重复测定,测定区域如图1序号标示。
1.2 试验方法
1.2.1 实际量子效率的测定

图1 坛紫菜Fig.1 Porphyra haitanensis
样品 PSII实际量子效率采用 Water-PAM(Walz,Effeltrich,Germany)进行测定。将探头垂直对准藻体不同生殖细胞或营养细胞部位,首先利用0.3 μmol /(m2·s)调制红光和 64 μmol /(m2·s)光化光,测得该光照条件下荧光值(Ft);随后提供 0.8 s约4 000 μmol /(m2·s)饱和脉冲光,测得此光化光条件下最大荧光值(Fm′)。按以下公式计算 PSII实际量子效率(ΔF/Fm′):

1.2.2 快速光曲线的测定
对样品依次提供0至1 020 μmol /(m2·s)共8个光强梯度,待不同光强下荧光值(Ft)达到稳定后(约20 s),提供 0.8 s约 4 000 μmol /(m2·s)的饱和脉冲光以测得该光强下最大荧光(Fm′),按以下公式计算相对电子传递速率(rETR):

式中,I表示光照强度;A表示样品的吸光系数,本文中设定为0.85;0.5表示光能由两个光系统平均分配。
以光照强度作为X轴,rETR为Y轴制作曲线即快速光曲线。参照 Platt等的方法,对快速光曲线进行拟合,分别获得初始斜率、最大相对电子传递速率、半饱和光强等参数:

式中,P表示给定光强下的相对电子传递速率(rETR);α表示快速光曲线初始斜率;Pm表示最大相对电子传递速率(rETRmax)。
按以下公式计算半饱和光强(Ik):

1.2.3 qP和NPQ的测定
样品暗适应20 min后,经远红光照射20 s,然后打开测量光,测得最小荧光值(Fo);然后提供0.8 s饱和脉冲光,测定最大荧光值(Fm);随后关闭光源,40 s后打开活化光(64 μmol /(m2•s)),之后每隔 20 s照射一次饱和脉冲光,直至该活化光下最大荧光值(Fm′)达到稳定。由以下公式计算光化学猝灭(qP)和非光化学猝灭(NPQ):
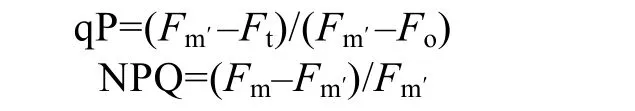
1.3 统计分析
实验数据采用 t-检验分析,显著水平设为P<0.05。
2 实验结果
2.1 营养细胞与生殖细胞实际量子效率差异
在给定的光强下,坛紫菜雌雄藻体营养细胞的△F/Fm′值非常接近,均维持在0.45左右(图2)。雌藻体营养细胞与雌性生殖细胞的△F/Fm′值无显著差异,但雄藻体营养细胞△F/Fm′值显著高于雄性生殖细胞(P<0.05)。雌、雄生殖细胞间△F/Fm′值存在差异,雌性生殖细胞△F/Fm′值显著高于雄性生殖细胞(P<0.05)。
2.2 营养细胞与生殖细胞快速光曲线比较
快速光曲线(RLC)的测定结果表明,随着光照强度的提高,样品相对电子传递速率(rETR)逐步上升,随后达到一个相对平稳的阶段(图3)。雌、雄藻体营养细胞的 RLC没有明显差异,rETR在光照强度为400 μmol /(m2·s)左右均达到稳定阶段,并维持在11至 15之间。雌性生殖细胞与营养细胞RLC存在一定差异,营养细胞的rETR略高于生殖细胞,但差异不显著。雄藻体营养细胞的rETR明显高于雄性生殖细胞,当光强超过 200 μmol /(m2·s),营养细胞的rETR显著高于雄性生殖细胞(P<0.05)。由生殖细胞RLC的比较可知,雌性生殖细胞RLC略高于雄性生殖细胞,但差异不显著。
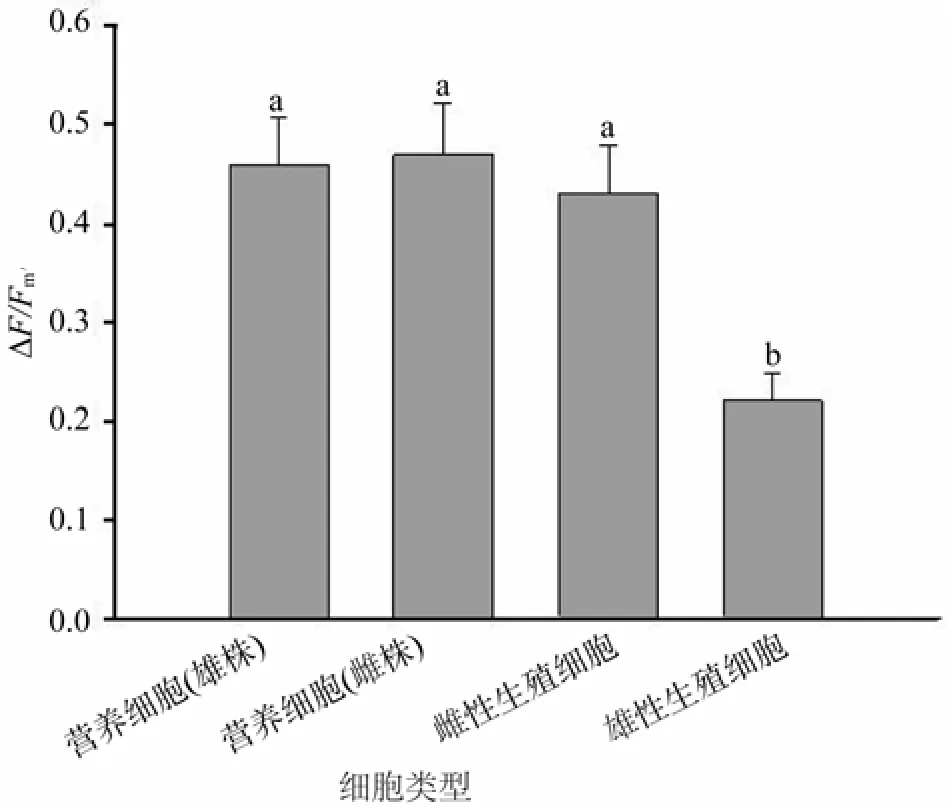
图2 营养细胞与生殖细胞实际量子效率比较Fig.2 Compare of yield between vegetative and germ cells of P.haitanensis
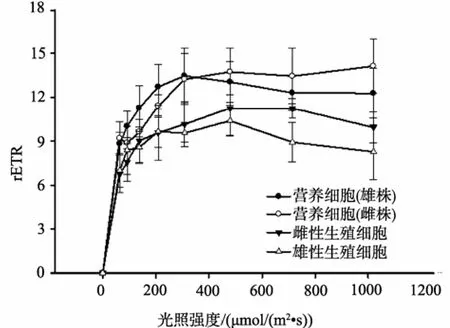
图3 营养细胞与生殖细胞快速光照曲线比较Fig.3 Compare of rapid light curves between vegetative and germ cells of P.haitanensis
通过对RLC拟合,获得了初始斜率(α)、相对最大电子传递速率(rETRmax)和半饱和光强(Ik)等能够反映样品光合作用实际状态的重要参数。从表1可见,雌藻体营养细胞与生殖细胞 α、rETRmax和 Ik等参数比较均无显著差异;雄藻体营养细胞 α和rETRmax均显著高于雄性生殖细胞(P<0.05),Ik无显著差异;雌性生殖细胞 α显著高于雄性生殖细胞(P<0.05),但rETRmax和Ik无显著差异。
2.3 营养细胞与生殖细胞qP和NPQ比较
诱导曲线的测定是通过对样品反应中心吸收的光能分配进行测定分析,计算光化学猝灭(qP)和非光化学猝灭(NPQ或 qN)[14]。qP反映 PSII原初电子受体QA的还原状态,qP值越大则PSII电子传递活性越高[15]。考虑到测定的简便性,本试验使用NPQ作为反映非光化学猝灭的指标。从表 2可见,在 64 μmol /(m2•s)活化光条件下,雌藻体营养细胞与雌性生殖细胞 rETR、qP和NPQ均无显著差异,但雌藻体营养细胞、雌性生殖细胞和雄藻体营养细胞rETR和qP均显著高于雄性生殖细胞,NPQ则无显著差异。
3 讨论
叶绿素荧光技术在植物光合生理研究中已有广泛的应用,能够客观反映光合生物自身的光合特性及环境适应能力[16-18]。通过叶绿素荧光测定方法中的快速光曲线(RLC)和诱导曲线的测定,可从多个角度研究样品对光能的利用能力及对吸收光能的分配特征。本研究表明,坛紫菜雌、雄藻体营养细胞叶绿素荧光参数间均无显著差异,说明无论是雌藻体还是雄藻体,其营养细胞的光能实际利用效率、光合电子传递能力及对光强的适应能力等较为一致。

表1 营养细胞与生殖细胞快速光曲线参数比较Tab.1 Compare of rapid light curve parameters between vegetative and germ cells of P.haitanensis

表2 营养细胞与生殖细胞qP和NPQ比较Tab.2 Compare of induction curve parameters between vegetative and germ cells of P.haitanensis
尽管雌性生殖细胞结构形态和藻体颜色上与营养细胞存在差异,我们的试验结果表明二者的叶绿素荧光特征并无明显不同,雌藻体营养细胞ΔF/Fm′和α、rETRmax和Ik等参数仅略高于雌性生殖细胞,但差别并没有达到显著水平,雄藻体营养细胞与雌性生殖细胞的光合荧光参数同样差异不显著,这说明雌性生殖细胞与雌、雄藻体营养细胞光能利用能力相似。
光合色素的含量与细胞光合活性密切相关,光合色素含量较高通常会使得细胞光能利用能力提高[19-21],这种联系可能也是导致雄性生殖细胞叶绿素荧光参数与营养细胞间显著差异的重要原因,雄性生殖细胞对光能的利用能力明显低于营养细胞,且在给定光照条件下,雄性生殖细胞的实际量子效率也低于营养细胞。雄性生殖细胞rETRmax显著低于营养细胞,而 Ik没有明显区别,这说明在给定光照条件下,雄性生殖细胞相对电子传递速率较营养细胞低,但二者对光照强度的适应能力相似。上述结果与光合色素含量的研究相一致,即雄性生殖细胞色素较营养细胞和雌性生殖细胞明显浅淡,稍带黄、白色,这种颜色的差异是因为细胞间光合色素含量和比例的不同所引起的[22]。诱导曲线的测定结果表明,在给定活化光条件下,营养细胞rETR和qP均显著高于雄性生殖细胞,即雄性生殖细胞电子传递速率和光化学猝灭均处较低水平,其吸收的光能用于光合电子传递部分明显低于营养细胞。雄性生殖细胞NPQ与营养细胞相似,该参数与光适应能力相关。结合ΔF/Fm′、RLC和诱导曲线的测定结果,推知在不同光照强度下,雄性生殖细胞所吸收的光能用于光合电子传递所占比例明显低于营养细胞,而用于热耗散的比例明显高于营养细胞,雄性生殖细胞的这种高热耗散比例可能是其光适应能力与营养细胞相似的主要原因,通过提高将吸收的光能以热耗散的形式消耗,从而适应环境光照强度。
[1]王素娟,裴鲁青,段德麟.中国常见海藻超微结构[M].宁波: 宁波出版社,2004.
[2]Lin A P,Wang G C,Yang F,et al.Photosynthetic parameters of sexually different parts of Porphyra katadai var.hemiphylla (Bangiales,Rhodophyta)during dehydration and rehydration[J].Planta,2009,229: 803-810.
[3]Yang R L,Zhou W,Shen S D,et al.Morphological and photosynthetic variations in the process of spermatia formation from vegetative cells in Porphyra yezoensis Ueda (Bangiales,Rhodophyta)and their responses to desiccation [J].Planta,2012,135(5): 885-893.
[4]杨睿灵,乔洪金,周伟,等.条斑紫菜叶状体不同区域光合活性的研究[J].海洋科学,2011,8: 63-66.
[5]Schreiber U,Bilger W,Neubauer C.Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis[C]// Schulze E D,Caldwell M M.Ecophysiology of Photosynthesis.Springer-Verlag,Berlin,1995: 49-70.
[6]张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999,16: 444-448.
[7]Henley W J,Levavasseur G,Franklin L A,et al.Photoaccllimation and photoinhibition in Ulva rotundata as influenced by nitrogen availability [J].Planta,1991,184: 235-243.
[8]Hanelt D.Photoinhibition of photosynthesis in marine macrophytes of the South Chinese Sea [J].Mar Ecol Progr Ser,1992,82: 199-206.
[9]Herbert S K.Fluorescence characteristics of photoinhibition and recovery in a sun and shade species of the red algal genus Porphyra[J].Plant Physiol,1988,86:946- 951.0
[10]Zhang T,Shen Z,Xu P,et al.Analysis of photosynthetic pigments and chlorophyll fluorescence characteristics of different strains of Porphyra yezoensis[J].J Appl Phycol,2011,DOI 10.1007/s10811-011-9708-x.
[11]张涛,沈宗根,姚春燕,等.基于叶绿素荧光技术的紫菜光适应特征研究[J].海洋学报,2011,33:140-147.
[12]姚春燕,张涛,姜红霞,等.条斑紫菜不同品系藻体光合色素及叶绿素荧光参数比较[J].南京师大学报(自然科学版),2010,33(2): 81-86.
[13]赵小波,张学成,许璞.不同品系条斑紫菜光合效率比较研究[J].中国海洋大学学报(自然科学版).2010,40(2): 57-62.
[14]Schreiber U,Bilger W,Neubauer C.Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis[C]//Schulze E-D,Caldwell M M .Ecophysiology of Photosynthesis.Springer-Verlag,Berlin,1995: 49-70.
[15]韩博平,韩志国,付翔.藻类光合作用机理与模型[M].北京: 科学出版社,2003: 59.
[16]张其德,卢从明,张启峰,张世平.几组杂交组合的杂交稻及其亲本光合特性的比较研究[J].生物物理学报,1996,12 (3): 511-516.
[17]Schreiber U.Pulse-amplitude (PAM)fluorometry and saturation pulse method[C]//Papageorgiou G G.Chlorophyll fluorescence: A Signature of Photosynthesis.Advances in Photosynthesis and Respiration Series,Kluwer Academic Publishers,Dordrecht,The Netherlands,2004: 100-125.
[18]White A J,Critcley C.Rapid light curves: a new fluorescence method to assess the state of the photosynthetic apparatus [J].Photosynth Res,1999,59: 63-72.
[19]周百成,武宝轩,曾呈奎,等.条斑紫菜的色素系统和光合作用的差异性[J].植物生物学,1966,9:427-429.
[20]Li Y,Wang G,Xu P,et al.Induction and characterization of green pigmentation mutant in Porphyra yezoensis Ueda [J].Aquacult,2008,282: 117-123.
[21]潘光华.不同性别来源的半叶紫菜华北变种和坛紫菜的生长发育以及生化特征比较[D].青岛: 中国海洋大学,2006.
[22]张学成,秦松,马家海,等.海藻遗传学[M].北京:中国农业出版社,2004: 184-225.

